硫氧还蛋白对缺氧/复氧人脐静脉内皮细胞的保护作用
苏 伟 高 枫 孙茂民 江家贵 (南京中医药大学无锡附属医院,江苏 无锡 2400)
正常生理状态下,内皮细胞可分泌多种血管活性物质,调节血管收缩与舒张。当内皮损伤时,氧自由基生成增加,舒血管物质如前列环素(PGI2)和内皮源性舒血管因子〔(EDRF,即一氧化氮(NO)〕等释放减少,而内皮素(ET)、血栓素A2(XA2)等缩血管物质释放增多。血管内皮细胞(VECs)损伤是动脉硬化发生的始动环节〔1〕,当VECs受损时,可导致血压增高、动脉硬化等疾病〔2〕。硫氧还蛋白(TRX)是机体内重要的氧化还原调节蛋白,Mr为12 kD,在体内分布广泛,具有多种生物学功能〔3〕。研究证实,硫氧还蛋白参与机体的氧化还原反应,影响细胞的增殖和生存,调节多种转录因子的活性,参与某些组织的应激反应。近年来,TRX在心血管系统疾病中的作用也日益受到人们关注。我们在试验中发现人内皮细胞株ECV304没有硫氧还蛋白的表达。本文对TRX基因修饰的ECV304细胞进行缺氧/复氧实验,探讨TRX其对内皮细胞的保护作用。
1 材料与方法
1.1 材料 ECV340(购自中科院上海细胞所),ECV304/TRX细胞株系本室构建,胎牛血清(杭州四季清),1640培养基(Gibco公司),胰酶(Sigma公司),噻唑蓝(MTT,Sigma公司产品)。丙二醛(MDA)及NO检测试剂盒(南京建成生物有限公司产品),ET检测试剂盒(华美生物有限公司产品)。
1.2 细胞分组及缺氧/复氧模型的建立 将不同内皮细胞分为3组:ECV304/TRX组、pcDNA3.0空载体转染组(空载体组)及正常对照组(ECV304组),参照文献〔4〕对前两组细胞进行缺氧实验,同时设置未缺氧的ECV304细胞作为对照组。
2 结果
2.1 TRX对缺氧/复氧的内皮细胞内MDA的影响 ECV304组,其细胞内的MDA含量在24 h内变化不大;空载体组,在缺氧3 h时,MDA含量显著增加,复氧12 h时,MDA含量达到最高,然后缓慢下降;ECV304/TRX组与空载体组相比,在缺氧3 h及复氧12 h时,MDA含量极显著下降(P<0.01),而在24 h MDA水平下降显著(P<0.05)。见表1。
2.2 TRX对缺氧/复氧的内皮细胞释放NO的影响 ECV304组,其细胞内的NO含量在24 h内变化不大;空载体组细胞在缺氧3 h时,NO含量显著下降,复氧12 h时,NO含量下降到最低,然后缓慢上升;ECV304/TRX组与空载体组相比,在缺氧3 h及复氧12 h时,NO含量极显著上升(P<0.01),在12 h时 NO水平最高。ECV304/TRX组与ECV304组相比,在12 h时,有显著差异。见表2。
2.3 TRX对缺氧/复氧的内皮细胞释放 ET-1的影响 ECV304组,其细胞内的ET-1含量在24 h内变化不大;空载体组,在缺氧3 h,细胞内ET-1含量迅速上升,复氧12 h时,ET-1含量上升最高;ECV304/TRX组与空载体组相比,ET-1水平在复氧的各时间点均比有下降,在复氧24 h下降最明显(P<0.01)。见表3。
表1 TRX对缺氧/复氧不同时间点内皮细胞MDA的影响(±s,μmol/L)

表1 TRX对缺氧/复氧不同时间点内皮细胞MDA的影响(±s,μmol/L)
与转染空载体组比较:1)P<0.01,2)P<0.05
组别0.54±0.02 0.72±0.03 1.03±0.07 1.24±0.10空载体组 0.56±0.04 5.64±0.17 8.38±0.08 3.15±0.07 ECV304/TRX组 0.49±0.05 1.96±0.041)2)3.42±0.031)2.62±0.032)0 h 3 h 12 h 24 h ECV304组
表2 TRX对缺氧/复氧不同时间点内皮细胞NO的影响(±s,μmol/L)
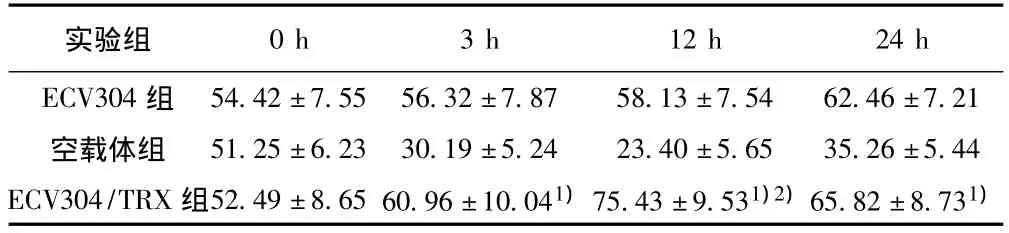
表2 TRX对缺氧/复氧不同时间点内皮细胞NO的影响(±s,μmol/L)
与空载体组比较:1)P<0.01;与ECV304组比较:2)P<0.05
实验组0 h 3 h 12 h 24 h ECV304组 54.42±7.55 56.32±7.87 58.13±7.54 62.46±7.21空载体组 51.25±6.23 30.19±5.24 23.40±5.65 35.26±5.44 ECV304/TRX组52.49±8.65 60.96±10.041)75.43±9.531)2)65.82±8.731)
表3 TRX对缺氧/复氧不同时间点内皮细胞ET-1的影响(±s,μmol/L)

表3 TRX对缺氧/复氧不同时间点内皮细胞ET-1的影响(±s,μmol/L)
与空载体组及ECV304组比较:1)P<0.01
实验组0 h 3 h 12 h 24 h ECV304组 10.52±2.12 10.42±2.15 10.63±2.09 10.24±2.10空载体组 10.48±2.11 50.56±10.04 56.64±10.17 52.38±9.08 ECV304/TRX组 10.32±2.13 30.49±5.251)25.96±5.441)22.42±4.831)
3 讨论
内皮细胞覆盖在血管内膜表面,具有多种重要的生理功能,参与机体的凝血、免疫、物质转运和生物活性物质释放等过程。在缺氧及缺氧复氧中,内皮细胞是组织中受攻击的第一靶器官,其中内皮源性的舒血管因子和缩血管因子的分泌调节功能更是最先受损〔5〕。缺氧/复氧后活性氧产生可以透过细胞膜,在膜外与Fe2+或Cu2+生成羟自由基,从而引发脂质过氧化(LPO)而导致损伤,羟自由基在缺氧再复氧损伤中起核心作用〔6〕。一旦内皮细胞受损,其分泌血管活性物质的功能将发生改变,通过测定VECs分泌的血管活性物质,可判断内皮细胞功能,NO就是VECs损伤的敏感的标志物〔7〕。当ECV中氧自由基过多时,其与NO作用,生成一些硝基化合物,使NO减少。
本实验说明缺氧损伤内皮,使内皮依赖性的血管舒缩功能紊乱,而复氧后进一步加重缺氧带来的损伤,且缺氧及缺氧复氧带来的损伤至少可持续至复氧后12 h,复氧24 h后内皮依赖的血管舒缩活性有所恢复但未能完全恢复。
氧自由基大量产生是目前公认的缺氧及缺氧复氧造成细胞损伤的主要机制之一〔8〕。本研究发现,除氧自由基外,缺氧及缺氧复氧还可通过其他机制抑制内皮细胞NO、ET的生成。缺氧及缺氧复氧可直接作用于(NO)合成的限速酶一氧化氮合酶(NOS),使其活性下降〔9〕;还引起生成NO的底物 L-精氨酸大量耗竭,使L-精氨酸跨膜转运障碍,使NO生成减少〔10〕。同样,缺氧及缺氧复氧可直接作用于ET基因,使ET转录增加;缺氧及缺氧复氧还刺激凝血系统,使凝血酶生成增加,通过凝血酶刺激 ET 大量生成〔11,12〕。
TRX能升高缺氧-复氧环境下ECV中NO的释放,可能是通过降低缺氧/复氧ECV产生氧自由基的量,减少氧自由基对NO的灭活;同时,TRX也可能通过活化NOS,使NO含量显著升高而抗ECV损伤。
1 叶希韵,王耀发.山楂叶总黄酮对血管内皮细胞氧化损伤的保护作用〔J〕.中国现代应用药学杂志,2002;19(4):265-8.
2 Valcrie BS,Paul MY.Endothelin-1:a potent vascular peptide〔J〕.Pharmacol Toxicol,1991;69(5):303-7.
3 Powis G,Montfort WR.Properties and biological activities of thioredo-xins〔J〕.Ann Pharmacol Toxicol,2001;41(1):261-95.
4 Tamatani M,Mitsuda N,Matsuzaki H,et al.A pathway of neuronal apoptosis induced by hypoxia/reoxygenation:roles of nuclear factor-kappaB and Bcl-2〔J〕.J Neurochem,2000;75(2):683-93.
5 Peter CK,Young DK.Heparin preserves nitric oxide activity in coronary endothclium during ischemia-reperfusion injury〔J〕.Ann Thorac Surg,1998;66(4):1210-5.
6 Beyer CE,Steketee JD,Saphier D.Antioxidant properties of melatonin an emerging mystery〔J〕.Biochem Pharmacol,1998;56(10):1265-72.
7 杨青华,林水金,杨映波.NO在血管内皮细胞损伤中的标志作用〔J〕.急诊学,1999;8(3):236-8.
8 Li C,Jackmn RM.Reactive species mechanisms of cellular hypoxia-reoxygenation injury〔J〕.Am J Physiol Cell Physiol,2002;282(2):C227-41.
9 Mcqullian LP.Hypoixia inhibits expression of enos via transcription and posttranscriptional mechanisms〔J〕.AM J Physiol,1994;267:H1921.
10 Hecker M.The mechanism of L-arginine and its significance for the biosynthesis of endothelium derived factor,cultured endothelial cells recycle L-citrulline to L-arginine〔J〕.Proc Natl Sci USA,1990;87:8612.
11 Medbo S,Beisvag V,Tollofsmd P,et al.Attenuated endothelin-1 mRNA expression with endothelin-1 receptor blockade during hypoxaemia and reoxygenation in newborn piglets〔J〕.Acta Paediatrica Int J Pacdiatr,2000;89(6):698-702.
12 Bodi I,Bishopric NH,Dischcr DJ,et al.Cell-specificity and signaling pathway of endothelin-1 gene regulation by hypoxia〔J〕.Cardiovasc Res 1995;30(6):975-84.

