糖尿病人群HbA1c控制水平对血清Hcy、hs-CRP水平的影响
崔建娇 张一兵 张立坤 桂晓巍 陈冬梅 (辽宁医学院附属第三医院检验科,辽宁 锦州 121000)
糖化血红蛋白(HbA1c)不仅是糖尿病(DM)理想的血糖控制和规范治疗金标准〔1〕,在近期又被美国DM协会(ADA)等组织推荐为诊断糖尿病的优先方法〔2〕。与此同时糖化血红蛋白(HbA1c)与DM并发症相关性,延缓并发症的出现一直是研究的重点。在DM人群中,同型半胱氨酸(Hcy)、超敏C反应蛋白(hs-CRP)的浓度不仅与DM的控制水平有关,并且与微血管病变〔3〕、大血管病变以及糖尿病并发症的发生具有密切关系〔4,5〕。所以按照患者HbA1c的控制水平将其分为4个等级,同时检测分级后DM患者血清中的 Hcy、hs-CRP的浓度,根据HbA1c的控制水平与Hcy、hs-CRP的浓度相关性作为实验基础加以论述和分析,以便在较早对糖尿病并发症的预测、诊断的基础上,推迟、控制和治疗并发症的发生。
1 资料与方法
1.1 一般资料
1.1.1 正常对照组 选择我院健康体检中心正常老年体检者24例(男12例,女12例),年龄60~69岁,平均(64.8±2.9)岁,按照1999年WHO公布的糖尿病诊断标准检测空腹血糖排除糖尿病。
1.1.2 DM组 从2011年1月至2012年9月,选择按照1999年WHO公布的糖尿病诊断标准新确诊的DM患者82例(男44例,女38例),年龄60~68〔平均(64.1±2.7)〕岁。
1.1.3 选择新发病例 是为了避免长时间患有糖尿病的人群由于血糖控制不良或者血脂异常以及肾脏损害导致其体内的Hcy、hs-CRP浓度升高。以上入组人员均无肾脏疾病、无高脂血症、无感染性疾病。
1.2 实验方法
1.2.1 分组 除正常对照组外,疾病组按照1年内HbA1c的平均水平分为四组。HbA1c 4% ~6.6%为Ⅰ组,HbA1c 6.6% ~8%为Ⅱ组,HbA1c 8% ~10%为Ⅲ组,HbA1c 10%以上Ⅳ组。
1.2.2 样品采集及处理方法 采集实验对象静脉血标本EDTA-K2抗凝,全血低温保存。采集实验对象静脉血标本使用带有分离胶的促凝管立刻离心分离血清,分别用于Hcy、hs-CRP的检测。
1.2.3 仪器、试剂 HbA1c检测使用美国普莱默斯HPLC检测系统及定标液、质控液、配套试剂;Hcy检测使用雅培i1000全自动免疫发光分析仪及定标液、质控液、配套试剂;hs-CRP检测使用美国贝克曼特种蛋白仪及定标液、质控液、配套试剂;生化检测使用HITACHI全自动生化分析仪及宁波瑞源生化试剂。
1.3 统计学分析 以SPSS 13.0统计分析软件分析数据。定量资料以±s表示,多组间比较采用方差分析。将HbA1c的控制水平与Hcy、hs-CRP的浓度作相关性分析。
2 结果
2.1 各组HbA1c、Hcy、hs-CRP水平比较 正常对照组与 DM组的HbA1c、Hcy、hs-CRP浓度差异有统计学意义(P<0.01)。见表1。疾病组按照HbA1c的控制水平分成4组后Hcy、hs-CRP浓度组间比较差异有统计学意义。见表2。
疾病组按照HbA1c的控制水平分成4组后Hcy浓度各组间两两比较,除Ⅱ组和Ⅲ组、Ⅲ组和Ⅳ组外,其他各组间结果差异有统计学意义(P<0.05,P<0.01)。见表3。
疾病组按照HbA1c的控制水平分成4组后hs-CRP浓度各组间两两比较,除Ⅱ组和Ⅲ组、Ⅱ组和Ⅳ组外,其他各组间结果差异有统计学意义(P<0.05,P<0.01)。见表4。
2.2 相关性分析 HCY(Y1)、hs-CRP(Y2)的浓度与 HbA1c(X)的控制水平有相关性,回归方程分别为Y1=1.063X+1.070(R=0.779,P=0.000);Y2=-1.409X+0.573(R=0.810,P=0.000)。见表5。
表1 正常对照组与疾病组各项指标的比较(±s)

表1 正常对照组与疾病组各项指标的比较(±s)
组别 n HbA1c(%) Hcy(μmol/L) hs-CRP(mg/L)对照组24 5.38±0.53 5.24±1.55 1.28±0.29疾病组 82 8.52±2.53 10.65±3.01 3.59±1.77 t值 6.02 8.46 6.34 P值0.00 0.00 0.00
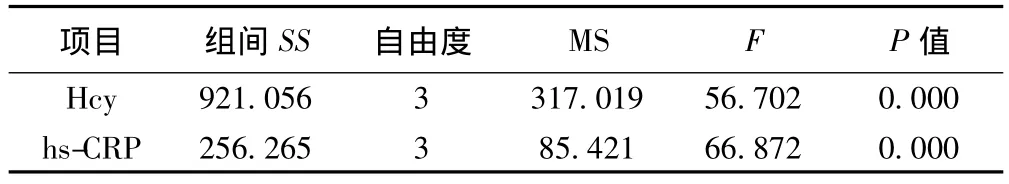
表2 四组Hcy、hs-CRP浓度比较
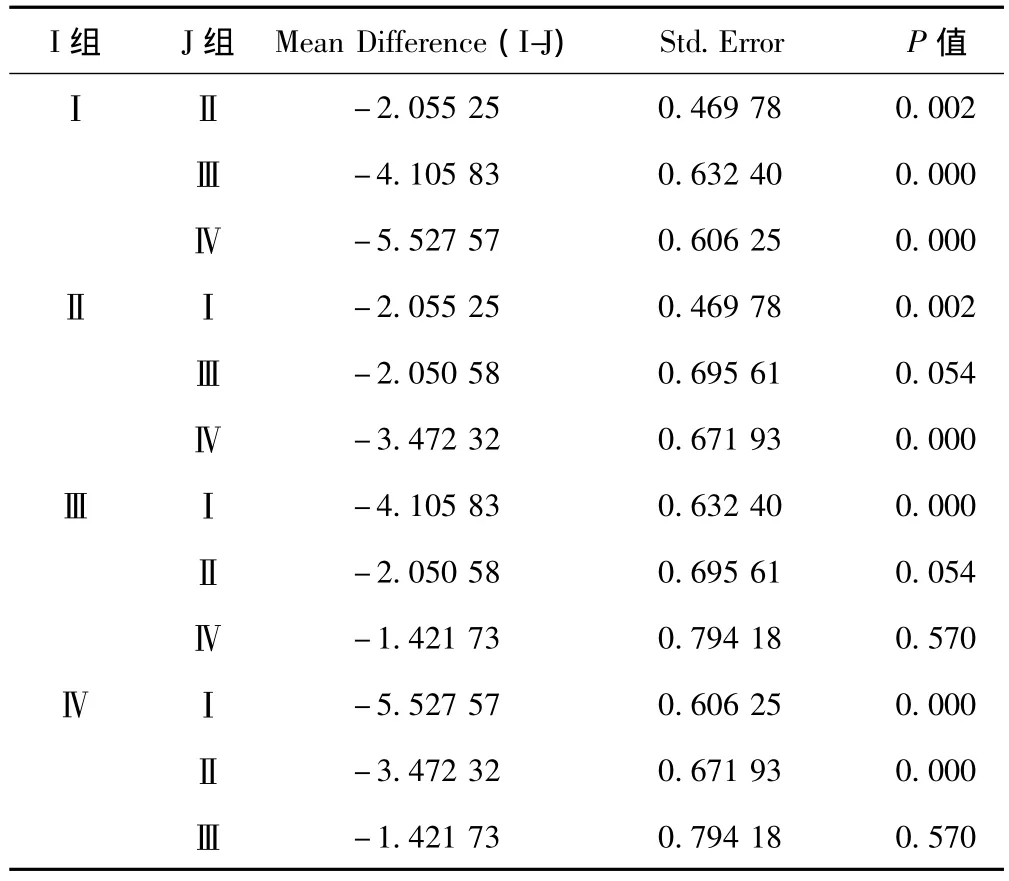
表3 四组Hcy浓度各组间两两比较

表4 四组hs-CRP浓度各组间两两比较结果

表5 HCY、hs-CRP的浓度与HbA1c的控制水平的相关性
3 讨论
HbA1c是由葡萄糖的游离醛基与HbA的β链N末端氨基酸的氨基进行不可逆的非酶促反应,HbA1c的浓度主要有血糖的浓度及葡萄糖与Hb接触的时间,它能够较稳定的反映1个人近2~3个月的血糖水平。Jesudason等〔6〕认为2型DM患者中患心血管疾病的风险与HbA1c及空腹血糖有关,HbA1c可以预测非DM患者群的心血管疾病。Gustavsson等〔7〕研究发现,在已知的冠心病患者中,低水平的炎性参数(如C反应蛋白)不仅在DM患者中升高,而且在HbA1c正常的非DM个体中,也随着HbA1c测定值的增加而增加,说明HbA1c与炎性参数之间存在一定的关系并对心血管疾病的发生发展起着预示作用。
随着对DM及其并发症发病机制研究的深入,越来越多的研究显示 DM是由炎症因子介导的慢性炎症性疾病〔8〕。而hs-CRP可以作用于血管内皮细胞从而诱导各种黏附分子如血管细胞黏附分子-1、细胞间黏附分子-1单核细胞趋化因子-1〔9〕、E选择素等的表达增加炎症的进展〔10〕。本次实验以及以往的研究显示,DM患者hs-CRP显著增高,是预测2型糖尿病发病的独立危险因素,其水平增高与大血管病变、微血管病变等并发症密切相关,而这些心血管疾病的发生均与内皮功能失调有关〔11〕。
Hcy是一种含硫非必需氨基酸,是蛋氨酸代谢的中间产物。研究已经证明Hcy作为心血管疾病的独立危险因素,可能通过多种机制引起血管内皮细胞功能损伤,最主要的通过氧化应激机制导致一氧化氮浓度降低及功能减退〔12〕;同时通过内质网应激机制诱导细胞凋亡、未折叠蛋白反应、影响脂质代谢、促进炎性介质释放等其他机制最终导致VEC功能损伤〔13〕。由于Hcy能够导致血管内皮损伤,而血管内皮损伤又是心血管疾病发病的病理基础,糖尿病的并发症又离不开心血管疾病,因此Hcy与糖尿病的发生密切相关。
Masay等〔14〕认为Hcy增加能促进糖尿病微血管并发症的发生和发展,Hcy产生超氧化物及过氧化物,加速脂质过氧化作用,在血管内皮细胞内过度蓄积,具有直接损伤作用;Okada等〔15〕认为,糖尿病患者血浆同型半胱氨酸水平升高与维生素B族及叶酸缺乏、同型半胱氮酸代谢过程中关键酶的基因突变以及肾脏功能受损导致的排泄障碍相关;而在糖尿病患者动脉壁上的脂蛋白更易氧化修饰,即同型半胱氨酸通过氧化应激系统影响内皮的功能,可使血管内皮暴露于糖基化终末产物而引起内皮损伤。
HbA1c是DM并发症独立危险因素,DM并发症主要涉及微血管及大血管的心血管病变,而hs-CRP及Hcy又是心血管疾病的独立危险因素,它们的发病机制均与血管内皮损伤有关。近年来的基础及临床医学研究成果显示,血管内皮功能失调是诸多心血管疾病发生发展的始动因子。hs-CRP可以直接作用于血管内皮细胞从而诱导各种黏附分子的表达增加以及炎症发展,而Hcy可以间接的引发血管内皮损伤机制,因此,检测hs-CRP及Hcy水平也可从一个侧面明确内皮炎症的存在和内皮功能障碍的程度。
在根据HbA1c检测值进行不同的分组中,联合HbA1c与hs-CRP及Hcy检测,可以看到HbA1c的控制水平不同,hs-CRP与Hcy的浓度差异有统计学意义,尤其值得关注的是HbA1c<6.6%的一组与其他各组之间的差别,不仅可以了解HbA1c对于DM的诊断和血管并发症发生的切入点,还可以根据HbA1c的控制水平与Hcy、hs-CRP的浓度相关性作为实验基础加以论述和分析,以便对DM并发症的预测、诊断早于影像学的改变和视网膜病变等传统方法,并且通过口服维生素B族、叶酸等干预Hcy、hs-CRP的浓度〔16〕,对治疗作出正确的判断和监测,从而在早期、特异诊断的基础上,推迟、控制和治疗DM并发症的发生。
1 Goldstein DE,Little RR,Lorenz RA,et al.American Diabetes Association.Tests of glycemia in diabetes〔J〕.Diabetes Care,2003;26(Suppl1):S106-8.
2 纪立农.糖化血红蛋白〔M〕.北京:人民卫生出版社,2010:1.
3 吴茂红.糖尿病微血管病变患者炎症因子水平、血浆同型半胱氨酸水平及血液流变学指标变化〔J〕.中国动脉硬化杂志,2011;19(6):514-6.
4 侯丹丹.高同型半胱氨酸血症与内皮祖细胞凋亡〔J〕.生理科学进展,2011;42(2):158-60.
5 李秀兰.P选择素和超敏C-反应蛋白与糖尿病肾病的关系〔J〕.检验医学与临床,2011;(16):1943-5.
6 Jesudason DR,Dunstan K,Leong D,et al.Macrovascular risk and diagnostic criteria for type 2 diabetes:implications for the use of FPG and HbA1c for cost-effective screening〔J〕.Diabetes Care,2003;26(2):485-90.
7 Gustavsson CG,Agardh CD.Markers of inflammation in patients with coronary artery disease a also associated with glycosylated haemoglobin ale within the noltflal range〔J〕.Eur Heart J,2004;25(23):2120-4.
8 Padhan AD,Ridker PM.Do atherosclerosis and type 2 diabetes share a common inflammatory basis〔J〕.Eur Heart,2003;23:831-4.
9 Devaraj S,Kumaresn PR,Jialal L.Effect of C-reactive protein on chemokine expression in human aortic endothelial cells〔J〕.J Mol Cell Cardiol,2004;36:405-10.
10 Khreis T,Jozsef L,Potempa L.Conforrnational rearrangement in C-reactive protein is required for proinnammatory actions on human endothelial cells〔J〕.Circulation,2004;109(16):2016-22.
11 Mesottn D,Swinnen JV,van Demhoydonc F,et al.Contribution of circulating lipids to the improved outcome of criticial illness by glycemic control with intersive insulin therapy〔J〕.Cli Endocrlol Metab,2004;89(1):219-26.
12 Hansrani M,Stansby G.The use of an in vivo model to study the effects of hyperhomocysteinaemia oil vascular function〔J〕.J Surg Res,2008;145:13-8.
13 Jiang Y,Jiang J,Xiong J,et al.Homocysteine-induced extracellular superoxide dismutase and its epigenetic mechanisms in monocytes〔J〕.J Exp Biol,2008;211:911-20.
14 Masay ZA,Ceballos I,Chadefaux-vekemens B,et al.Homocystine oxidative stress and endothelium function in uremic patients〔J〕.Kidney Iat(Supp1),2001;78:s243-5.
15 Okada E,Oida K,Tada H,et al.Hyperhomocysteinemia is a risk factor for coronary arteriosclerosis in Japanese patients with type 2 diabetes〔J〕.Diabetes Care,1999;22(3):48:4-490.
16 程思高.同型半胱氨酸血症治疗研究进展〔J〕.生理科学进展,2011;42(5):329-34.

