钯配合物对人乳腺癌细胞MCF-7增殖的抑制作用及机制
姜 虹 朱国巍 王丽君 (北华大学化学与生物学院,吉林 吉林 132013)
乳腺癌是严重威胁女性健康的最常见恶性肿瘤之一,近年来跃居女性恶性肿瘤发病率首位〔1〕。肿瘤的发生和发展与细胞凋亡失控密切相关,因此,利用凋亡调控机制寻找高效低毒、作用机制明确的凋亡诱导剂已成为肿瘤防治的一个重要策略。基于含硒小分子化合物具有在信号转导过程中的调控机制及其相应的细胞生理功能〔2〕,结合钯配合物(PBIPS)诱导肿瘤细胞凋亡的作用〔3〕,本文以含硒小分子为配体,设计合成了新型含硒生物活性小分子配合物,经元素色谱分析、红外光谱分析等进行表征(结构式见图1),以乳腺癌细胞(MCF-7)为体外模型,研究PBIPS对MCF-7增殖抑制及其诱导该细胞凋亡的能力,探讨其作用的分子机制,以求为乳腺癌的治疗寻求新的有效方法、策略提供基础研究资料。
1 材料与方法
1.1 主要材料与仪器 PBIPS由本实验室制备,MCF-7(中国科学院上海细胞生物学研究所),RPMI-1640培养液(Gibco),胎牛血清(杭州四季青生物工程有限公司),碘化丙啶(PI)(美国Caltag公司),吖啶橙(A0)/溴乙啶(EB)(华美生物工程有限公司),β-肌动蛋白(β-actin)、Bcl-2,survivin、半胱氨酸蛋白酶(Caspase-3)抗体(Santa Cruz Biotechnologies公司)。流式细胞仪(FCM)(美国 Beckman coulter公司),描定蛋白/碘化丙啶(Annexin/PI)凋亡检测试剂盒(北京宝赛公司),BX51TF荧光显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1 细胞培养 MCF-7细胞均常规培养于含10%胎牛血清,100 U/ml青霉素和链霉素的RPMI-1640完全培养液中,于37℃,体积分数5%CO2培养箱培养,取对数生长期细胞进行试验。
1.2.2 细胞增殖活性测定 取对数生长期的MCF-7细胞,以细胞数1.5×104/孔接种于96孔板。37℃、5%CO2培养箱中培养24 h,再加入PBIPS,使每孔的终质量浓度分别为0、12.5、25、50、100、150、200 μg/ml(每个质量浓度设 5 个平行孔),同时设置阴性对照。分24 h、48 h、72 h共3个培养时间段。培养结束时弃上清,加入5 mg/ml的噻唑蓝(MTT)试剂10 μl,37℃、5%CO2孵箱继续培养4 h,取出加入DMSO 150 μl/孔,充分振荡10 min溶解,酶标仪490 nm处测定每孔的吸光度A值,计算细胞增殖抑制率〔4〕。抑制率(%)=〔A(阴性)/A(给药)〕/〔A(阴性)/A(空白)〕×100%。

图1 PBIPS结构式
1.2.3 荧光显微镜观察MCF-7细胞凋亡 取对数生长期MCF-7细胞悬液接种于培养瓶中,待细胞贴壁后加入终浓度为100 μg/ml的 PBIPS 处理,同时设对照组,分别作用 24 h、48 h、72 h后终止培养,收集细胞悬液,用磷酸盐缓冲液(PBS)洗涤2次,AO/EB染色后在荧光显微镜下观察MCF-7细胞的凋亡情况。
1.2.4 FCM检测PBIPS对MCF-7细胞凋亡的影响 选取对数生长期细胞接种于24孔板中,加入PBIPS使其终浓度分别为 50 μg/ml(低剂量组)、100 μg/ml(中剂量组)、200 μg/ml(高剂量组),处理细胞24 h、48 h、72 h后,用0.25%胰酶+0.02%乙二胺四乙酸(EDTA)消化,计数后取约 5×105个细胞,1 000 r/min离心5 min后弃上清液,用预冷PBS洗涤2次,按试剂盒说明书加入 Annexin V-FITC 10 μl和 PI 5 μl,避光室温反应15 min,在1 h内用流式细胞仪检测。以AnnexinⅤ+细胞比率作为细胞凋亡率,实验重复3次,另设空白对照组。
1.2.5 Western印迹检测PBIPS对MCF-7细胞凋亡相关蛋白表达的影响 应用Western印迹技术,以β-actin作为内照物,比较各组survivin、Caspase-3、Bcl-2和 Bax蛋白表达水平的改变。作用 48 h后分别收集空白对照组、PBIPS 50、100、200 μg/ml剂量组的细胞,PBS洗3次,加入预冷的细胞裂解液,裂解后离心取上清,用Bradford法测定各种蛋白的浓度。分别取蛋白样品,按体积比4∶1加入上样缓冲液,100℃、5 min变性,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)(5%的浓缩胶,18%的分离胶)电泳分离后,将蛋白电转印于硝酸纤维素膜经脱脂奶粉封闭液封闭,将硝酸纤维素膜分别加入稀释后一抗,再用相应辣根过氧化物酶(HPR)标记的二抗稀释液孵育,用增强化学发光(ECL)法检测不同样品各种蛋白表达状况。图像以Bio-Rad图像分析系统分析,用目的蛋白条带的平均光强度值与β-actin条带的平均光强度值的比值表示该蛋白表达的相对强度。
1.3 统计学方法 应用SPSS13.0统计软件进行分析,实验结果用±s表示,两组间比较采用两独立样本t检验,多组间均数比较采用单因素方差分析。
2 结果
2.1 PBIPS对MCF-7细胞增殖的影响 MTT检测结果显示,PBIPS可以时间和剂量依赖性地诱导MCF-7细胞发生生长抑制。12.5~200 μg/ml PBIPS对MCF-7细胞生长具有不同程度的抑制作用,在 24 h、48 h、72 h 的 IC50值分别是 128.7、86.7、60.8 μg/ml。见图 2。
2.2 AO/EB双染法观察细胞凋亡形态学改变 PBIPS处理MCF-7细胞24 h、48 h、72 h后,出现典型的凋亡形态学改变。对照组正常细胞核为结构规则的绿色染色质;药物作用24h时,部分细胞核染色质着黄色或黄绿色,呈圆珠状或固缩状,为早期凋亡细胞;48 h时细胞核染色质着橘红色,呈固缩状,为晚期凋亡细胞;72 h时大部分细胞核染色质着橘红色,与作用48 h相比增多,并且细胞发生坏死,显示为橙红色的浓缩、碎裂染色质。见图3。
2.3 PBIPS对MCF-7细胞凋亡的影响 FCM检测结果显示,50、100、200 μg/ml PBIPS作用 MCF-7 细胞 24 h后即出现凋亡现象,随着PBIPS浓度的增加和作用时间的延长,细胞的凋亡率逐渐增加,与对照组比较,差异有统计学意义(P<0.01),呈现明显的剂量/时间正向依赖关系。见图4,5。
2.4 PBIPS对 MCF-7细胞 survivin、Caspase-3、bcl-2及 bax蛋白表达的影响 Western印迹检测显示经50、100、200 μg/ml PBIPS处理MCF-7细胞48 h,蛋白条带相对强度图表明,随着作用浓度的增加,survivin和Bcl-2的蛋白表达均呈现下调的趋势,而Caspase-3和bax的表达却显著升高,其效应均具有浓度梯度依赖性(P<0.05或P<0.01)。见图6。
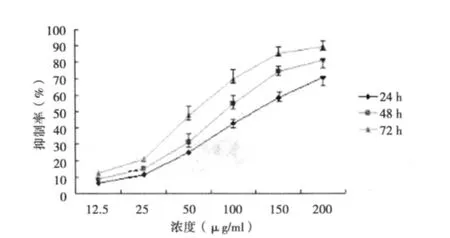
图2 MTT检测PBIPS对乳腺癌MCF-7细胞生长的抑制作用

图3 AO/EB检测各组凋亡情况(×200)

图4 MCF-7细胞经不同浓度PBIPS处理24 h后凋亡情况
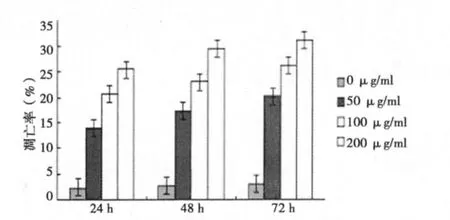
图5 MCF-7细胞经不同浓度PBIPS处理后凋亡情况
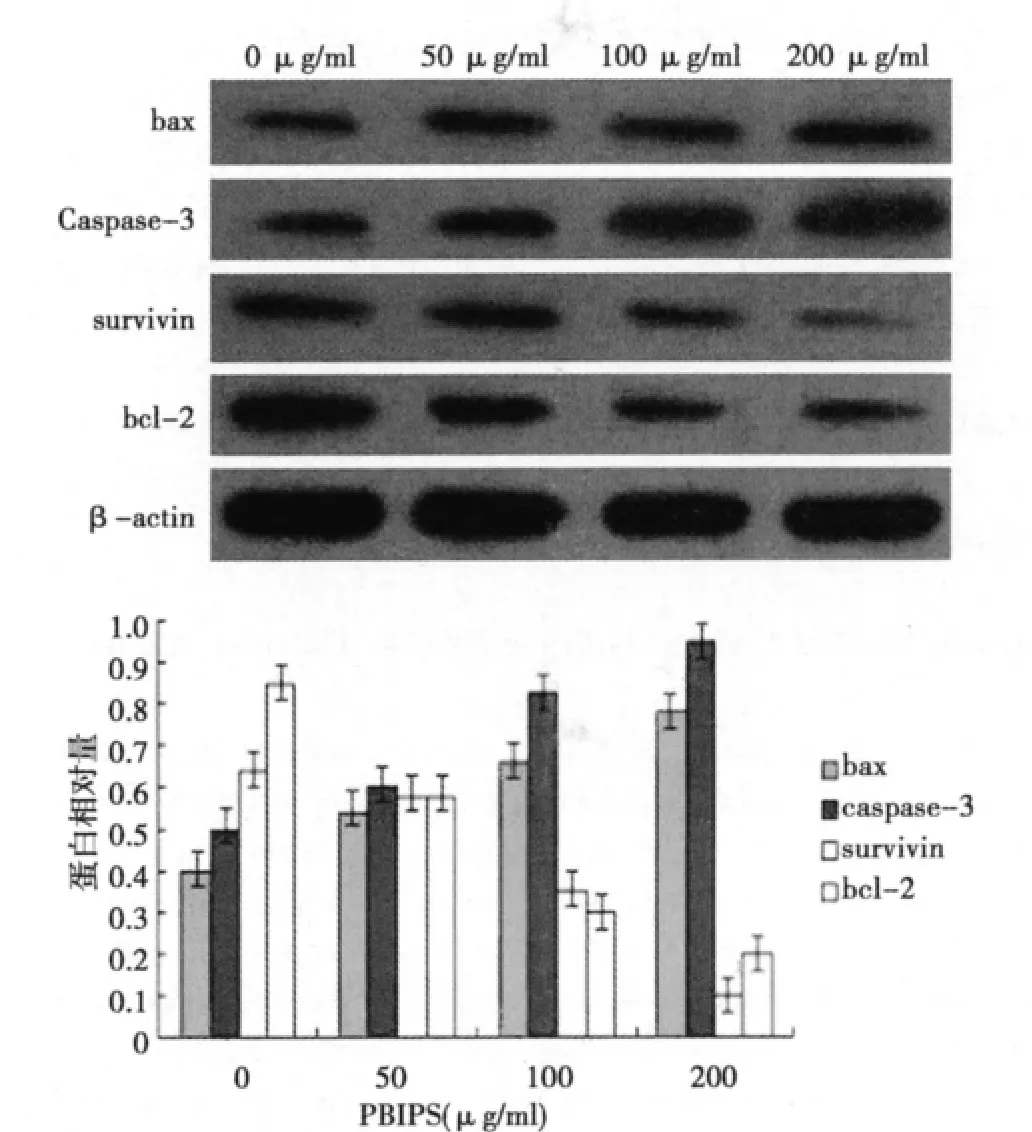
图6 PBIPS对MCF-7细胞 survivin、caspase-3、bcl-2及bax蛋白表达的影响
3 讨论
本研究结果显示 PBIPS可以时间和剂量依赖性地抑制MCF-7细胞体外生长,其抑制作用是通过诱导MCF-7细胞凋亡实现的。细胞凋亡是一个非常复杂的细胞内信号传导的过程,受多种因素精确地调控〔5〕。细胞凋亡过程中,对于凋亡通路起主要调节作用的有三类蛋白:(1)bcl-2蛋白家族,主要调节细胞线粒体膜的通透性,从而决定细胞色素c的释放。本实验所选用的bcl-2蛋白是抑制细胞凋亡的基因代表,主要是通过在线粒体外膜发挥作用,以维持膜的完整性,从而抑制细胞色素c的释放,而bax蛋白是促进细胞凋亡的基因代表,其作用是扩张线粒体外膜的通透性,使凋亡相关蛋白如细胞色素c可以进入细胞质。细胞是否进入凋亡途径,细胞中bcl-2与bax的比例扮演着重要角色,bax/bcl-2比值可以代表细胞凋亡能力〔6,7〕;(2)Caspase是凋亡机制的核心成分,担任细胞凋亡的启动和执行者的角色。Caspase是名副其实的“破坏者”,它们切断细胞与周围的联系,拆散细胞骨架,阻断细胞DNA复制和修复,干扰mRNA剪切,损伤DNA与核结构,使细胞降解为凋亡小体〔8〕;(3)尿亮氯酸氨基肽酶(IAP)蛋白,主要作用是调节Caspase活性。在凋亡信号刺激下,这三类蛋白相互作用,决定细胞是否进入凋亡程序〔9〕。
Survivin被认为是凋亡抑制蛋白(IAP)家族中作用最强的凋亡蛋白抑制因子。Survivin的过度表达抑制了细胞凋亡,有利于细胞的异常增殖和恶性转化。Caspase-3是Caspase家族中重要的凋亡执行者之一,与DNA断裂、染色质凝聚和凋亡小体的形成有关,抑制Caspase-3的活性或拮抗其功能可使细胞凋亡受抑。功能强大的凋亡抑制基因Survivin主要在凋亡通路的下游抑制Caspase-3发挥抗凋亡的效应〔10〕。为此,本文采用Western印迹检测了相关凋亡蛋白Survivin和Caspase-3的表达情况,结果显示Survivin在PBIPS诱导下出现了表达显著下调,而致凋亡蛋白Caspase-3的表达显著增加,从而导致MCF-7细胞凋亡。
bcl-家族成员的构成比例直接决定了线粒体外膜各种通道的开放程度,是调控细胞凋亡线粒体途径的关键因素,采用Western印迹检测了该家族中具有代表性的凋亡蛋白bcl-2和bax的表达情况,结果显示,PBIPS作用后MCF-7细胞中抗凋亡蛋白bcl-2的表达显著降低,促凋亡蛋白bax的表达显著上调,表明MCF-7细胞凋亡与上述凋亡调控基因在翻译水平上的变化有关。
1 侯 净,王子良,杨 恭,等.EMSY在乳腺癌中的功能研究进展〔J〕.中国癌症杂志,2012;22(4):300-7.
2 Zhao R,Xiang N,Domann FE,et al.Expression of p53 enhances seleniteinduced superoxide production and apoptosis in human prostate cancer cells〔J〕.Cancer Res,2006;66(4):2296-304.
3 高恩君,程卯生,王克华,等.钯配合物抗癌活性研究进展〔J〕.中华医学杂志,2006;6(2):236-9.
4 张亚宏,郭敬功,郭子华,等.白藜芦醇通过激活 p38-p53通路诱导人乳腺癌 MCF-7细胞凋亡〔J〕.药学学报,2011;46(11):1332-7.
5 Daniel JC,Smythe WR.The role of Bcl-2 family members in non-small cell lung cancer〔J〕.Semin Thorac Cardiovasc Surg,2004;16(1):19-27.
6 Levine B,Sinha S,Kroemer G.Bcl-2 family members:dual regulators of apoptosis and autophagy〔J〕.Autophagy,2008;4(5):600-6.
7 Danial NN.Bcl-2 family proteins:critical checkpoints of apoptotic cell death〔J〕.Clin Cancer Res,2007;13(24):7254-63.
8 Ming Sun,Yumei Zhao,Yi Gu,et al.Inhibition of nNos reduces ischemic cell death through down-regulating calpain and caspase-3 after experimental stroke〔J〕.Neurochem Int,2009;54(5-6):339-46.
9 Hunter AM,LaCasse EC,Korneluk RG,et al.The inhibitors of apoptosis(IAPs)as cancer targets〔J〕.Apoptosis,2007;12(9):1543-68.
10 Shin S,Sung BJ,Cho YS,et al.An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and 7〔J〕.Biochemistry,2001;40(4):1117-23.

