副猪嗜血杆菌和猪传染性胸膜肺炎放线杆菌双重PCR 检测方法的建立及应用
余远迪,曾 泽,岳 华,张 斌
(西南民族大学生命科学与技术学院,四川成都610041)
副猪嗜血杆菌(Haemophilus parasuis,Hps)是普通猪上呼吸道的一种共栖菌,能在特定条件下侵入机体而引起严重的全身性疾病,以纤维素性多发性浆膜炎、关节炎和脑膜炎为特征。主要临诊症状为发热、咳嗽、呼吸困难、消瘦、跛行、共济失调和被毛粗乱等,剖检病理变化表现为胸膜炎、肺炎、心包炎、腹膜炎、关节炎和脑膜炎等;主要危害2周龄~8周龄的仔猪,发病率一般为10%~15%,病死率可达50%以上[1-2]。猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,App)是猪传染性胸膜肺炎(Porcine infectious pleuropneumonia)的致病菌,以急性出血和慢性纤维素性坏死性胸膜炎病变为主要特征,慢性症状表现为可造成猪生长缓慢的肺损伤,给世界各地养猪业造成严重经济损失[3]。在临床诊断中,很难通过临床症状和病理特征鉴别这两种疾病的混合感染。而传统的鉴别诊断方法,即病原分离和血清学诊断,由于敏感性和特异性不高,不能满足快速鉴别诊断的需要,所以建立一种快速准确的病原检测方法尤为重要。多重PCR作为一种特殊的PCR比单项PCR更加快捷和简便,已应用于诊断多种疾病的混合感染[4-6]。本 试 验 根 据 Hps 16SrRNA 序 列 和 App ApxIVA基因序列各设计一对引物,通过特异性和敏感性试验,建立了可快速鉴别检测副猪嗜血杆菌和猪传染性胸膜放线杆菌的双重PCR方法。
1 材料与方法
1.1 材料
1.1.1 菌株与毒株 Hps菌株参考血清1型(HS82)、2型(HS83)、3型(HS81)、4型(HS79)、5型(HS80)、6 型 (HS1072)、7 型 (HS1073)、8 型(HS1073)、9 型 (HS50)、10 型 (HS1076)、11 型(HS1077)、12 型 (HS1075)、13型 (HS1079)、14 型(HS1080)、15型(HS1081)、100株 Hps临床分离株(SWUN050~SWUN151),App参考菌株血清1型(CVCC259)、血 清 2 型 (CVCC260)、血 清 3 型(CVCC261)、血 清 4 型 (CVCC262)、血 清 5 型(CVCC263)、血 清 6 型 (CVCC264)、血 清 7 型(CVCC265)、血 清 8 型 (CVCC266)、血 清 9 型(CVCC267)、血 清 10 型 (CVCC268)、血 清 11 型(CVCC269)、血清12型(CVCC270),15株 App临床分离株(SWUN170~SWUN182),支气管败血波氏杆菌(SWUN200)、猪源多杀性巴氏杆菌(SWUN201)、猪源大肠埃希菌(SWUN203)、猪源沙门菌(SWUN204)、猪源金黄色葡萄球菌(SWUN205)、猪圆环病毒2型(SWUN061)、猪流感病毒(H1N1)、猪繁殖与呼吸综合征病毒(疫苗株)、大肠埃希菌JM109菌株为本实验室分离鉴定并保存(表1)。
1.1.2 主要试剂及试剂盒 胰蛋白酶胨大豆琼脂培养基(TSA)为青岛海博生物有限公司产品;烟酰胺腺嘌呤二核苷酸(NAD)为Sigma公司产品;MgCl2、dNTP、r Taq聚合酶和pMD19-T Vector等为宝生物工程(大连)有限公司产品;胶回收和质粒提取试剂盒为Omega生物技术有限公司产品。
1.1.3 引物 参照文献[7]根据 Hps 16SrRNA序列设计引物,预期扩增的片段大小为822bp,引物序列 为,PH1:5′ GTGATGAGGAAGGGTGGTGT3′;PH2:5′GGCTTCGTCACCCTCTGT3′。参照文献[8]根据App ApxIVA基因设计引物,预期扩增的片段大小为346bp,引物序列为,PA1:5′ATACGGTTAATGGCGGTAATGG3′;PA2:5′ACCTGAGTGCTCACCAACG3′。以上引物均由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 Hps与App的培养 将参考菌株 Hps和App分别接种于含有50mL/L小牛血清和0.1 mL/L的NAD的TSA平板上,37℃培养24h~48 h,单个菌落进行革兰染色,观察结果,保存备用;从TSA平板上挑取单菌落培养于50mL/L小牛血清和0.1mL/L的NAD的TSB培养基中,置于37℃,150r/min振摇培养24h。
1.2.2 DNA模板的制备 细菌DNA模板制备:按细菌基因组DNA提取试剂盒说明书操作;组织中DNA的提取:按组织DNA提取试剂盒说明书操作。
1.2.3 单项PCR扩增制备阳性标准品 标准品采用25μL反应体系:DNA模板1μL,上游引物1 μL,下游引物1μL,10×PCR buffer 2.5μL,dNTP(2.5mmol/L)2μL,MgCl21.5μL,rTaq1U,无菌双蒸水15.8μL。以下反应条件分别扩增Hps 16S rRNA片段和App ApxIVA片段:94℃5min;94℃30s,58℃40s,72℃延伸1min,30个循环;72℃延伸10min,16℃反应结束。PCR产物用10g/L琼脂糖凝胶电泳,Goldview染色,小量胶回收试剂盒回收目的片段,分别连接pMD19-T Vector,转化大肠埃希菌JM109。阳性克隆质粒送上海生工生物工程技术服务有限公司测序,测序结果正确的阳性质粒用核酸蛋白检测仪测定OD 260nm值,计算其浓度,将两种阳性质粒调整至相同浓度,等量混合,即为阳性标准品。
1.2.4 双重PCR方法的建立 以阳性标准品为模板,在Hps、App单项PCR稳定的基础以25μL总体积,优化反应体系。对退火温度(52℃~62℃)进行优化,再以优化的退火温度对两对引物浓度进行优化,以电泳条带最亮,无非特异扩增,引物二聚体最少,敏感性最高为优化标准。
1.2.5 双重PCR特异性试验 以相同条件扩增本实验保存的波氏杆菌、多杀性巴氏杆菌、大肠埃希菌、沙门菌、金黄色葡萄球菌、猪圆环病毒2型、猪流感病毒、猪繁殖与呼吸综合征病毒基因组模板,检测该双重PCR方法的特异性。
1.2.6 多重PCR的敏感性试验 分别用单项和双重PCR检测10倍系列稀释阳性模板,初始模板浓度为3.8μg/mL,模板稀释6个梯度,为10-1~10-6。将Hps和App纯培养后,用PBS将细菌洗下,细菌计数测定细菌浓度,用PBS将其从10-1~10-6进行10倍稀释,各取1μL进行PCR扩增。
1.2.7 多重PCR的通用性试验 用Hps 15个标准血清型参考株,100株Hps临床分离株和12株App标准血清型参考株,15株App临床分离株进行通用性检测。
1.2.8 临床样本的检测 对36份临床采集的疑似样本从肺脏细支气管进行常规细菌分离培养,并从肺脏组织中提取组织DNA,用单项PCR方法及本研究所建立的双重PCR方法进行检测。
1.2.9 人工感染样本的检测 人工感染试验在本实验室进行,将10头1月龄仔猪随机分为2组饲养,第一组5头仔猪用浓度为1×109cfu的 Hps标准血清5型菌株气管注射,接种剂量5mL/头;第二组5头仔猪用浓度为1×109cfu的App标准血清5型菌株气管注射,接种剂量为5mL/头。注射后每隔1h观察仔猪临床症状,处死发病症状明显的仔猪,分别采集其肺组织,用所建立的双重PCR方法进行检测。
2 结果
2.1 单项及多重PCR扩增结果
采用引物 PH1、PH2、PA1、PA2按文中1.2.3的方法分别扩增Hps和App的DNA模板,结果只扩增出相应的特异性片段;同时以Hps和App的DNA为模板时,结果扩增出Hps16SrRNA 822bp和App ApxIVA 346bp 2个片段。阳性克隆质粒进行测序分析,结果表明所扩增的片段为Hps和App目的基因片段(图1)。
2.2 双重PCR条件的优化
采用25μL反应体系,最佳退火温度为60℃,Hps和 App引物的最佳配比 0.6μmol/L∶1μmol/L(图2和图3)。
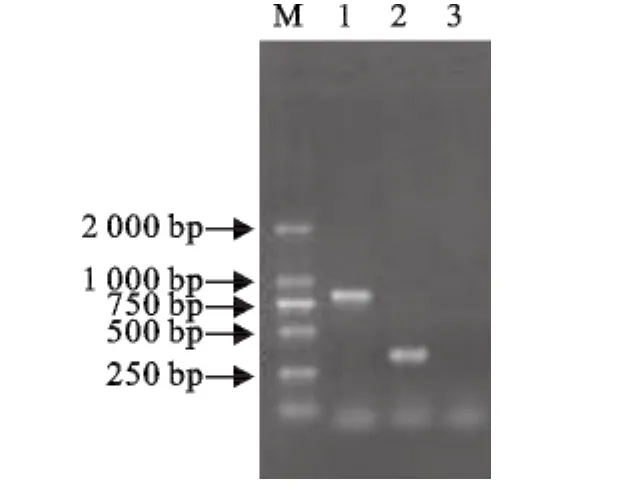
图1 Hps和App基因PCR扩增产物电泳图Fig.1 Electrophoresis of PCR products of Hps and App genes

图2 双重PCR退火温度的优化Fig.2 Optimization of annealing temperature in duplex PCR
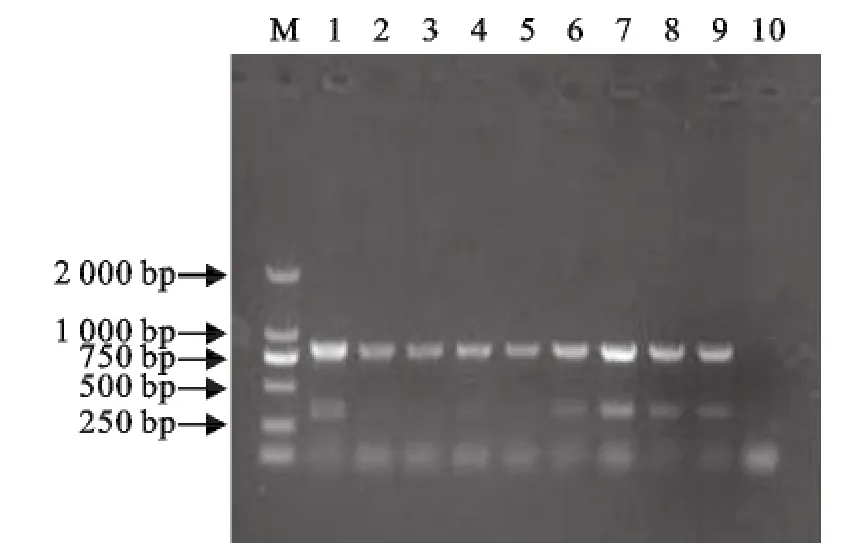
图3 双重PCR引物浓度优化结果Fig.3 Optimization of primer concentration in duplex PCR
2.3 双重PCR特异性试验结果
检测结果表明,多重PCR方法可特异性地扩增Hps和App目的片段,不与猪源波氏杆菌、猪源多杀性巴氏杆菌、猪源大肠埃希菌、猪源沙门菌、猪源金黄色葡萄球菌、猪圆环病毒2型、猪流感病毒、猪繁殖与呼吸综合征病毒发生交叉反应,说明该方法具有较高的特异性(表1)。

表1 双重PCR方法特异性试验结果Table 1 The results of specificity tests of duplex PCR
2.4 双重PCR敏感性试验结果
2.4.1 最低检测核酸浓度 该方法对Hps和App重组质粒DNA浓度的最低检测核酸浓度Hps 38 pg/mL,App 3.8pg/mL,与单项PCR检测灵敏度基本相符(图4)。
2.4.2 最低检测细菌含量 双重PCR方法对Hps和App最低检测细菌含量 Hps 8.9cfu,App 26.9 cfu,与单项PCR检测灵敏度基本相符(图5)。
2.5 通用性检测结果
该方法对Hps 15个血清型参考菌株,100株Hps临床分离株,App 12个血清型参考菌株和15株App临床分离株的检测结果表明,该方法能对标准菌株和临床分离株全部检出,表明该方法具有较好的通用性。
2.6 临床样本检测结果
对36份临床采集的疑似病料分别进行常规细菌分离培养和PCR检测,常规细菌分离培养检出Hps 13份,检出率为36.11%;双重PCR检测出Hps 18份,检出率为50%,未检出App;单项PCR检测与双重PCR检测结果一致。
2.7 人工感染样本的检测结果
在Hps人工感染试验中,肺脏组织用单项PCR和双重PCR检测,结果均为Hps阳性;在App人工感染试验中,肺脏组织用单项PCR和双重PCR检测,结果均为App阳性。

图4 双重PCR最低检测核酸浓度Fig.4 Minimal detection concentration of nucleic acids in the duplex PCR

图5 双重PCR最低检测细菌含量Fig.5 Minimal detection of cfu in duplex PCR
3 讨论
Hps和App是危害养猪业的重要病原菌,而且两种病原菌均为革兰阴性菌,具有多形性,生长条件要求严格,难于培养和分离,给诊断和治疗带来一定的困难,因此需要建立一种快速检测方法。多重PCR检测技术是一种快速、特异、敏感和可靠的病原检测方法[4-6]。16SrRNA 基因普遍存在于细菌并参与细菌蛋白质的合成过程,已成为细菌分类和鉴定的一个重要标志,目前已经建立了多种细菌基于16SrRNA 基因的分子诊断方法[9-10]。溶血素(Apx)为App毒力因子之一,属于RTX毒素家族,ApxIVA由Schaller A等于1999年在App中首次发现,存在于所有血清型的放线杆菌中,具有种的特异性[11-12]。本研究参考已发表的针对 Hps 16S rRNA引物及App ApxIVA设计的引物,扩增出822bp及346bp的目的片段,所建立的双重PCR对其他细菌的扩增结果均为阴性,表明建立的方法具有较好的特异性,最低可检测核酸浓度Hps 38 pg/mL,App 3.8pg/mL;最低检测细菌含量 Hps 8.9cfu,App26.9cfu,与单项PCR的敏感性一致。
该方法通用性研究表明,应用该方法对Hps 15个血清型参考株,100株临床分离株均能检出;对App 12个血清型参考株,15株临床分离株均能检出,说明该方法具有良好的通用性。对常规的细菌分离培养及该双重PCR方法进行了比较,结果显示该方法对Hps和App的检出率明显高于常规细菌分离培养;而且该方法特异性和敏感性高、操作简便、快速高效,可在5h内检测出结果。因此,本研究建立的Hps和App双重PCR检测方法对于Hps和App感染的快速诊断及病原的监测等均具有很高的实用价值。
[1] Oliveira S,Pijoan C.Haemophilus parasuis:new trends on diagnosis,epidemiology and control[J].Vet Microbio,2004,99(1):1-12.
[2] 刘正飞,蔡旭旺,陈焕春,等.副猪嗜血杆菌研究进展 [J].动物医学进展,2003,24(5):17-19.
[3] 雷连成,华 芳,王丽哲,等.猪胸膜肺炎放线杆菌分离鉴定与毒力测定[J].中国兽医学报,2008,28(4):359-362.
[4] 朱来华,陆承平,黄纪徽,等.应用三重PCR快速同步检测和区分3种马疱疹病毒 [J].中国兽医杂志,2007,43(2):15-19.
[5] 谢玉洁,王桂军,李 郁,等.PRRSV和PCV-2双重PCR检测方法的建立及应用 [J].动物医学进展,2008,29(3):21-25.
[6] 覃宗华,蔡建平,吕敏娜,等.鸭疫里默氏菌和大肠杆菌鉴别诊断双重PCR方法的建立和应用 [J].畜牧兽医学报,2008,39(4):517-521.
[7] Oliveira S,Galina L,Pijoan C.Development of a PCR test to diagnose Haemophilus parasuis infections[J].J Vet Diagn Invest,2001,13(6):495-501.
[8] Xiao G S,Cao S J,Duan L L,et al.Identification and detection of Actinobacillus pleuropneumoniae in infected and subclinical-ly infected pigs by multiplex PCR based on the genes ApxIVA and OmIA [J].Agric Sci,2006,5(2):146-154.
[9] 于 超,郭海勇,魏嘉良.16S-23SrRNA基因序列在细菌鉴定中的应用 [J].中国畜牧兽医,2012,39(2):57-59.
[10] Woo P C,Lau S K,Teng J L,et al.Then and now:use of 16S rDNA gene sequencing for bacterial identification and discovery of novel bacteria in clinical microbiology laboratories[J].Clin Microbiol Infect,2008,14(10):908-934.
[11] Schaller A,Kuhn R,Kuhnert P,et al.Characterization of apxIVAa new RTX determinant of Actinobacillus pleuropneumoniae [J].Microbiology,1999,145(8):2105-2116.
[12] Schaller A,Djordjevic S P,Eamens G J,et al.Identification and detection of Actinobacillus pleuropneumoniae by PCR based on the gene apxIVA [J].Vet Microbiol,2001,9(1):47-62.

