慢病毒的包装及其对禽细胞的转基因效率研究
陈志胜,黄晓敏,廖敬森
(佛山科学技术学院,广东佛山528000)
慢病毒载体是一种新型转基因载体,以其独特的优势成为转基因研究和基因治疗中病毒载体的研究热点。作为外源基因载体,已广泛地用于体外细胞的转染、转基因研究,以及结合RNAi进行功能基因组和基因治疗研究[1-2]。近几年来,利用慢病毒为载体对家禽细胞转基因的操作也进行了一些尝试,但还远没有达到哺乳动物的研究水平。Hen G等[3]研究表明,慢病毒可以携带外源基因至受体鸡胚中表达,但是表达效率极低,仅为0.48%。Chapman S C等[4]用慢病毒载体生产转基因鸡,其种系传递率均明显低于相同载体在小鼠中的报道。本研究将4种已构建好的慢病毒质粒pLP1、pLP2、p-VSVG和pll3.7以脂质体介导转染到293T细胞中,将其包装成以VSV-G为囊膜糖蛋白的复制缺陷型假逆转录病毒,再用这种包装产物感染体外培养的鸡胚和鸭胚成纤维细胞,通过绿色荧光蛋白(green fluorescent protein,GFP)基因作为标记基因,观察其荧光表达,并检测其感染效率,从而为重组慢病毒系统在家禽细胞上的合理使用提供理论和试验基础,进一步为慢病毒介导法制备转基因家禽的研究奠定基础。
1 材料与方法
1.1 材料
4种基于HIV-1的复制缺陷型慢病毒4种质粒系统pLP1、pLP2、p-VSVG、pll3.7以及293T细胞均由中山大学发育生物学与发育工程研究室惠赠。大肠埃希菌DH5α由本试验室保存。鸡、鸭胚成纤维细胞为原代培养:取8日龄~10日龄的鸡、鸭胚,去除头部、四肢、内脏及可见的血管,用2.5g/L的胰蛋白酶-0.2g/L的EDTA 消化液,置于37℃消化10min,得到的细胞用含100mL/L胎牛血清的DMEM培养液置37℃、饱和湿度、体积分数为5%的CO2培养箱培养。
1.2 方法
1.2.1 脂质体介导法转染293T细胞 以3种不同剂量准备DNA-脂质体转染复合物:①将4种包装质粒各取5μL,加入到0.25mL无血清无双抗DMEM培养基中,轻轻混匀,并与4μL的脂质体LipofectamineTM 2000混匀;②4种包装质粒各取5μL,与6μL的脂质体LipofectamineTM 2000混匀;③将pLP1、pLP2、p-VSVG质粒按6.5∶2.5∶3.5质量比进行混合(这一比例约相当于摩尔等比关系)制作包装混合物然后取12.5μL包装混合物及7.5μL pll3.7质粒,共20μL,加入到500μL无血清无双抗DMEM培养基中,轻轻混匀并加入6μL的脂质体;
待293T细胞在24孔板生长达到90%~95%融合度时,将转染复合物逐滴加入培养瓶中,并来回轻摇以混匀。37℃孵育过夜;第2天移去含复合物的培养基,换上新鲜培养液;转染后48h~72h收集含病毒上清,4℃、3 000r/min离心15min,去除细胞沉淀,取上清,-80℃保存备用。
1.2.2 包装病毒的滴度鉴定 病毒转染滴度的简单测算是通过获取的病毒原液感染293T细胞,48h后观察绿色荧光蛋白的表达,每瓶细胞随机选择5个视野进行阳性荧光计数,利用荧光成像系统分析计算转染的总细胞数,进而估测每毫升病毒原液的滴度[6]。
1.2.3 包装病毒感染鸡、鸭胚成纤维细胞 将上述冻存的最高滴度慢病毒液解冻后,以1∶1的比例与含100mL/L胎牛血清DMEM培养液混合,其终体积均为1mL。将此稀释液轻轻倒转混匀,加到六孔板培养的鸡、鸭胚成纤维细胞中。在转染后72h观察孔中GFP的表达情况,随机抽取10个非重叠视野,利用荧光成像系统分析计数表达GFP的细胞个数占细胞总数百分比最终得出其转染效率。
2 结果
2.1 慢病毒4种质粒系统在293T细胞中的包装及其滴度检测
不同浓度的4种质粒和脂质体转染293T细胞均发现绿色荧光蛋白的表达,取病毒上清液感染293T后同样观察到绿色荧光表达,表明293T细胞成功地包装制备了重组慢病毒,但其转染效率与质粒和脂质体的相对浓度相关。3种转染方法中,当4种质粒浓度按6.5∶2.5∶3.5∶7.5比例混匀共20μL并与6 μL脂质体共同分散于500μL的DMEM时转染效率最高(35%),即GFP拷贝数多,表达量高,荧光强。此外,在转染293T细胞时,如4种质粒比例相同条件下,高浓度脂质体转染效率高。分别收集3种转染细胞的病毒上清液进行滴度检测可知,本试验3种方法中慢病毒的生产体系所获得的病毒滴度分别约为0.1×104,9.5×104,1.7×105PFU/mL(图1)。

图1 3种方法的转染效率及获得的包装病毒滴度比较Fig.1 Transfection efficiency and packaging viral titer in 3methods
2.2 慢病毒载体感染鸡、鸭胚成纤维细胞的效率
经293T细胞包装制备的重组慢病毒(病毒滴度约为1.7×105PFU/mL)感染鸡、鸭胚成纤维细胞,感染72h后,可见感染细胞内有不同程度绿色荧光蛋白表达,表明家禽成纤维细胞可以吸附重组慢病毒并在细胞内表达外源基因。慢病毒对细胞的感染力直接反映在带绿色荧光的细胞数量上(图2)。经计数其感染效率在鸡、鸭胚成纤维细胞上分别为12% 和8%。
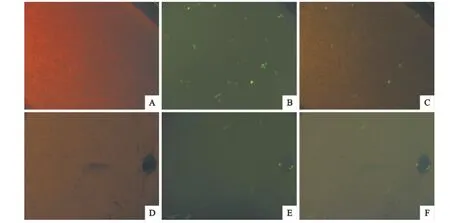
图2 慢病毒感染鸡、鸭胚成纤维细胞时GFP的表达情况Fig.2 GFP expression in chicken and duck embryonic fibroblast cells after lentiviral particle infection
3 讨论
慢病毒载体是一类新型的基因转移载体,相比其他基因转移方法,慢病毒载体因具有可以感染非分裂期细胞,并能实现目的基因的稳定表达,容纳外源性目的基因片段大,免疫反应小等优点越来越受到人们的重视[7-8]。本试验采用的慢病毒4种质粒包装系统拓宽了载体的嗜性范围,增加了载体的稳定性且重组进标记基因GFP,可以标识转移质粒的转染效率。选用人胚肾细胞来源的293T作为包装细胞,使其在包装过程中能反式提供产生病毒颗粒所需的蛋白。结果表明此法包装好的慢病毒可成功感染鸡、鸭胚成纤维细胞。
3.1 慢病毒载体包装条件的优化
本试验中,在暴露时间一定时,不同比例的慢病毒4种质粒和不同剂量的脂质体对293T细胞转染效果的影响不同。4种质粒DNA按6.5∶2.5∶3.5∶7.5质量比转染时转染效率最高,达到35%,病毒滴度为1.7×105IU/mL。说明不同的慢病毒成分需要达到合理比例才能获得较好的包装效果。必要数量的质粒混合比例是转基因表达所必需的,但本试验中增加慢病毒载体4种质粒的比例并不能使转染效率提高,这说明细胞对慢病毒质粒DNA的摄取是有一定限度的,高浓度的4种质粒混合比例可能是限制转染的重要因素。这可能是因为大剂量质粒长时间作用于细胞造成细胞损伤或对细胞的毒性所致,使细胞死亡率升高,导致转染效率降低。这一结论与于建宁的研究结论一致[9]。本研究获得的病毒滴度比其他文献报道的低[10-12],一方面可能是由不同的研究中慢病毒生产和病毒滴度估测的方法不同造成的,另一方面我们的试验方法尚需要进一步优化。实际上,收集慢病毒液上清经过超速离心,可以进一步浓缩病毒从而增加滴度,因此在生产转基因动物时将病毒液超速离心几乎是必不可少的。
3.2 慢病毒载体对鸡、鸭胚成纤维细胞的感染效率
在不同物种来源的细胞中,慢病毒载体有不同的转染效率。目前己有利用慢病毒生产出高整合率转基因小鼠报道,但在转基因家禽生产中还仅有少量成功的报道[3-5]。本试验结果发现,在鸡、鸭胚成纤维细胞中分别有12%和8%的细胞表达荧光,说明本试验生产的慢病毒对家禽成纤维细胞有较好的感染能力。但感染效率仍不理想,可能与病毒粒子的宿主特异性相关,慢病毒各组分都是基于哺乳动物细胞获得,因此病毒可能较难吸附到禽类细胞。
本试验优化了慢病毒4种质粒的包装效率,并成功感染鸡、鸭胚成纤维细胞,为重组慢病毒系统的在家禽的使用提供了试验基础。
[1] 崔奎青,刘庆友,赵一广,等.慢病毒法生产转基因鸡的初步研究[J].安徽农业科学,2012,19(10):136-138.
[2] 孙克宁,朱化彬,林 峰,等.慢病毒载体的构建及其应用于转基因动物的研究进展[J].中国畜牧兽医,2010(8):116-120.
[3] Hen G,Yosefi S,Shinder D,et al.Gene transfer to chicks using lentiviral vectors administered via the embryonic chorioallantoic membrane[J].PLoS One,2012;7(5):e36531.
[4] Chapman S C,Lawson A,Macarthur W C,et al.Ubiquitous GFP expression in transgenic chickens using a lent iviral vector[J].Development,2005,132:935-940
[5] McGrew M J,Sherman A,Ellard F M,et al.Efficient production of germline transgenic chickens using lentiviral vectors[J].EMBO,2004,5:728-733
[6] Pacchia A L,Adelson M E,Kaul M,et al.An inducible packaging cell system for safe,efficient lentiviral vector production in the absence of HIV-1accessory proteins[J].Virology,2001,282:77-86.
[7] 单艳菊,胡 艳,李慧芳,等.转基因鸡的制备技术及其利用现状[J].家禽科学,2009(10):45-48.
[8] 崔奎青,王晓丽,钟俊洁,等.慢病毒法生产转基因鸡的初步研究(英文)[J].Agricultural Sci Technol,2012(5):1101-1104.
[9] 于建宁,苗德强,马所峰,等.影响小鼠体细胞脂质体法转染效率的因素[J].实验生物学报,2005,38(5):404-410.
[10] 杨鹏翔,王曦晨,王宇祥,等.转基因鸡生物反应器载体的构建及其表达特性分析[J].生物工程学报,2011(8):1215-1224.
[11] 燕海峰,易康乐,TREFIL P,等.慢病毒载体导入种蛋内鸡胚技术研究[J].中国生物工程杂志,2012(12):73-79.
[12] 徐世永,丁红梅,孙 岩,等.慢病毒载体介导外源基因在不同细胞及鸡体不同组织中的表达[J].南京农业大学学报,2008(3):97-101.

