网状内皮组织增生症病毒改良型LAMP 检测方法的建立
曾婷婷,谢芝勋,谢丽基,刘加波,庞耀珊,范 晴,罗思思,邓显文,谢志勤
(广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室,广西南宁530001)
网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)不仅引起禽类发生肿瘤,雏禽感染后还能导致后期免疫抑制[1]。目前可以通过病毒分离物免疫荧光[2]、组织病理学、免疫组化、PCR[3]等方法进行诊断,但以上方法需要较长的周期或较昂贵的仪器才能完成。Notomi T等[4]建立的环介导等 温 扩 增 技 术 (loop-mediated isotheral amplification,LAMP)具有成本低廉、反应快速、操作简便和结果可视化等优点,目前已经广泛应用于畜禽传染病的 诊 断 中[5-7]。 本 试 验 参 考 Yang J等[8]的 方 法,先设计一套针对REV的LAMP引物,在此基础上加入一条加速引物,以期提高LMAP法检测REV的敏感性。
1 材料与方法
1.1 材料
1.1.1 病毒样品 网状内皮组织增生症病毒前病毒DNA、J亚群禽白血病病毒前病毒DNA、鸡马立克病病毒DNA、鸡传染性贫血病毒DNA、传染性法氏囊病病毒cDNA和禽呼肠病毒cDNA由本实验室保存;A亚群禽白血病病毒(RAV-1株)、B亚群禽白血病病毒(RAV-2株)购自中国兽医微生物菌种保藏中心。
1.1.2 试剂 Bst DNA 聚合酶(大片段)、MgSO4、甜菜碱为New England Biolabs公司产品;PCR试剂为北京全式金生物技术有限公司产品;海洋动物组织基因组抽提试剂盒为广州东盛生物科技有限公司产品;dNTPs为宝生物工程(大连)有限公司产品;钙黄绿素、MnCl2为International Laboratory USA产品。
1.2 方法
1.2.1 LAMP引物设计 根据GenBank中网状内皮组织增生症病毒gp90基因保守区段,使用在线软件Primer Explorer V4(http://primerexplorer.jp/e/v4-manual/index.html)设计 LAMP 引物。引物由广州Invitrogen公司合成。再在两条环引物中间设一条加速引物(accelerating primer,AP),用 Oligo 6.0验证与其他几条引物之间不能形成紧密的二聚体结构。引物序列见表1。
1.2.2 LAMP反应条件优化 25μL LAMP反应体系:1μL ~4μL dNTPs(10mmol/L),2.5μL 10×Bst buffer,1μL Bst DNA聚合酶8U,4μL ~7μL甜菜碱 Betaine(5mmol/L),2μL ~9μL MgSO4(25mmol/L),1μL 引物 (FIP 40μmol/L,BIP 40μmol/L,LF 20μmol/L,LB 20μmol/L,B3 5μmol/L,F3 5μmol/L),1μL 钙黄绿素 Calcein(625μmol/L),1μL MnCl2(12.5mmol/L)和1μL模板(网状内皮组织增生症病毒前病毒的基因组DNA),加纯净水至25μL。改良型LAMP在此基础上加入20μmol/L AP。反应条件:温度按60、61、62、63、64、65、66、67 ℃依次递增反应50min,80℃作用5min灭活。分别按照上述反应体系和反应条件进行摸索,获得最佳反应体系和条件。

表1 LAMP引物序列Table 1 The primer sequences of LAMP
1.2.3 特异性试验 分别以网状内皮组织增生症病毒前病毒DNA,A、B、J亚群禽白血病毒前病毒DNA,马立克病病毒DNA,鸡传染性贫血病毒DNA,传染性法氏囊病毒cDNA和禽呼肠病毒cDNA为模板,按照最佳反应体系和最佳反应条件进行LAMP反应。
1.2.4 敏感性试验 将网状内皮组织增生症病毒的DNA10倍稀释,从14ng/μL到1.4fg/μL为模板,按照1.2.2的最佳反应体系和最佳反应条件进行LAMP反应。为比较加入加速引物前后的敏感性,再将14fg/μL 2倍稀释至7fg/μL,进行LAMP反应。
同时以常规PCR作为对照,以同样的模板浓度进行常规的PCR扩增(常规的PCR扩增引物[9]F:CAGGAATTCAAGAATGGACTGTCTCACC,R:ATT GTC GACCTGGTGGAGGACATAGC,目的片段约为1 100bp)。
1.2.5 病料检测 抽提16份临床上疑为肿瘤病或其他免疫抑制性疾病的鸡内脏组织的DNA,用于LAMP检测,同时与普通PCR检测比较其阳性率。
2 结果
2.1 反应条件优化结果
25μL LAMP反应体系:2μL dNTPs,2.5μL 10×Bst buffer,1μL Bst DNA聚合酶8U,5μL甜菜碱Betaine,3μL MgSO4,1μL引物,1μL钙黄绿素 Calcein,1μL MnCl2,1μL模板 DNA,加水至25μL。最佳反应条件为64℃反应50min,80℃作用5min灭活。
判断标准:若反应产物颜色变为绿色,为阳性反应;若颜色为棕红色,为阴性反应。
2.2 特异性试验结果
从图1和图2可以看出,只有网状内皮组织增生症病毒检测为阳性结果(肉眼观察可见翠绿色,琼脂糖凝胶电泳呈现典型的连续梯状条带),而对A、B、J亚群禽白血病毒,马立克病病毒,鸡传染性贫血病毒,传染性法氏囊病病毒和呼肠病毒均为阴性(肉眼观察可见棕红色,电泳均没有特征性梯形条带出现)。

图1 LAMP特异性试验APFig.1 Specificity test of AP-LAMP

图2 特异性试验LAMP产物电泳结果Fig.2 Electrophoresis of specific LAMP products
2.3 敏感性试验结果
图3为肉眼观察结果,图4为电泳检测结果。可以看出,LAMP对网状内皮组织增生症病毒前病毒DNA的最小检测限为14fg/μL(肉眼观察可见翠绿色),而改良型LAMP的最小检测限为7fg/μL,是前者的2倍。
常规PCR对照组20g/L琼脂糖凝胶电泳观察结果如图5所示,得到PCR预期扩增片段大小约为1 000bp,常规PCR方法最小检测限为1.4pg。本试验建立的改良型LAMP检测方法敏感性比常规PCR高200倍。
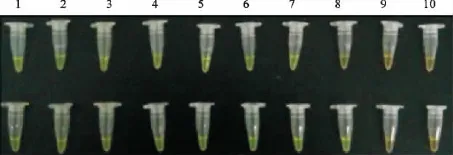
图3 AP-LAMP的敏感性试验Fig.3 Sensitivity test of AP-LAMP

图4 AP-LAMP敏感性试验产物电泳结果Fig.4 Electrophoresis of sensitivity test products of AP-LAMP
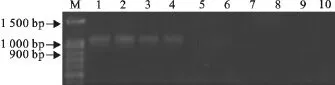
图5 普通PCR产物电泳结果Fig.5 Electrophoresis of PCR products
2.4 病料检测结果
16份样品检测结果与普通PCR检测结果100%符合,其中5号和10号病料PCR检测为弱阳性,但改良型LAMP结果为阳性,说明后者在检测临床样品时更加敏感(图6和图7)。
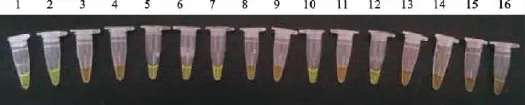
图6 AP-LAMP病料检测结果Fig.6 Samples detected by AP-LAMP

图7 病料检测PCR电泳结果Fig.7 Electrophoresis of samples detected byPCR
3 讨论
网状内皮组织增生症病毒(REV)可感染包括鸡在内的多种禽类,根据不同毒株可引起急、慢性肿瘤,还能导致长期的免疫抑制。REV可以通过蚊虫水平传播,也能低水平的垂直传播,近年来发现还有一个比较重要的传播途径就是通过污染活疫苗注射传播[10]。在养殖企业,需要及时将感染的病禽和污染的疫苗检测出来并剔除。REV属于反转录病毒[11],在细胞内复制时以前病毒DNA的形式存在于细胞基因组内,前病毒DNA也可以插入到马立克病或禽痘疫苗的病毒基因组内。所以在检测时,可直接抽提组织或这些疫苗的DNA进行检测。
由于LAMP技术方便快捷,不需要特殊仪器的优点而特别适用于基层单位检测REV的感染情况,本试验利用实验室已经建立的LAMP技术平台[12-15],设计一套针对网状内皮组织增生症病毒的LAMP引物,在环引物LF和LB之间添加一条加速引物(AP),通过优化反应条件,建立了改良型网状内皮组织增生症病毒可视化LAMP诊断方法。经过添加加速引物之后,其敏感性是原来的2倍,是普通PCR的200倍,可以检测到低至7fg/μL的DNA,这在检测疫苗的污染情况时更具优势。而病料检测试验也表明,改良型LAMP的敏感性更高,在普通PCR结果显示为弱阳性的情况下仍能检测出来。
[1] Dren C N,Nemeth I,Sari I,et,al.Isolation of a reticuloendotheliosis-like virus from naturally occurring lymphoreticular tumours of domestic goose [J].Avian Pathol,1988,17(2):259-277.
[2] Witter R L,Purchase H G,Burgoyne G H.Peripheral nerve lesions similar to those of Marek's disease in chickens inoculated with reticuloendotheliosis virus[J].J Natl Cancer Inst,1970,45(3):567-577.
[3] Aly M M,Smith E J,Fadly A M.Detection of reticuloendotheliosis virus infection using the polymerase chain reaction[J].Avian Pathol,1993,22(3):543-554.
[4] Notomi T,Okayama H,Masubuchi H,et,al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acid Res,2000,28(12):63.
[5] 邓显文,谢芝勋,谢志勤,等.鸡传染性贫血病毒病LAMP快速可视化检测方法的建立[J].家畜生态学报,2011,32(6):57-60.
[6] 罗思思,谢芝勋,邓显文,等.鸡毒支原体强弱毒株LAMP可视化鉴别检测方法的建立[J].中国兽医科学,2012,42(9):943-948.
[7] 范 晴,谢芝勋,刘加波,等.牛病毒性腹泻病毒RT-LAMP检测方法的建立[J].生物技术通讯,2010,21(2):248-252.
[8] Yang J,Fang M X,Li J,et,al.Detection of hepatitis C virus by an improved loop-mediated isothermal amplification assay[J].Arch Virol,2011,156:1387-1396.
[9] 吉 荣,赵文明,钱 莉,等.REV分离株囊膜糖蛋白基因的克隆及序列分析[J].扬州大学学报:农业与生命科学版,2003,24(1):23-25.
[10] Takagi M,Lshikawa K,Nagai H,et al.Detection of contamination of vaccines with the reticuloendotheliosis virus by reverse transcriptase polymerase chain reaction(RT-PCR)[J].Virus Res,1996,40(2):113-121.
[11] Dornburg R.Reticuloendotheliosis viruses and derived vectors[J].Gene Therapy,1995,2(5):301-310.
[12] Xie Z,Peng Y,Luo S,et al.Development of a reverse transcription loop-mediated isothermal amplification assay for visual detection of avian reovirus [J].Avian Pathol,2012,41(3):311-316.
[13] Xie Z,Tang Y,Fan Q,et al.Rapid detection of group I avian adenoviruses by a loop-mediated isothermal amplification[J].Avian Dis,2012,55(4):575-579.
[14] Xie Z,Fan Q,Liu J,et al.Reverse transcription loop-mediated isothermal amplification assay for rapid detection of bovine rotavirus[J].BMC Vet Res,2012,8(1):133.
[15] Peng Y,Xie Z,Liu J,et al.Visual detection of H3subtype avian influenza viruses by reverse transcription loop-mediated isothermalamplification assay[J].Virol J,2011(8):337.

