传染性法氏囊病病毒四川分离株VP2基因序列分析
严专强,刘 迪,,刘佳佳,覃健萍,鲁俊鹏,谢青梅,毕英佐,陈 峰*
(1.华南农业大学动物科学学院,广东广州510642;2.广东温氏食品集团股份有限公司,广东云浮527439)
鸡传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的幼鸡的一种急性高度接触性传染病。IBDV的基因组由A、B两个片段的双链 RNA组成[1-2]。A片段长约3.2kb,含有2个部分重叠并且大小不等的开放性阅读框(open reading frame,ORF)[3]。小 ORF编码非结构蛋白 VP5(17 ku),大ORF编码多聚蛋白NH2-pVP2-VP4-VP3-COOH(110ku);B片段长约2 827bp,只编码 VP1蛋白,具 有 RNA 依 赖 的 RNA 聚 合 酶 的 功 能[4-5]。在IBDV的结构蛋白中,VP2和VP3是组成病毒核衣壳的主要蛋白成分,约占病毒蛋白成分的51%和40%[6]。VP2是IBDV的主要衣壳蛋白,它含有1个高变区(206aa~350aa),包含2个亲水氨基酸区,即第1亲水区 (2124aa~224aa)和第2亲水区(314aa~324aa),2个亲水区的氨基酸变化被认为是抗原变异的主要因素[7]。VP2蛋白还是主要的保护性抗原,其诱导机体产生毒株特异性中和抗体能被动地保护宿主免受IBDV的感染[8]。
根据致病型和病毒中和试验可将血清I型IBDV分为经典毒株(classical IBDV,cIBDV)、变异株(variant IBDV,vIBDV)和超强毒株(very virulent IBDV,vvIBDV)。目前,临床上存在着超强毒株、经典毒株和变异株等各种致病型病毒株的流行,其危害主要表现为:一是IBDV感染导致鸡群生产力下降或死亡,造成直接经济损失;二是感染IBDV可导致鸡群免疫抑制,致使机体免疫应答水平下降,增加并发或继发感染其他疾病的机会,引起鸡广泛的临床发病和死亡而带来经济损失[9]。鉴于上述原因,本研究对2011年4月~8月分离于四川主要养禽地区的10株鸡传染性法氏囊病病毒进行VP2基因的克隆测序,旨在从分子水平探索四川地区IBDV的流行特点,及时了解病毒的变异情况,为研究近年来出现的免疫失败和IBD的有效防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、菌种和克隆载体 本研究所选取的毒株均分离自四川德阳、眉山等地区的养鸡场,分别命名 为 DXH-201104、LDP-201104、LFL-201106、LKL-201106、 LKM-201106、 WT-201106、 XN-201106、ZHW-201107、ZLC-201107、ZW-201107;DH5α感受态细胞为天根生化科技有限公司产品;pMD19-T Simple载体为宝生物工程((大连)有限公司产品。
1.1.2 主要试剂 AxyPrep体液病毒DNA/RNA小量试剂盒,DNA片段快速纯化/回收试剂盒为爱思进生物技术有限公司产品;一步法RT-PCR试剂盒(PrimeScript○ROne Step RT-PCR Kit Ver.2),Ex Taq DNA 聚 合 酶 (5U/μL),DNA Marker DL 2 000均为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物合成 参照文献[10]公布的引物序列合 成 引 物。IBDs 5′-GCCGATGATTACCAAT-TCTCATC-3′,IBDa 5′-CCGGATTATGTCTTTGAAGC-3′,预期扩增片段长度为717bp,引物由奥科生物技术有限责任公司合成。
1.2.2 病毒核酸提取 病毒RNA提取根据爱思进生物技术(杭州)有限公司AxyPrep体液病毒DNA/RNA小量试剂盒的说明书进行。
1.2.3 RT-PCR扩增病毒VP2基因 反转录参照一步法RT-PCR试剂盒采用25μL体系,RT-PCR反应条件为:50℃反转录30min;94℃5min;94℃40s、56℃40s、72℃40s,30个循环;72℃延伸10min,4℃终止反应。扩增产物用10g/L琼脂糖电泳检测,并用凝胶成像系统对电泳结果成像。
1.2.4 RT-PCR产物的纯化与克隆测序 PCR产物纯化回收按Axygen公司的胶纯化试剂盒说明书进行,回收后产物与pMD19-T Simple载体混合离心后于16℃条件下连接过夜;将连接产物转化至大肠埃希菌DH5α感受态细胞,涂布于含氨苄西林的LB固体培养基上,37℃培养过夜,挑选抗性菌落扩大培养,提取质粒,用PCR进行鉴定,样品由奥科生物技术有限责任公司测序。
1.2.5 序列分析与遗传进化树构建 用DNA Star对分离株与GenBank中登录的24株参考毒株VP2基因核苷酸序列及其推导的氨基酸序列进行同源性比较分析。应用ClustalX计算方法进行序列比对,使用 MEGA4.1的邻位相接法(Neighbor-joining法)进行进化树的构建,并用Bootstrap对进化树进行统计验证。参考毒株及其GenBank登录号如下:欧洲超强毒株UK661(NC004178),日本超强毒株OKYM(D49706),中国香港 超 强毒 株 HK46(AJ878900);经 典 毒 株 CU1(D00867)、52/70(D00869);标准毒株 CEF94 (AF194428.1)、D78(AF499929.1)、ZJ2000 (AF321056.1);疫苗株B87(DQ656516)、FW2512(DQ656499);变异毒株Variant E(AF133904.1)、GLS(AY368653.1);中国 内 地 分 离 毒 株 GX8/99(AY305386)、YN-h(EU328335.1)、SH95 (AY134874)、AH2(EU417824.1)、HuN-w(EU328328.1)、HeN-h(EU328327.1)、HLJ-7(EU042143.1)、HuB-1(EU042145.1)、JS-h (EU328329.1)、QD-h(EU328331.1)、ZJ2000 (AF321056.1)、YS07(FJ695138.1)。
2 结果
2.1 RT-PCR结果
应用合成的引物,以IBDV病毒RNA为模板进行RT-PCR扩增,电泳后出现一条717bp的目的条带,与预期片段大小相符(图1)。
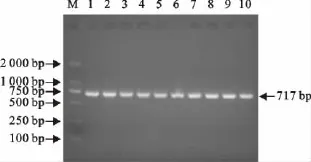
图1 IBDV分离株VP2高变区的RT-PCR扩增结果Fig.1 RT-PCR amplification of VP2gene of IBDV isolates
2.2 序列特征性氨基酸位点分析
早期研究发现,通过部分特征性氨基酸可以区分不同类型的毒株,这些氨基酸分别为超强毒株的222位(A)、256位(I)、294位(I)和299位(S),变异株的249位 (K)、254位(S)和弱毒株的253位(H)、279位(N)、284位(T)和330位(R)[11]。根据测定的9个IBDV分离株的核苷酸序列推导出其氨基酸序列,发现其毒力相关位点的特征性氨基酸与此前报道的超强毒株一致。分离株ZW-201107在254位氨基酸发生了类似变异株的变异,即G变为S。其余9个分离株均未发生抗原变异株GLS和variant E的249K和254S的变化。与常用疫苗株2512、52-70、B87(in)、Cu-1和 D78相比较,不同分离株在相关功能区内均有不同程度的氨基酸差别(表1)。
2.3 同源性分析
测序结果表明,10株传染性法氏囊病病毒分离株VP2基因的核苷酸序列长度均为717bp,编码239个氨基酸。10个分离株与参考株VP2序列通过MegAlign软件Clustal W方法进行序列比较,分析表明,各个分离株之间核苷酸序列同源性在95.3%~99.9%之间,其推导氨基酸序列同源性在99.2%~100%之间,与国内其他vvIBDV毒株的核苷酸同源性在94.3%~99.0%之间。本研究10个分离株与日本分离的超强毒株OKYM、欧洲经典强毒株52/70、美国变异株GLS、标准毒株CEF94和疫苗株B87(in)之间核苷酸和氨基酸的同源性如表2所示。可见,所有分离株与超强毒株的同源性比较高,而与经典强毒株、经典弱毒株、变异株和疫苗株的同源性较低。
2.4 遗传进化分析
将10个IBDV分离株的核苷酸序列与参考毒株的相应序列用MEGA4.0构建进化树,进行遗传进化分析。结果表明,这些毒株共形成2个大的分支,即超强毒株分支和经典毒株,其中超强毒株分为3个小群,经典毒株分为强毒株、变异株、中等毒力疫苗株和弱毒株4个小的分支(图2)。10个分离毒株均处于超强毒株分支,主要集中于2个大的亚群,LFL-201106、 LKM-201106、 WT-201106、 XN-201106、ZHW-201107和 ZLC-201107等 6个分离株与香港超强毒株HK46以及国内分离株GX8-99和 AH2处于同一亚群,DXH-201104、LDP-201104和LKL-201106等3个分离株与欧洲超强毒株UK661以及国内分离株 QD-h、HuN-w和 YN-h处于同一亚群,而分离株ZW-201107则单独处于一个小分支。
3 讨论
血清Ⅰ型的IBDV遍布全世界,基本所有的家禽主产区都有IBD发生。IBDV的感染率很高,绝大部分鸡群在幼龄阶段都面临IBDV的感染,要么是自然感染,要么是疫苗接种。传染性法氏囊病已严重威胁着包括中国在内的世界养鸡业的发展,尽管各种疫苗在防控传染性法氏囊病中起到了重要作用,但随着美国变异株和欧洲超强毒株的出现,常造成鸡群的免疫失败和经济损失,现今传染性法氏囊病仍是养禽业防控的重要对象。
本研究对10株于2011年分离自四川省部分地区的IBDV毒株的VP2基因进行了扩增和克隆测序。结果表明,扩增产物的长度均由717个核苷酸组成,编码239个氨基酸,与已发表的血清Ⅰ型IBDV毒株相比较,没有发生碱基的插入和缺失。早期研究发现,不同IBDV毒株氨基酸差异主要在VP2基因的高变区(206Y~350T)。VP2具有一个构象依赖(不连续)的中和抗原决定簇,能刺激机体产生保护性中和抗体,是决定病毒毒力和抗原性的关键区域,包含2个亲水区(AA211D~224G,AA314T~324Q)和 1 个 七 肽 区 S-W-S-A-S-G-S(AA326S~332S),2个亲水区参与病毒中和性抗原表位的形成,且不同毒株之间具有抗体交叉反应,说明2个亲水区的氨基酸序列比较保守[12]。七肽区与病毒的毒力有关,该区域的4个丝氨酸残基暴露在VP2蛋白外部,能与细胞膜形成分子间氢键,可能参与了病毒的黏附和成熟过程[4]。利用相关软件对本研究采用的分离株进行分析,结果表明,10个分离株中除ZW-201107株254位推导氨基酸为丝氨酸(S)外,其余分离株均具有超强毒株的特征性氨基酸222位(A)、249位(Q)、254位(G)、256位(I)、279位(D)、284(A)、294位(I)和299位(S),且具有富含丝氨酸(S)的七肽区。序列分析发现,本研究采用的10个分离株在第1亲水区和第2亲水区的一些氨基酸位点发生了与常用疫苗株不同的改变。与52-70株、Cu-1株和D78株相比,10株分离株均在第1亲水区222位有1个共同的氨基酸突变(P→A);而与国内常用中等毒力疫苗株B87(in)和FW2512相比,则在第1亲水区222位(L→A),第2亲水区317位(N→S)。IBDV VP2是病毒主要的宿主保护性抗原,其2个大亲水区的关键性氨基酸对于vvIBDV的抗原性至关重要,其位点的改变可能导致VP2蛋白抗原性发生改变,上述氨基酸的变化可能是导致目前国内IBD疫苗对IBDV超强毒株保护力降低的原因之一。而分离株ZW-201107与标准血清I型相比在抗原关键位点254位氨基酸发生了类似变异株的变异(G→S),这一变化是否会造成IBDV抗原发生变异,是否能突破当前市售疫苗的保护,需进一步研究。

表1 10个分离株与参考毒株VP2关键位点的特征性氨基酸比较Table 1 Comparison of the amino acids at critical sites in VP2gene among the 10field isolates and the reference strains

表2 10个分离株与参考毒株之间vVP2核苷酸和推导氨基酸之间的同源性比较Table 2 Similarty comparsion of the nucleotide sequence and the deduced amino acids of vVP2gene among the 10field isolates and the reference strains

图2 IBDV VP2基因高变区进化树Fig.2 Phylogenetic tree of VP2gene HVR of IBDV
同源性分析结果表明,所有分离株与国内外分离的超强毒株同源性比较高,而与经典强毒株、经典弱毒株、变异株和中等毒力疫苗株的同源性均较低;根据VP2核苷酸序列对分离株和参考株的遗传演化进行分析表明,所有分离株均与欧洲、亚洲其他国家以及我国分离的vvIBDV处于同一亚群,因此认为所有的vvIBDV可能来自一个共同的祖先;另外,除分离株ZW-201107外,其他毒株均与超强毒株VP2高变区内的氨基酸特点相符合。由此可初步确定目前四川流行的毒株仍以超强毒株为主。
[1] Jackwood D J,Saif Y M,Hughes J H.Nucleic acid and structural proteins of infectious bursal disease virus isolates belonging to serotypes I and II[J].Avian Dis,1984,28(4):990-1006.
[2] Jeon W J,Choi K S,Lee D W,et al.Molecular epizootiology of infectious bursal disease (IBD)in Korea[J].Virus Genes,2009,39(3):342-351.
[3] 鄂 巍,张改平,罗 俊,等.鸡传染性法氏囊病病毒河南分离株HeYD VP2基因高变区基因克隆及序列分析[J].河南农业科学,2011,40(3):149-153.
[4] 岳 锋,宁红梅,银 梅,等.鸡传染性法氏囊病病毒XX08株VP2高变区基因的克隆与序列分析[J].动物医学进展,2010,31(3):35-39.
[5] Wei Y,Yu X,Zheng J,et al.Reassortant infectious bursal disease virus isolated in China[J].Virus Res,2008,131(2):279-282.
[6] 胡永新,尹燕博,许江涛,等.十一株鸡传染性法氏囊炎病毒VP2全基因序列的特征分析[J].中国兽医科学,2011,41(4):359-366.
[7] 何秀苗,韦 平,官丁明,等.2000~2007年广西鸡传染性法氏囊病病毒的分子流行病学[J].病毒学报,2009,25(6):437-444.
[8] Qi X,Gao H,Gao Y,et al.Naturally occurring mutations at residues 253and 284in VP2contribute to the cell tropism and virulence of very virulent infectious bursal disease virus[J].Antiviral Res,2009,84(3):225-233.
[9] 韦 平,丁家波.几种引起家禽免疫抑制的病毒性疾病及其作用机理[J].中国预防兽医学报,2000,22(4):316.
[10] Li Y,Wu T,Cheng X,et al.Molecular characteristic of VP2 gene of infectious bursal disease viruses isolated from a farm in two decades[J].Virus Genes,2009,38(3):408-413.
[11] Ren X,Xue C,Zhang Y,et al.Genomic analysis of one Chinese strain YS07of infectious bursal disease virus reveals unique genetic diversity[J].Virus Genes,2009,39(2):246-248.
[12] Yuwen Y,Gao Y,Gao H,et al.Sequence analysis of the VP2 hypervariable region of eight very virulent infectious bursal disease virus isolates from the northeast of China[J].Avian Dis,2008,52(2):284-290.

