美洛昔康干混悬剂的制备及其处方因素考察*
王 敏,林 茂,阮云艳
(遵义医学院 珠海校区,广东珠海 519041)
美洛昔康(Meloxicain)是新一代非甾体类抗炎药,对环氧化酶-2(cox-2)有高度选择性抑制作用,能有效抑制炎症部位前列腺素(PEG2)的合成,其消炎镇痛作用明显,临床用于治疗类风湿关节炎、骨关节性疾病,是一种新型、高效、安全的抗炎药物[1-2]。笔者将美洛昔康制成干混悬剂,使美洛昔康以微粒状态分散在介质中,大大增加美洛昔康与胃肠道粘膜接触面积,增加药物在体内的吸收速度。与美洛昔康的片剂和胶囊剂相比,干混悬剂作为一种新剂型[3-4],服用前配制成混悬剂属于液体制剂,不经过崩解、溶出过程即可被人体吸收,从而提高其生物利用度。
1 仪器与试药
1.1 仪器JA2003 精密电子天平(上海恒平科学仪器有限公司);电热恒温干燥箱(广州恒康仪器有限公司);UV-1800型紫外分光光度计(日本岛津)。
1.2 试药 美洛昔康(武汉圣天宇科技有限公司,批号20110425);蔗糖(天津市永大化学试剂有限公司,批号2011106);十二烷基硫酸钠(天津市大茂化学试剂厂,批号20110621)微粉硅胶(湖北展望药业,批号20110725);羟丙基甲基纤维素E50(上海卡乐康公司,批号20110217);羟丙基甲基纤维素E5(上海卡乐康公司,批号20110511);羟丙基甲基纤维素E3(上海卡乐康公司,批号20110522);聚维酮(PVP)K30(上海卡乐康公司,批号20100928);阿拉伯胶(天津大茂化学试剂厂,批号20110916);氢氧化钠(天津大茂化学试剂厂,批号20101024)。
2 方法与结果
2.1 原辅料相容性试验 选择蔗糖、各型号的羟丙基甲基纤维素(HPMC)、聚维酮(PVP)、十二烷基硫酸钠(SDS)、微粉硅胶作为辅料进行原辅料的相容性试验。将以上原辅料分别研磨,过150目筛,再分别称取美洛昔康、蔗糖、HPMC(E3)、HPMC(E5)、HPMC(E50)、PVP(K30)、SDS、微粉硅胶,以 200∶100∶1∶1∶1∶1∶1∶1 的重量比于研钵中用等量递加稀释混合均匀,分别于高湿 RH(75%)、强光(4500lx±500lx)、高温(60℃)的条件下放置10d进行试验,实验结果表明湿度对原辅料影响较大,则制备过程中应注意防潮。高温和强光条件下各辅料对美洛昔康的稳定性没有显著影响。
2.2 填充剂、矫味剂、助流剂用量的选择 根据预实验及相关参考文献的处方分析研究,选择蔗糖、菠萝香精、微粉硅胶分别作为填充剂、矫味剂及助流剂使用。蔗糖在处方中既作填充剂又作矫味剂,甜味适宜即可。香精用量较少,处方量的1%即可。微粉硅胶作为助流剂可以增大干混悬剂的流动性,粉末的休止角应小于40°,以微粉硅胶为单因素变量,初步选择其适宜处方比例,结果表明微粉硅胶的含量在0.5%左右时干混悬剂的流动性可以满足要求。
2.3 助悬剂种类的选择 选择以HPMC(E50、E3、E5)、PVP(K30)、阿拉伯胶五种辅料作为助悬剂,以等量递加法混合均匀,得到五种不同处方,则助悬剂种类的筛选处方设计(见表1)。根据《中国药典》的要求对其沉降体积比及再分散性进行考察。将各处方药物分别置于50mL量瓶中加水至刻度,观察其溶解情况,再用力振摇一分钟使其成混浊液再移至100mL具塞量筒中记下混悬物的最开始高度H0,静置3 h,记录混悬物最终高度H,按公式计算沉降体积比:沉降体积比=H/H0;然后将配制的混悬剂继续沉降1 d,以20 rpm速度转动,经过一定时间量筒底部沉降底部的沉降物质消失,分别以好、良好、一般、差来评价其再分散性。分别记录各处方的溶解情况、沉降体积比(F)及再分散性试验,其中以容易溶解,0.90≤F≤1.00,再分散性好为指标筛选助悬剂种类,结果(见表2)。
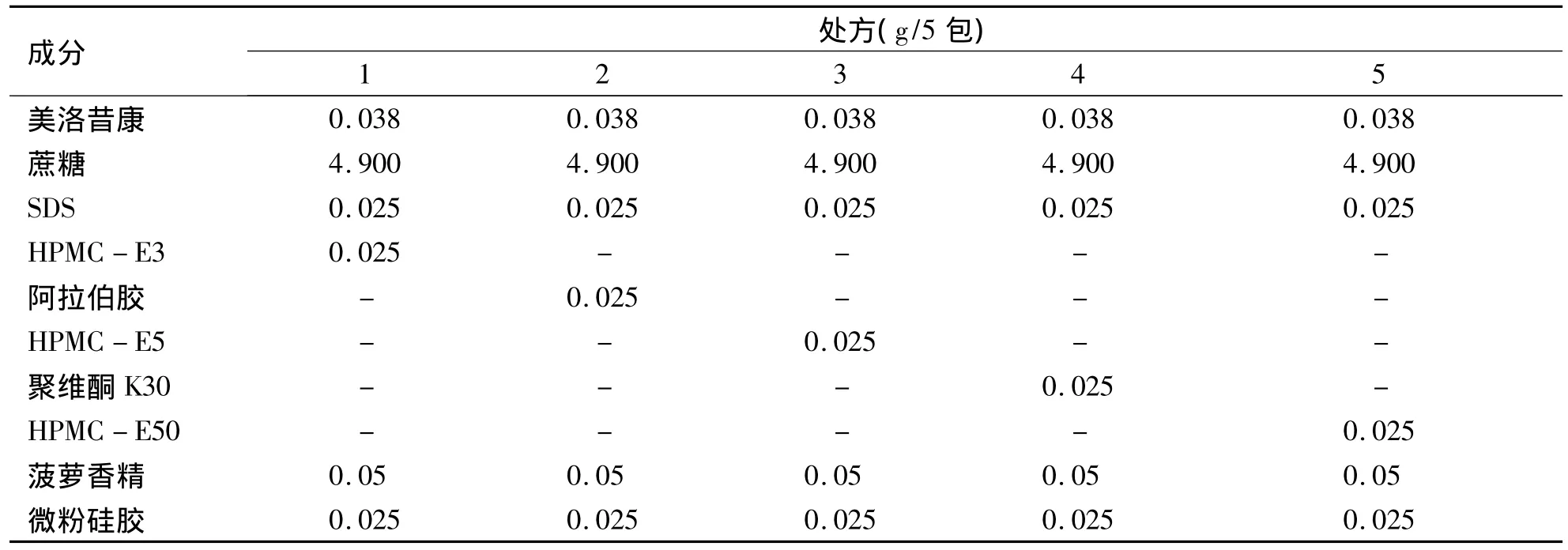
表1 助悬剂种类选择处方表
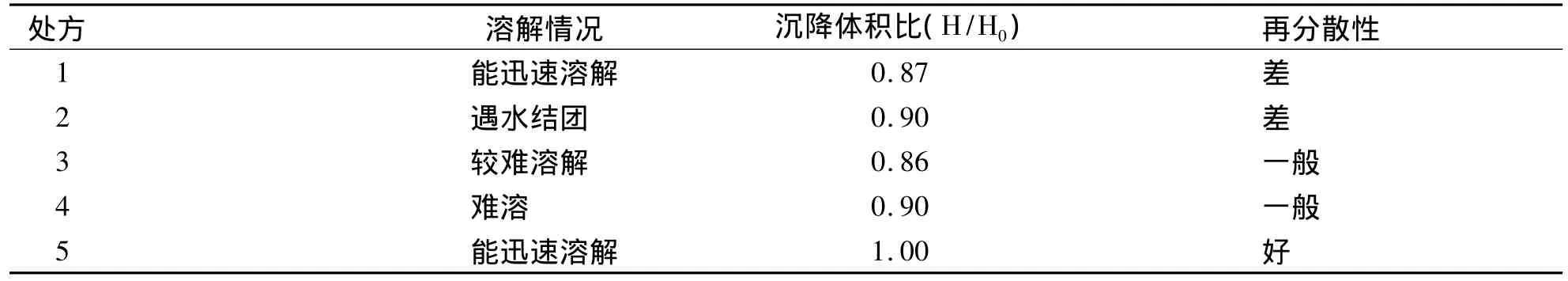
表2 不同助悬剂的试验结果
2.4 美洛昔康干混悬剂制备工艺的筛选 由Stoke’s定律可知,粒径大小直接影响混悬剂的沉降体积比,所以制备工艺选择将原辅料先过筛,再混合。根据“2.3”项下的结果,选择HPMC(E50)作为助悬剂,处方比例不变,分别将原、辅料过100目筛、150目筛、200目筛,再分别等量递加法混合,分别考察粒径对沉降体积比与再分散性的影响。结果(见表3)。结果表明过筛后制备的美洛昔康干的混悬剂沉降体积比与再分散性均符合要求,由于过筛时蔗糖过筛并不顺利,所以选择过100目筛即可。

表3 工艺筛选结果
2.5 正交试验法优化美洛昔康干混悬剂的处方
2.5.1 正交试验的因素水平值的确定 以HPMC(E50)用量(A,%)、十二烷基硫酸钠用量(B,%)、微粉硅胶用量(C,%)为因素进行L9(34)正交试验,因素水平表(见表4),其中D为空白列。
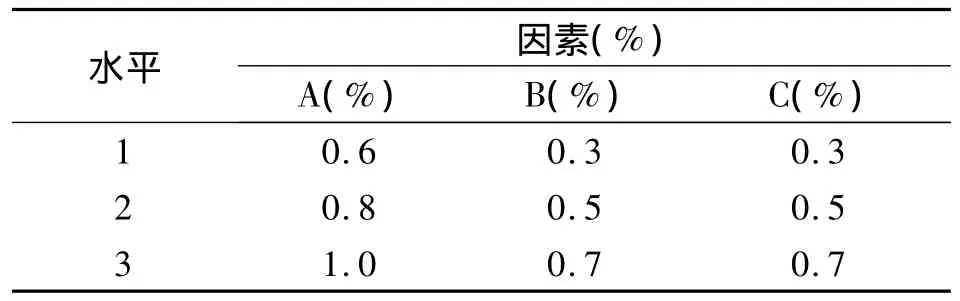
表4 因素水平表
2.5.2 正交试验 以沉降体积比作为筛选指标,按设计的处方量称取各原辅料,分别过100目筛后以等量递加法混合均匀,置于50 mL量瓶中加水至刻度,用力振摇使其成混浊液再移至100 mL具塞量筒中密塞,用力振摇均匀,记录混悬物的初始高度H0,静置3 h后,记录混悬物的最终高度H,计算沉降体积比H/H0。正交试验结果(见表5,表6)。方差分析结果表明各因素的水平值之间并无显著性差异。根据直观分析,结果表明RA﹥RC﹥RB,即HPMC(E50)对混悬剂的沉降体积比的影响最大,其次是微粉硅胶的用量,最后是十二烷基硫酸钠的用量。确定最佳处方为 A2B2C2,即 HPMC(E50)0.8%,微粉硅胶0.5%,十二烷基硫酸钠0.5%,美洛昔康0.75%,菠萝香精1%,蔗糖96.45%。
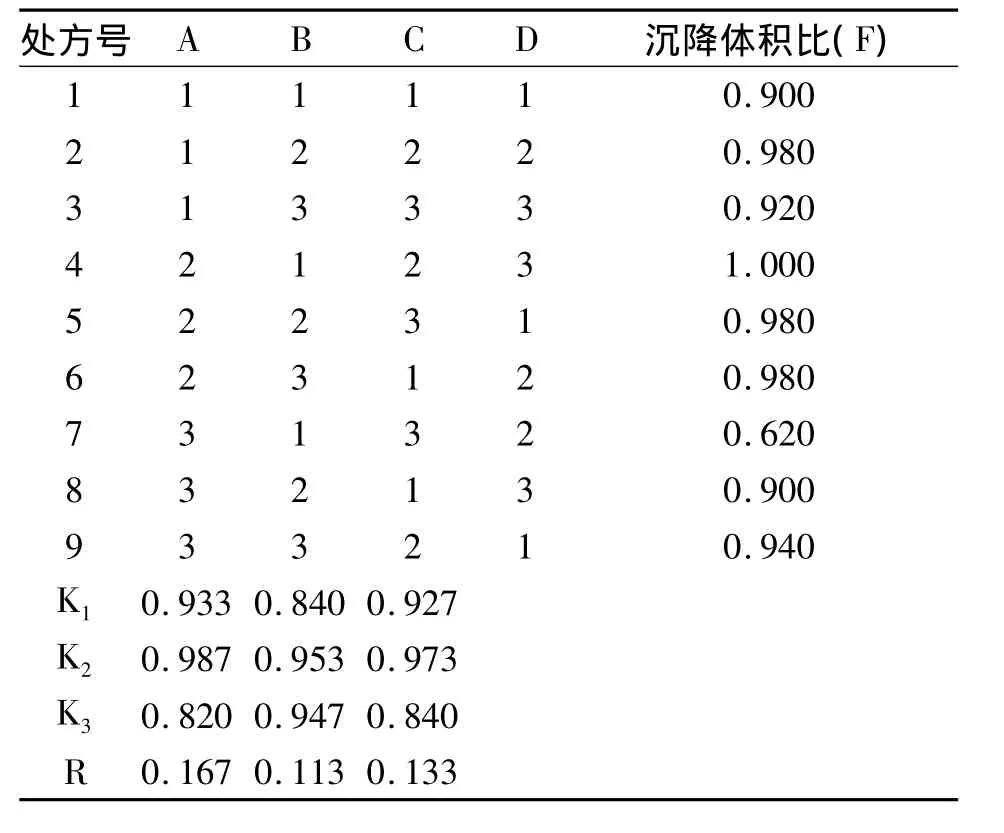
表5 正交试验结果
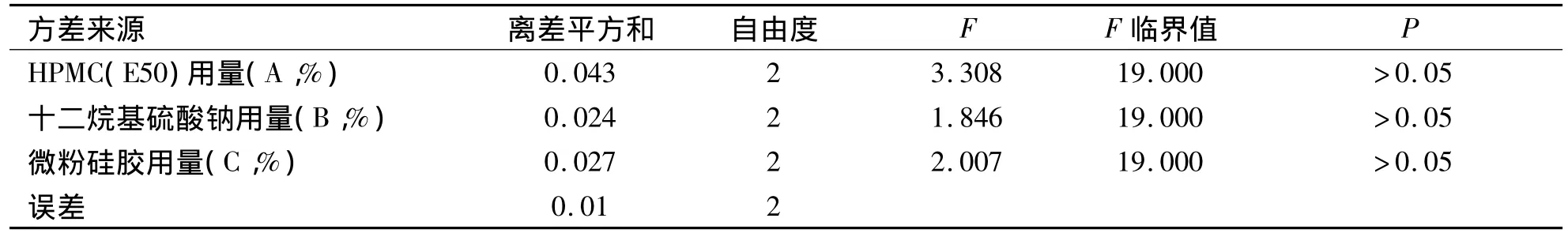
表6 方差分析表
2.6 美洛昔康含量测定方法的确定
2.6.1 测定波长的确定 称取美洛昔康10.0 mg,溶于0.1 mol/L 氢氧化钠溶液中,制成10.0 μg/mL美洛昔康溶液;同法取处方中除主药外的辅料配制成相同浓度的溶液,在200~500 nm范围内扫描,扫描图谱见图1,结果表明美洛昔康在362 nm处有最大吸收,且辅料对美洛昔康的测定没有干扰,故选择紫外条件下362 nm处进行测定美洛昔康含量。
2.6.2 标准曲线的绘制 精密称取美洛昔康10.0 mg,用0.1 mol/L 的氢氧化钠配制成 100 μg/mL 的储备液,分别吸取储备液并加0.1 mol/L氢氧化钠溶液,得到美洛昔康溶液浓度分别为 1.0、2.0、5.0、10.0、20.0 μg/mL,摇匀。以0.1 mol/L 氢氧化钠溶液作为空白对照,在362 nm处测定吸光度,得线性方程为 Y=0.02155X -0.00272(n=5,r=0.9997),表明美洛昔康在1.0 ~20.0 μg/mL 范围内线性较好。
2.6.3 精密度试验 取上述浓度为1.0μg/mL、10.0μg/mL、25.0 μg/mL(即低、中、高三个浓度)的标准溶液,以0.1 mol/L氢氧化钠溶液作为空白对照,在362 nm处测定吸光度。结果(见表7),结果表明精密度良好。
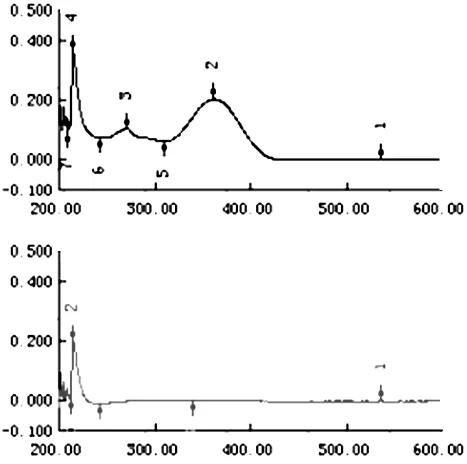
图1 美洛昔康及辅料的紫外扫描图谱

表7 精密度试验结果
2.6.4 回收率试验 精密称量美洛昔康25.0 mg,加入相应处方量的空白辅料。用0.1 mol/L的氢氧化钠稀释美洛昔康浓度为 1.0 μg/mL、10.0 μg/mL、25.0 μg/mL,同样以 0.1 mol/L 的氢氧化钠溶液为空白对照液,362 nm处测定吸光度。结果(见表8),结果表明,美洛昔康的回收率符合本实验方法的要求。
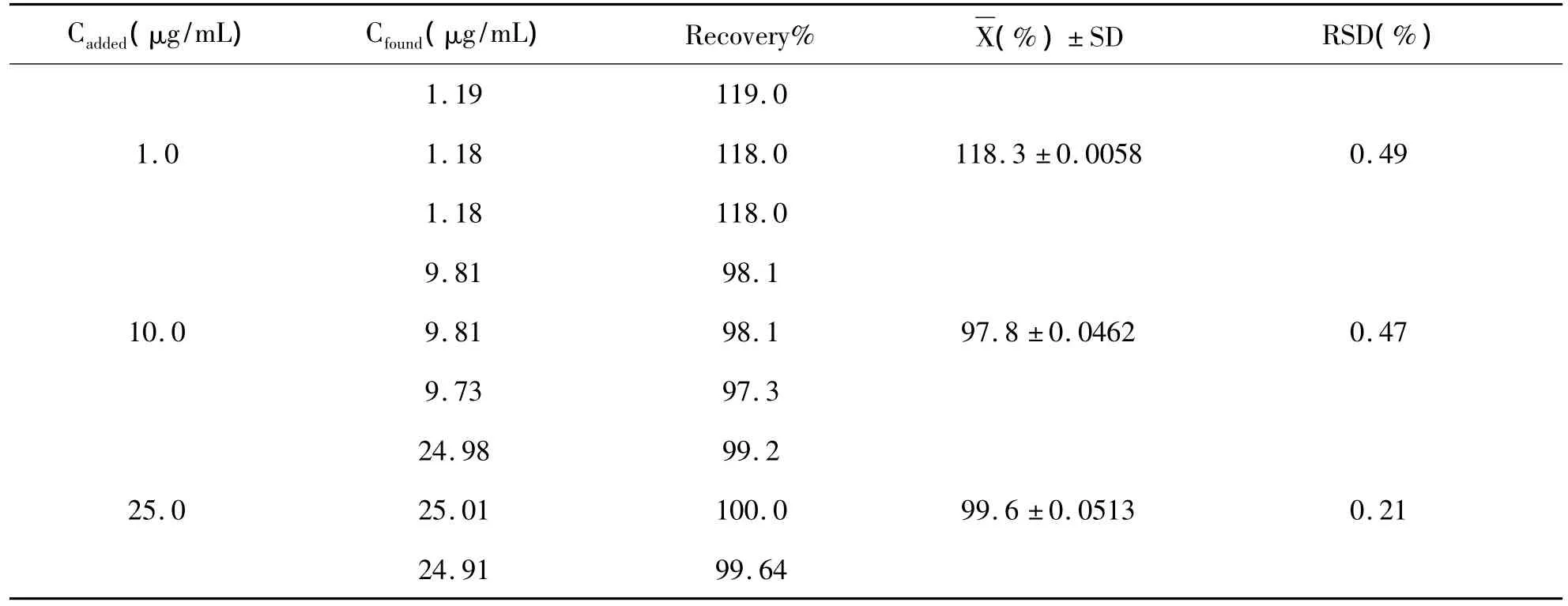
表8 美洛昔康回收率试验结果
2.6.5 美洛昔康的含量测定 取1包美洛昔康干混悬剂于50 mL容量瓶中,用0.1 mol/L氢氧化钠溶液溶解并稀释至刻度。再精密量取1 mL溶液与10 mL容量瓶中用0.1 mol/L氢氧化钠溶液稀释至刻度,用UV在362 nm处测定其吸光度。美洛昔康干混悬剂的含量测定结果如下(见表9)。

表9 美洛昔康干混悬剂的含量测定结果
2.7 最佳处方的重复性试验 按照最优化处方,及“2.5.2”项下的工艺制备美洛昔康干混悬剂三批,分别测定每批干混悬剂的含量、沉降体积比、再分散性及制备时的溶解情况。结果如下(见表10)。结果表明该处方及工艺制备的美洛昔康干混悬剂含量准确、易于溶解、沉降体积比和再分散性试验均符合要求。

表10 最佳处方重复性试验结果(n=3)
3 讨论
干混悬剂是将混悬剂的液体形式固体化,所以增加了液体制剂的稳定性,且制备工艺简单。服用干混悬剂时需加入一定量的水将其搅拌均匀,亦属于液体制剂,所以与片剂、胶囊剂相比,增加了难溶性药物在体内吸收和利用的速度和程度,即提高了生物利用度。
由于小剂量药物若制备成混悬剂,可造成分剂量不准确的问题,所以限制了这类药物的混悬剂的制备,但干混悬剂的制备工艺与固体制剂的制备工艺相似,过筛、混合即可,确保分计量准确,解决了这个问题。
根据2010版《中国药典》的制剂通则中,要求口服混悬剂的沉降体积比应不低于0.9。而根据本实验所筛选出的美洛昔康干混悬剂的最佳处方制备三批制剂,测定其沉降体积比均大于0.9,所以符合2010版《中国药典》的相关要求。
美洛昔康的单次剂量很小,只有7.5 mg,所以将其制备成干混悬剂既可以提高混悬剂的物理稳定性且分剂量准确,又可以提高其在体内的生物利用度,并且具有制备工艺简单,易于重复等优点,希望此研究可以为美洛昔康干混悬剂的剂型开发提供理论参考。
[1]Yang H C,Chen X B.Determination on dissolution of Meloxican tablet[J].Chin J Hosp Pharm,2000,20(3):143-144.
[2]Yie J Z H.Anti-inflammatory agent Meloxican[J].Foreign MedSynth Biochem Drug Med Prep Fasci,1997,18(5):273-274.
[3]杨戒骄 ,向莉,李双梅,等.头孢克肟干混悬剂制备工艺及沉降体积比影响因素研究[J].中国药房,2008,19(10):765-767.
[4]王从品,张海燕,杜伟.掩味头孢丙烯干混悬剂的制备及质量控制[J].中国药房,2009,20(34):2689-2691.

