藿香正气胶囊微生物限度检查法验证
胡 林,翁永京,万小玲,黄丽红
(四川泰华堂制药有限公司,四川广汉 618300)
藿香正气胶囊微生物限度检查法验证
胡 林,翁永京,万小玲,黄丽红
(四川泰华堂制药有限公司,四川广汉 618300)
为建立藿香正气胶囊微生物限度检查验证方法,采用多种阳性菌作为对照菌,采用回收率试验测定其抑菌成分对微生物限度检查的影响.根据回收率试验结果,藿香正气胶囊抑菌成分对微生物限度检查影响较大,通过系统性设置试验,表明薄膜过滤法、离心沉淀薄膜过滤法能消除其影响,但薄膜过滤法中枯草芽孢杆菌回收率相对较低,抑菌成分消除不彻底,而离心沉淀集菌薄膜过滤法能完全、彻底消除其抑菌作用.
微生物限度检查;抑菌成分;薄膜过滤;验证
0 引言
藿香正气胶囊是一种具有解表化湿,理气和中功效的,含有广藿香、紫苏叶、白芷、白术、陈皮、厚朴、茯苓、桔梗、甘草、大腹皮等成分的中成药,常用于外感风寒、内伤湿滞、头痛昏重、胸隔痞闷、脘腹胀痛和呕吐泄泻等症的治疗.由于本品为含有多种抑菌成分的中药材制剂[1-17],按《药典》规定,含抑菌成分的中成药的微生物限度检查[20-21]必须在消除供试液抑菌活性后,再按规定的方法进行检查.同时,还需对所采用检测方法进行验证试验,以确认供试品的抑菌活性和保证测定方法的可靠性.据此,本研究对藿香正气胶囊微生物限度检查法进行方法验证,以评价本品微生物限度检查方法的可行性,规范微生物限度检查方法,进而提供产品质量控制依据.
1 仪器与材料
1.1 仪器
实验所用的仪器包括:生化培养箱、显微镜、立式电热蒸汽消毒器、天平、ZF-1型紫外灯、电热鼓风干燥箱、恒温水浴锅、平皿(直径90 mm)、接种针、振荡器、酒精灯、离心机等.
1.2 样品
实验所用的样品为藿香正气胶囊,由四川泰华堂制药有限公司生产(批号为,110201、110601、120301).
1.3 培养基
实验中,营养琼脂培养基用于细菌计数,玫瑰红钠琼脂培养基用于霉菌及酵母菌计数,胆盐乳糖培养基用于大肠埃希菌培养.
1.4 实验菌株
实验所有菌株包括:大肠埃希菌 CMCC(B)(44102)、金黄色葡萄球菌CMCC(B)(26003)、枯草芽孢杆菌 CMCC(B)(63501)、白色念珠菌 CMCC(F)(98001)和黑曲霉CMCC(F)(98003),所有菌株均由中国药品生物制品检定所提供.
2 方法与结果
2.1 细菌、霉菌及酵母菌计数方法验证
按照文献[20]中“细菌、霉菌及酵母菌项下计数方法的验证”方法对本品进行计数方法的验证,同时参考国家药典委员会网上公布之相关方法.
2.1.1 常规法.
为明确本品验证的过程,确保验证不受常规法分析的干扰,故做常规法的验证.
1)对照用菌液的制备.取经37℃培养18~24h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌肉汤培养物1 mL,加0.9%无菌氯化钠溶液分别稀释制成每1 mL中含菌数为50~100 cfu的菌悬液,备用.取经25℃培养18~24 h的白色念珠菌液体培养物,加0.9%无菌氯化钠溶液稀释制成每1 mL中含菌数为50~100 cfu的菌悬液,备用.取经20~25℃培养1周的黑曲霉斜面培养物,加3~5 mL 0.9%无菌氯化钠溶液,将孢子洗一下,用带有棉花的球形吸管取出菌液至无菌试管内,加0.9%无菌氯化钠溶液制成每1 mL中含孢子数为50~100 cfu的孢子悬液,备用.
2)供试液的制备.无菌操作称取供试品10 g,置入100 mL 40℃的pH值为7.0的无菌氯化钠—蛋白胨缓冲液中,充分振摇后静置,吸取上清液,作为1∶10的供试液.
3)回收率测定.
①试验组.取供试液1 mL,加入直径为90 mm的无菌平皿中,同时加入50~100 cfu试验菌株,注入10~20 mL温度不超过45℃的溶化的营养琼脂培养基或玫瑰红钠琼脂,混匀,凝固,倒置培养,每株试验菌平行制备2个平皿,记录其菌数,测定回收率.
②供试品对照组.取供试液1 mL,加入直径为90 mm的无菌平皿中,注入培养基,凝固,倒置培养.每种计数用的培养基各制备2个平板.
③活菌试验组.取50~100 cfu试验菌株加入无菌平皿中,注入培养基,凝固,倒置培养.每个菌种计数用的培养基各制备2个平板.
④稀释剂对照组.取稀释剂1 mL,加入50~100 cfu试验菌株,注入10~20 mL温度不超过45℃的溶化的营养琼脂或玫瑰红钠琼脂,混匀,凝固,倒置培养,每个菌种计数用的培养基各制备2个平板.
4)结果.细菌培养48 h,逐日点计菌落数;霉菌、酵母菌培养72 h,逐日点计菌落数.实验结果表明,实验中所有枯草芽孢杆菌回收率均未达到70%,故考虑采用培养基稀释法进行验证.
2.1.2 培养基稀释法.
1)对照用菌液和供试液的制备,同常规法.
2)回收率测定.
①试验组.分别取供试液0.2 mL,加入直径为90 mm的无菌平皿中,同时加入50~100 cfu试验菌株,注入10~20 mL温度不超过45℃的溶化的营养琼脂或玫瑰红钠琼脂培养基,混匀,凝固,倒置培养.每株试验菌平行制备2个平皿,记录其菌数,测定回收率.
②供试品对照组.取供试液0.2 mL,加入直径为90 mm的无菌平皿中,注入培养基,凝固,倒置培养.每种计数用的培养基各制备2个平板.
③活菌试验组.取50~100 cfu试验菌株加入无菌平皿中,注入培养基,凝固,倒置培养.每个菌种计数用的培养基各制备2个平板.
④稀释剂对照组.取稀释液0.2 mL,加入50~100 cfu试验菌株,加入直径为90 mm的无菌平皿中,按试验组方法操作全过程.每个菌种计数用的培养基各制备2个平板.
3)结果.细菌培养48 h,逐日点计菌落数;霉菌、酵母菌培养72 h,逐日点计菌落数.实验结果表明,实验组枯草芽孢杆菌回收率仍未达到70%,故考虑采用薄膜过滤法进行验证.
2.1.3 薄膜过滤法.
1)对照用菌液和供试液的制备,同常规法.
2)回收率试验.
①试验组.取供试品原液1 mL,用pH值为7.0无菌氯化钠—蛋白胨缓冲液50~100 mL稀释后,混匀,加入薄膜过滤器中,过滤.用无菌氯化钠—蛋白胨缓冲液冲冼,100 mL/次,每膜冲洗2次,在最后一次冲洗液中加入50~100 cfu试验菌株,过滤后取膜贴于琼脂平板培养基上培养.每种计数用的培养基各制备2个平板,测定回收率.
②供试液对照组.取供试品原液1 mL,用pH值为7.0无菌氯化钠—蛋白胨缓冲液50~100 mL稀释后,混匀,加入薄膜过滤器中,过滤.用无菌氯化钠—蛋白胨缓冲液冲冼,100 mL/次,每膜冲洗2次,过滤后取膜贴于琼脂平板培养基上培养.每种计数用的培养基各制备2个平板.
③活菌试验组.取50~100 cfu/mL试验菌株加加入无菌平皿中,注入培养基,凝固,倒置培养.每个菌种计数用的培养基各制备2个平板.
④稀释剂对照组.取缓冲液100 mL和50~100 cfu试验菌株加入薄膜过滤器中,过滤,后取膜贴于琼脂平板培养基上培养.每株试验菌平行制备2个平板.
⑤培养和计数.细菌培养48 h,逐日点计菌落数,一般以48 h的菌落数报告;霉菌、酵母菌培养72 h,逐日点计菌落数,一般以72 h的菌落数报告.点计菌落数后,计算各稀释级供试液的平均菌落数,按菌落报告规则报告菌落.
3)结果.细菌培养48 h,逐日点计菌落数;霉菌、酵母菌培养72 h,逐日点计菌落数.结果见表1、表2.
表1、2结果表明,以上各次实验回收率均在70%以上,表2结果表明,以上各次实验回收率均在70%以上,可采用薄膜过滤法进行验证.但该方法中枯草芽孢杆菌回收率有待进一步提升.为保证彻底消除产品中抑菌成分,同时保证回收率实验稳定、可行,故考虑采用离心沉淀集菌薄膜过滤法进行验证.2.1.4 离心沉淀集菌薄膜过滤法.
1)对照用菌液和供试液的制备,同常规法.

表1 薄膜过滤法验证实验(试验组菌回收率)结果表
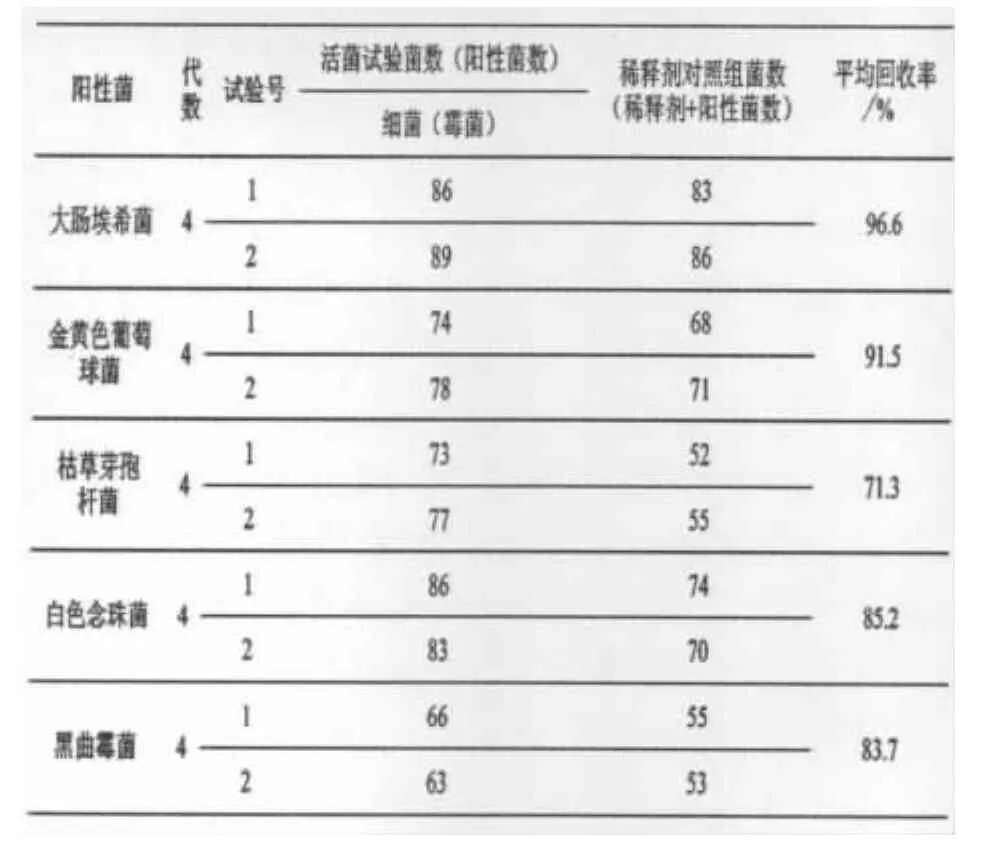
表2 薄膜过滤法验证实验(稀释剂对照组菌回收率)结果表
2)回收率测定.
①试验组.吸取供试液10 mL,于已灭菌的具塞离心管内,以500 r/min离心5 min,取上清液1 mL,用pH值为7.0无菌氯化钠—蛋白胨缓冲液100 mL稀释,混匀.加入薄膜过滤器中,过滤.用 pH值为7.0无菌氯化钠—蛋白胨缓冲液冲洗,100 mL/次,分别试验,每膜冲洗3次和5次,在最后一次冲洗液中加入50~100 cfu试验菌株,过滤后取膜贴于琼脂平板培养基上培养.每种计数用的培养基各制备2个平板,测定回收率.
②供试品对照组.取供试液1 mL,用pH值7.0无菌氯化钠—蛋白胨缓冲液100 mL稀释,混匀.加入薄膜过滤器中,过滤.冲冼液100 mL/次,分别实验,每膜冲洗3次和5次,过滤后取膜贴于琼脂平板培养基上培养.每种计数用的培养基各制备2个平板.
③活菌试验组.取50~100 cfu试验菌株加入无菌平皿中,注入培养基,凝固,倒置培养.每个菌种计数用的培养基各制备2个平板.
④稀释剂对照组.取试验用稀释液10 mL,按试验组供试液制备方法操作全过程.每个菌种计数用的培养基各制备2个平板.
3)结果.细菌培养48 h,逐日点计菌落数;霉菌、酵母菌培养72 h,逐日点计菌落数.结果见表3~表6.

表3 离心沉淀集菌薄膜过滤法验证实验(试验组菌回收率试验)结果表(冲洗液300 mL/膜;n=3)
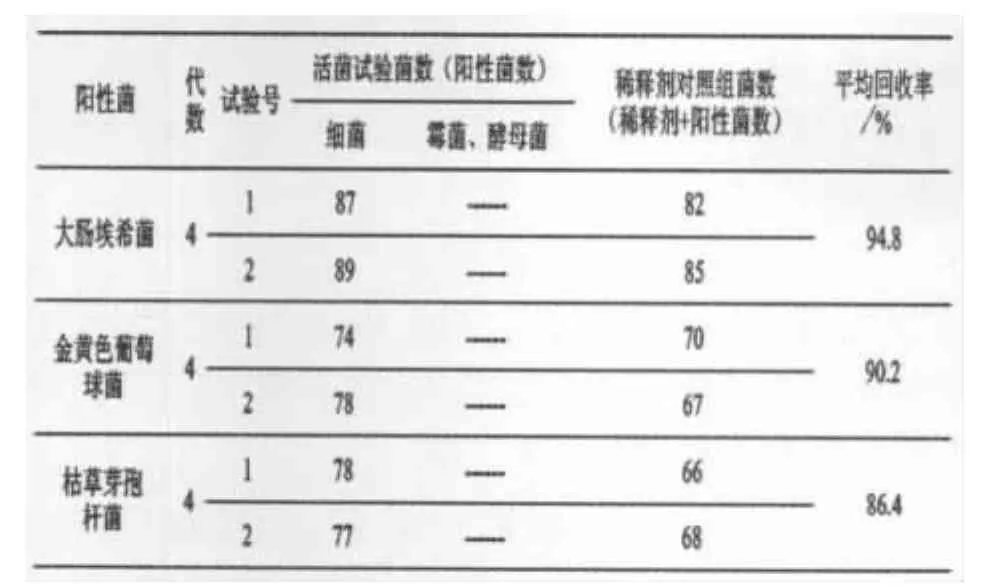
表4 离心沉淀集菌薄膜过滤法验证实验(稀释剂对照组菌回收率试验)结果表(冲洗液300 mL/膜)

表5 离心沉淀集菌薄膜过滤法验证实验(试验组菌回收率试验)结果表(冲洗液500 mL/膜;n=3)

表6 离心沉淀集菌薄膜过滤法验证实验(稀释剂对照组菌回收率试验)结果表(冲洗液500 mL/膜)
表3~6结果表明,以上各次实验回收率均在80%以上.
实验验证结果表明,薄膜过滤法对照菌的回收率均虽然达到70%以上,但该实验方法中枯草芽孢杆菌回收率相对较低,抑菌成分消除不彻底.离心沉淀集菌薄膜过滤法对照菌的回收率均达到80%以上,彻底消除了抑菌成分.同时,实验中还发现,该法随着冲洗量的增加,测定对照菌的回收率反而有下降的趋势,且实验过程中易出现滤膜破损等情况,故选择冲洗液冲洗量为300 mL/膜的离心沉淀集菌薄膜过滤法.
2.2 控制菌检查法的验证
按照文献[20]中“控制菌检查法的验证”进行验证.
2.2.1 供试液的制备.
无菌操作称取供试品10 g,置入100 mL 40℃的pH值为7.0无菌氯化钠—蛋白胨缓冲液中,充分振摇,静置,吸取上清液,作为1∶10的供试液.
2.2.2 验证实验.
1)试验组.取供试液10 mL至缓冲液100 mL中,混匀.加入薄膜过滤器中,用无菌氯化钠—蛋白胨缓冲液冲冼,100 mL/次,每膜冲洗2次,在最后一次冲洗液中加入10~100 cfu试验菌株,过滤后取膜加入增菌培养基中,按照相应控制菌检查法检查.
2)阴性菌对照组.取10~100 cfu金黄色葡萄球菌加入增菌培养基中,按照相应控制菌检查法检查,作为大肠埃希菌阴性对照.
验证实验结果如表7所示.
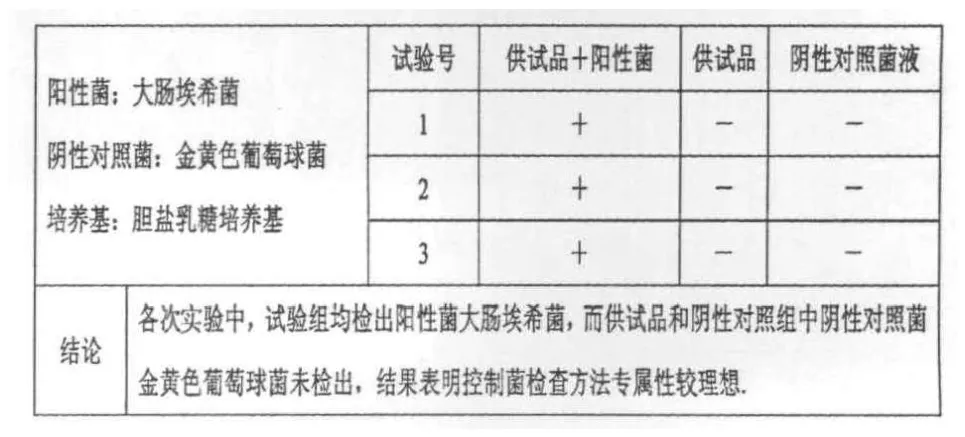
表7 验证实验结果表(n=3)
表7数据表明,以上各次实验验证的控制菌检查方法专属性较强、方法可行.
3 讨论
中药成分复杂,许多成分都有不同程度的抑菌作用,因而有必要根据各个品种、各个企业具体生产工艺,通过不同方法验证实验确立适宜的微生物限度检验方法.
本研究中的藿香正气胶囊,其药材品种较多,各药材抑菌成分复杂,且相互交替影响,故对微生物限度验证方法的选用具有典型意义.
本研究对藿香正气胶囊制剂生产过程中使用醇沉工艺、大孔树脂工艺的品种的微生物验证做了初步的研究,验证了薄膜过滤法、离心沉淀集菌薄膜过滤法等方法.实验发现,离心沉淀集菌薄膜过滤法以低速500 r/min离心,再以高速3 000 r/min离心集菌较为适宜,冲洗量达到300 mL时可消除抑菌作用,但随着冲洗量增加,易出现滤膜破损等不易控制情况.
:
[1]苏镜娱,张广文,李核,等.广藿香精油化学成分分析与抗菌活性研究(Ⅰ)[J].中草药,2001,32(3):204-208.
[2]莫小路,朱庆玲,陈瑜珍,等.几种植物精油的抗菌作用研究[J].中成药,2010,23(7):1213-1215.
[3]莫小路,严振,王玉生,等.广藿香精油对植物病原真菌的抑菌活性研究[J].中药材,2004,27(11):805-808.
[4]郭群群,杜桂彩,李荣贵.紫苏叶挥发油抗菌活性研究[J].食品工业科技,2003,25(9):25-28.
[5]吴媛媛,蒋桂华,马逾英,等.白芷的药理作用研究进展[J].时珍国医国药,2009,20(3):625-629.
[6]吕圭源.白术抗衰老作用研究[J].现代应用药学,1996,13(5):266-269.
[7]枝凤,梁逸曾,邱细敏,等.白术挥发油成分分析及其色谱指纹图谱研究[J].中草药,2004,35(1):5-9.
[8]文高艳,周贤梅.陈皮有效成分在呼吸系统中的作用研究[J].现代中西医结合杂志,2011,20(3):385-389.
[9]方玉复,魏玉平,于香安,等.陈皮对浅部真菌的试管内抑菌实验报告[J].兰州大学学报(医学版),1997,23(1):34-35.
[10]李兴春,马经野,聂俊秀.吉林省中草药对变形链球菌抑菌的研究[J].口腔医学研究,1987,3(2):65-68.
[11]李鸣宇,朱彩莲,刘正.天然植物提取物对变链菌胞外多糖的抑制[J].现代口腔医学杂志,2004,18(6):481-484.
[12]邓淑华,王晓斌,王鸿梅,等.甘草酸盐抗菌作用的实验研究[J].承德医学院学报,2011,28(3):325-328.
[13]周邦靖.几种中药在试管内对金黄色葡萄球菌凝固酶形成及白细胞吞噬作用的影响[J].成都中医学院学报,1978,4(1):73-76.
[14]张采,李佳,张永清.大枣化学成分研究概况[J].中国现代中药,2011,13(11):49-52.
[15]关俊玲,李明润,高向耘,等.不同产地大枣化学成分的含量分析[J].天津药学,2002,14(3):82-85.
[16]谢永芳,梁亦龙,杨仙,等.生姜内生菌抗菌蛋白提取及性质[J].食品研究与开发,2009,30(9):43-47.
[17]关洪全,李海波.生姜对常见污染食品真菌抗菌活性的探讨[J].辽宁中医学院学报,2000,2(3):216-219.
[18]张广波.微生物肥料应用系列报道生姜栽培中使用生物多抗菌肥的情况(一)[J].中国农业信息,2005,17(8):43-47.
[19]周孟清.生姜提取物的抗菌作用及应用[J].养殖技术顾问,2005,33(10):17-21.
[20]国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2010.
[21]马绪荣.药品微生物学检验手册[M].北京:科学出版社,2000.
Validation of Microbial Limit Test of Huoxiangzhengqi Capsule
HU Lin,WENG Yongjin,WANG Xiaoling,HUANG Lihong
(Sichuan Taihuatang Pharmaceutical Co.,Ltd.,Guanghan 618300,China)
A variety of Gram-positive bacteria are used as the control bacteria.The recovery test determines the impact of antifungal composition on microbial limit tests.According to the results of the recovery test,Huoxiangzhengqi capsule antifungal composition has great effect on the microbial limit test.Through the systematic set to test,the results show that the membrane filtration,centrifugation and membrane filtration method can eliminate its influence.But in the membrane filtration method,bacillus subtilis recovery rate is relatively low and antibacterial ingredients can't be eliminated thoroughly.The centrifugal sedimentation and membrane filtration method can eliminate the antimicrobial effect completely and thoroughly.
microbial limit test;antifungal composition;membrane filtration;verification
R284
A
1004-5422(2013)03-0224-05
2013-07-05.
胡 林(1974—),男,工程师,从事中药新制剂研究.

