正极材料聚阴离子型硅酸亚铁锂的研究进展
张 峥,马慎思,寇 丹,刘兴泉
(电子科技大学微电子与固体电子学院,新能源材料与集成能源器件研发中心,电子薄膜与集成器件国家重点实验室,成都 610054)
正极材料聚阴离子型硅酸亚铁锂的研究进展
张 峥,马慎思,寇 丹,刘兴泉
(电子科技大学微电子与固体电子学院,新能源材料与集成能源器件研发中心,电子薄膜与集成器件国家重点实验室,成都 610054)
介绍了硅酸亚铁锂(Li2FeSiO4)的结构与充放电机理;综述了Li2FeSiO4的合成方法,如高温固相法、溶胶-凝胶法、自蔓延燃烧法、微波法、熔融盐法、喷雾热解法和水热(溶剂热)法等,并比较了优缺点;探讨了改善该类正极材料电化学性能的途径(碳包覆和离子掺杂等);对发展趋势进行了展望。
锂离子电池; 聚阴离子; 正极材料; 硅酸亚铁锂(Li2FeSiO4); 正硅酸盐
硅酸亚铁锂(Li2FeSiO4)能可逆地嵌脱Li+,比容量较高,可用作锂离子电池正极材料[1]。M.E.Arroyo-de Dompablo等[2]通过计算电负性考察聚阴离子体系Li2MSiO4(M=Fe、Mn、Ni和Co)的结构稳定性与电极电位的关系,认为:Li2CoSiO4与Li2NiSiO4的电压平台高于目前所用电解液的承受能力;而Li2MnSiO4的电导率较低,且循环性能不如Li2FeSiO4,在多次循环后有向非晶态转化的趋势[3];Li2FeSiO4具有较好的循环特性与较高的比容量。
本文作者就Li2FeSiO4的结构、合成方法、表面改性与电化学性能的关系进行了综述。
1 Li2FeSiO4的结构与电化学性能
在Li2FeSiO4的结构中,阳离子都与氧形成四配位的四面体,O2-以六方密堆积分布,根据四面体中各顶角的方向不同,形成正交或单斜晶系等多种结构[3]。A.Nytén 等[4]认为:在750℃时合成的Li2FeSiO4符合β-Li3PO4结构,属正交晶系Pmn21空间群,a=0.626 61(5)nm,b=0.532 95(5)nm,c=0.501 48(4)nm,但该模型不能解释XRD图中的所有衍射峰。S.Nishimura等[5]对在800℃时合成的Li2FeSiO4进行高分辨X射线衍射(HR-XRD)分析,认为Li2FeSiO4的结构更接近单斜晶系的P21空间群,存在超晶格现象。
R.Dominko[3]认为:Li2FeSiO4材料同时存在两相甚至三相,造成结构解析的困难。C.Sirisopanaporn等[6]也认为:合成温度对材料的结构有重要影响。通过水热法在200℃制得Li2FeSiO4,并在700℃和900℃下退火,发现3种样品分属3种不同的空间群。利用恒电位间隙滴定技术比较平衡电势,认为有些样品在首次循环过程中发生了不可逆相变。
M.de Dompablo等[7]期望通过固相法合成Li2FeSiO4的脱锂态样品,即橄榄石结构的LiFeSiO4,但得到的产物并不是Li2FeSiO4,而是更稳定的Li2FeSi2O6。
A.R.Armstrong等[8]比较了 Li+在 Li2FeSiO4中沿不同方向的迁移能,认为首次循环时Li+沿着b轴和a-c轴对角线方向扩散;经过多次循环的Li2FeSiO4,结构中存在沿c轴方向的一维Li+通道,但在c轴方向上,Li+以曲折的方式运动,最小的迁移能约为0.91 eV,高于LiFePO4的迁移能[9]。
P.Zhang等[10]利用第一性原理计算文献[11]提出的Li2FeSiO4的3种可能晶体结构的热力学稳定性和嵌锂电位,发现在嵌脱Li+的过程中,SiO4四面体中Si—O键的键长几乎没有改变,FeO4中Fe—O键的键长变化与平均电压正相关。结合退火温度与晶体结构的关系可知,在嵌脱1个Li+的情况下,低温相(空间群Pmn21)的嵌脱锂电压比高温相(空间群Pmnb)高。D.H.Seo等[12]通过第一性原理计算不同结构Li2FeSiO4的稳定性,研究嵌脱锂过程中的相变过程,认为各种空间群的Li2FeSiO4均可实现Li+的脱出,但在脱锂态(即LiFeSiO4)将发生相变,引起空间群改变,最稳定的状态为氧四面体朝向一致的Pmn21相(嵌锂电位为2.823 V)。
2 Li2FeSiO4的合成方法
2.1 高温固相法
A.Nytén 等[4]利用固相法,以 Li2SiO3与 FeC2O4·H2O 为原料合成了Li2FeSiO4。将原料在丙酮中分散,加入质量分数10%的碳凝胶,用CO/CO2气氛防止Fe2+被氧化,在750℃下保温24 h。所得样品以C/16在2.0~3.7 V循环,在60℃下的首次放电比容量为165 mAh/g,经过9次循环,比容量降至 140 mAh/g。张峥等[13]将 Li2CO3、Fe2O3、Si(C2H5O)4与羟乙基纤维素球磨10 h,再在80℃下干燥,将产物研磨成粉末后,在N2气氛中、600℃下烧结10 h。制备的样品以C/5在1.5~4.7 V循环,放电比容量达113.6 mAh/g,20次循环后的容量保持率为90.3%。该方法的烧结温度低,所得样品的循环性能好。
2.2 溶胶-凝胶法
C.Deng等[14]将 LiCH3COO·2H2O 和柠檬酸铁溶于水中,边搅拌边缓慢加入饱和柠檬酸溶液,再加入溶于乙醇的正硅酸乙酯(TEOS);在80℃下保温14 h,形成溶胶,在75℃下挥发乙醇后,得到凝胶;将凝胶在100℃下烘干,得到干凝胶;经过700℃/12 h的退火处理,得到最终产物。产物以C/16在1.5~3.8 V循环,首次放电比容量为152.8 mAh/g,50次循环的容量保持率为98.3%。
X.Wu等[15]将三嵌段聚合物P123用于 Li2FeSiO4的溶胶-凝胶法合成。将P123与TEOS溶于乙醇,得到粘性混合物,将Li(CH3COO)·2H2O与Fe(NO3)3·9H2O加入并搅拌,在100℃下挥发乙醇,得到干凝胶,在氩气气氛中、650℃下烧结10 h,得到Li2FeSiO4。聚合物的加入使原料混合均匀,提高了前驱体的活性,产物在1.5~4.8 V循环,C/10首次放电比容量为185 mAh/g,10C放电比容量为120 mAh/g。
2.3 自蔓延燃烧法
M.Dahbi等[16]将 LiNO3、Fe(NO3)3·9H2O、纳米 SiO2溶于水中,加入蔗糖,将外部加热装置设定在120℃,搅拌升温蒸发水分,继续加热。前驱体中含有大量的硝酸盐及蔗糖,混合物发生自蔓延燃烧并生成粉末,发生的化学反应如下:
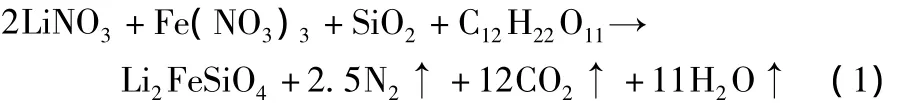
将粉末在CO/CO2气流的保护下,于800℃保温10 h,所得样品在60℃下,以C/20在1.8~4.0 V循环,首次放电比容量为130 mAh/g,循环50次,容量几乎没有衰减。
H.Zhou等[17]以聚乙烯醇(PVA)为燃料合成 Li2FeSiO4。将Li(CH3COO)·2H2O和 Fe(NO3)3·9H2O溶于水中,加入TEOS的乙醇溶液;剧烈搅拌后加入PVA,在70℃下反应5 h,再在120℃下将溶剂挥发,形成凝胶;升温至250℃引发自蔓延燃烧;将样品在500℃下继续烧结2 h,取出与淀粉混合;最后在650℃下烧结10 h,得到 Li2FeSiO4/C。样品以C/16在1.5~4.5 V循环,首次放电比容量为135 mAh/g。
2.4 微波法
Z.D.Peng等[18]将 Li2CO3、FeC2O4·2H2O、纳米 SiO2和葡萄糖分散在丙酮中,球磨16 h后干燥,制成块状;在氩气气氛中、微波恒温700℃处理12 min,合成Li2FeSiO4/C样品。所得产物以C/20在2.0~3.8 V循环,首次放电比容量为94 mAh/g,10 次循环后下降为 88.4 mAh/g。胡国荣等[19]用类似的微波合成法合成了Li2FeSiO4/C样品,在650℃下处理12 min的产物以C/20在2.0~3.8 V循环,首次放电比容量为119.5 mAh/g,10次循环后保持在116.2 mAh/g。
2.5 熔融盐法
T.Kojima等[20]采用熔融碳酸盐法合成Li2FeSiO4材料,将 Li2CO3、Na2CO3、K2CO3按物质的量比 0.435∶0.315∶0.250混合,在CO2气氛中、700℃下烧结1 h,得到复合碳酸盐;将复合盐、FeC2O4·H2O 和 Li2SiO3按物质的量比6∶5∶5混合,在CO2/H2气氛中、500℃下烧结13 h;将产物溶于水中,除去碳酸盐,加入乙炔黑球磨,再在CO2/H2气氛中、700℃下退火2 h。所得样品在60℃下以C/16在2.0~4.2 V循环,首次放电比容量为120 mAh/g。进一步利用熔融碳酸盐法考察多种原料合成的Li2FeSiO4,发现以单质Fe和Li2SiO3为原料制备的样品,电化学性能最好,C/10时的首次放电比容量达162 mAh/g,循环20次,容量没有衰减。
2.6 喷雾热解法
B.Huang等[21]利用球磨和喷雾干燥法,制备具有高活性、良好表面形貌的前驱体。用水作为分散剂,将FeC2O4·2H2O、Li2C2O4和SiO2球磨10 h,所得浆料于100℃干燥,制成前驱体,在Ar气氛中、350℃下预烧3 h;再添加蔗糖,以乙醇为分散剂,球磨15 h,在120℃真空(真空度为113 Pa)喷雾干燥,制成粉末,在Ar气氛中、700℃下烧结10 h,得到样品Li2FeSiO4/C。产物以C/10在1.5~4.6 V循环,首次放电比容量为150 mAh/g,循环80次,容量保持率为94.8%。
2.7 水热(溶剂热)法
M.Zhang 等[22]将 Fe(CH3COO)2·4H2O、Li(CH3COO)·2H2O、SiO2与葡萄糖混合,在水热釜中(装填率67%)200℃下保温72 h,取出后洗涤、离心分离,即得到Li2FeSiO4/C样品。该方法在水热反应的过程中实现了碳的包覆,简化了合成过程。产物以C/5在1.5~4.5 V循环,首次放电比容量为136 mAh/g,循环100次的容量保持率为96.1%。
Z.L.Gong等[23]利用溶剂热合成法合成 Li2FeSiO4。先将 Li(CH3COO)·2H2O、FeC2O4·H2O 和 TEOS溶于乙醇,加少量乙酸作为催化剂,在高压釜中(装填率50%)120℃下保温20 h,取出产物并与蔗糖混合球磨,将粉料压成圆片后,在N2气氛中、600℃下保温10 h,得到产物。样品在30℃下以C/16在1.5~4.8 V循环,首次放电比容量为160 mAh/g,循环50次,容量没有衰减。
2.8 超临界热合成法
D.Rangappa等[24]利用超临界热合成法制备 Li2FeSiO4纳米片。将FeCl2·4H2O和TEOS溶解于乙醇中、LiOH·H2O和柠檬酸溶解于水中,两种溶液混匀后装入容器,在400℃下保温10 min,急冷后离心干燥,得到产物。将产物与碳纳米管(CNT)混合,再在 Ar气氛中、300℃下保温3 h,得到Li2FeSiO4/CNT样品。样品的厚度只有100~120 nm,退火处理也没有改变Li2FeSiO4的二维纳米片形貌。材料在45℃下,以C/50在1.5~4.8 V循环,首次放电比容量接近于340 mAh/g,即Li2FeSiO4晶格中的两个Li+全部实现脱嵌,20次循环后的容量保持率约为85%;但在室温下放电比容量约为160 mAh/g,没有实现第2个Li+的脱嵌,说明环境温度对材料放电性能的影响显著。
2.9 不同制备方法的优缺点
固相反应法工艺简单,但产品质量稳定,均匀性和重现性较差,原料、合成温度、烧结时间和工艺对产品性能的影响较大。溶胶-凝胶法制备的产品均匀性好,粒径较小且分布均匀,形貌和活性较好;但使用大量的有机试剂,制备的成本高、工艺复杂,且对环境不友好。自蔓延燃烧法有利于降低能耗;但使用大量的有机物,制备的成本较高且对环境不友好。微波合成法具有烧结时间短、工艺简单的优点;但难以处理带还原气氛的烧结,烧结的均匀性较差,且产品的性能和重现性不佳。熔融盐合成法的工艺简单、易于控制;但对原料有特殊要求,反应时间较长、能耗较高,且对环境不友好。喷雾热解法的生产效率高、产品均匀一致性好,粒径分布较窄;但工艺较复杂,对原料要求较高,能耗较高,不便于回收有机溶剂。水热(溶剂热)法的合成条件温和、产品纯度高且物相单一;但产量有限、效率低、工艺流程长且对原料有特殊要求,不适合大规模制备。超临界热合成法能够得到性能优异、结构特殊的产品,但工艺复杂,难于控制,对设备要求高,成本难以降低,不适合规模生产。
影响Li2FeSiO4材料性能的因素很多,研究结果较凌乱,甚至有互相矛盾的地方,没有明显的规律性可循。本文作者总结发现:各种制备方法都有局限性,但提高原料纯度、降低反应温度(≤700℃)和缩短反应时间(≤24 h),以获取较小的粒径和较好的形貌,是发展的主要方向。固相法可得到电化学性能良好的产品,是工业化前景较好的方法。
3 Li2FeSiO4的改性研究
Li2FeSiO4材料的电子迁移率和离子扩散速率较低,因此常采用包覆碳材料和离子掺杂的方法来提高电化学性能。
3.1 包覆碳材料
由于本征电导率和离子扩散速率很低,纯Li2FeSiO4材料几乎没有电化学活性。碳包覆可提高材料的导电性和电化学性能,包覆的碳源分为两种:①无机碳源,主要是一些碳的单质,如碳凝胶[1]、乙炔黑[20]或 CNT[21];②有机碳源,依靠有机物在惰性环境下分解形成碳的包覆层,一般又分为小分子有机物(如柠檬酸[14]、蔗糖[16]、葡萄糖[16,19]和抗坏血酸[24]等)和高分子有机物(如羟乙基纤维素[13]、P123[15]和PVA[17]等)。碳源加入方式有3种:①前期,在混料的阶段与锂源、铁源及硅源一起混合球磨[2-3],或在溶胶-凝胶法制备溶胶的过程加入[14-15],或在水热法中先期加入水中[22];②中期,将预烧后的样品与碳源混合后,再在高温下进行退火处理[20-21];③后期,合成 Li2FeSiO4样品后,再与碳源混合,在适当的温度下退火[23-25]。
3.2 离子掺杂改性
碳包覆可提高电子的导电率,但不能改变材料的本征Li+扩散速率。有针对地选择一些金属离子取代晶格中的Li+或Fe2+,可改变材料的能带结构,使电导率得到提高。
H.J.Guo等[26]考察了Mn掺杂量对Li2FeSiO4性能的影响,认为Li2Fe0.8Mn0.2SiO4的电化学性能最好,以C/32倍率1.5~4.8 V下首次放电比容量为158.1 mAh/g。H.Hao等[27]在 Li2FeSiO4中掺杂钒(V),得到的 Li2Fe0.9V0.1SiO4/C样品以C/16在1.5~4.8 V循环,首次放电比容量可达159 mAh/g;光电子能谱实验结果证明,V可同时占据Fe位和Si位,占据Fe位为+3价,占据Si位为 +5价。S.Zhang等[28]合成了Li2Fe0.97Mg0.03SiO4和Li2FeSiO4样品,发现掺杂Mg可使材料的电导率由3.57 mS/cm升至8.96 mS/cm。X.Huang等[29]合成了缺锂的 Li1.95FeSiO4/C样品,发现比Li2FeSiO4/C具有更好倍率性能,以5C在1.5~4.8 V放电,比容量为93 mAh/g,而Li2FeSiO4/C只有84 mAh/g,作者认为是锂空位改变材料的电化学性能。M.Armand等[30]利用第一性原理计算预测Li2FeSiO4掺杂N或F后的电化学性能,认为掺杂N或F都可降低Fe3+/Fe4+电对的Li+脱出电压,但N3-的掺杂会提高Li2FeSiO4的比容量,而F-会恶化样品的电化学性能。
4 小结
Li2FeSiO4材料有多种晶型,不同合成温度与合成方法都会对材料的结构产生影响,较低温度和溶胶凝胶法制备的材料性能较好。Li2FeSiO4可实现多于1个Li+的脱嵌,理论比容量高,在高电位下可生成Fe4+离子。与LiFePO4类似,Li2FeSiO4也是一维的Li+通道,材料较低的离子迁移率和电子电导率限制了倍率性能的提高。环境温度对材料的放电性能有明显影响。通过采用包覆导电物质和对材料进行纳米化等手段有助于改善材料的电化学性能。
[1]HUANG Feng-tao(黄锋涛),XU Dan(徐丹),SHU Jie(舒洁),et al.锂离子电池正极材料 Li2MSiO4的研究进展[J].Battery Bimonthly(电池),2011,41(3):165 -167.
[2]Arroyo-de Dompablo M E,Armand M,Tarascon J M,et al.On-demand design of polyoxianionic cathode materials based on electronegativity correlations:an exploration of the Li2MSiO4system(M=Fe,Mn,Co,Ni)[J].Electrochem Commun,2006,8(8):1 292 -1 298.
[3]Dominko R.Li2MSiO4(M=Fe and/or Mn)cathode materials[J].J Power Sources,2008,184(2):462 -468.
[4]Nytén A,Abouimrane A,Armand M,et al.Electrochemical performance of Li2FeSiO4as a new Li-battery cathode material[J].Electrochem Commun,2005,7(2):156 -160.
[5]Nishimura S I,Hayase S,Kanno R,et al.Structure of Li2FeSiO4[J].J Am Chem Soc,2008,130(40):13 212 -13 213.
[6]Sirisopanaporn C,Masquelier C,Bruce P G,et al.Dependence of Li2FeSiO4electrochemistry on structure[J].J Am Chem Soc,2011,133(5):1 263 -1 265.
[7]de Dompablo M,Gallardo-Amores J M,Garcia-Martinez J,et al.Is it possible to prepare olivine-type LiFeSiO4?A joint computational and experimental investigation[J].Solid State Ion,2008,179(27-32):1 758-1 762.
[8]Armstrong A R,Kuganathan N,Islam M S,et al.Structure and lithium transport pathways in Li2FeSiO4cathodes for lithium batteries[J].J Am Chem Soc,2011,133(33):13 031 -13 035.
[9]Islam M S,Driscoll D J,Fisher C,et al.Atomic-scale investigation of defects,dopants,and lithium transport in the LiFePO4olivinetype battery material[J].Chem Mater,2005,17(20):5 085 -5 092.
[10]Zhang P,Hu C H,Wu S Q,et al.Structural properties and energetics of Li2FeSiO4polymorphs and their delithiated products from first-principles[J].Phys Chem Chem Phys,2012,14(20):7 346-7 351.
[11]Sirisopanaporn C,Masquelier C,Bruce P G,et al.Dependence of Li2FeSiO4electrochemistry on structure[J].J Am Chem Soc,2011,133(5):1 263 -1 265.
[12]Seo D H,Kim H,Park I,et al.Polymorphism and phase transformations of Li2-xFeSiO4(0 <x<2)from first principles[J].Physical Review B,2011,84(22):220 106(1 -5).
[13]ZHANG Zheng(张峥),LIU Xing-quan(刘兴泉),MA Shen-si(马慎思),et al.不同碳源对碳热还原法合成Li2FeSiO4/C电化学性能的影响[J].Electronic Components and Materials(电子元件与材料),2013,32(3):62 -66..
[14]Deng C,Zhang S,Fu B L,et al.Characterization of Li2MnSiO4and Li2FeSiO4cathode materials synthesized via a citric acid assisted sol-gel method[J].Mater Chem Phys,2010,120(1):14 -17.
[15]Wu X,Jiang X,Huo Q,et al.Facile synthesis of Li2FeSiO4/C composites with triblock copolymer P123 and their application as cathode materials for lithium ion batteries[J].Electrochim Acta,2012,80:50 -55.
[16]Dahbi M,Urbonaite S,Gustafsson T.Combustion synthesis and electrochemical performance of Li2FeSiO4/C cathode material for lithium-ion batteries[J].J Power Sources,2012,205:456 - 462.
[17]Zhou H,Einarsrud M A,Vullum-Bruer F.PVA-assisted combustion synthesis and characterization ofporous nanocomposite Li2FeSiO4/C[J].Solid State Ionic,2012,225:585 -589.
[18]Peng Z D,Cao Y B,Hu G R,et al.Microwave synthesis of Li2FeSiO4cathode materials for lithium-ion batteries[J].Chin Chem Lett,2009,20(8):1 000 -1 004.
[19]HU Guo-rong(胡国荣),CAO Yan-bing(曹雁冰),PENG Zhongdong(彭忠东),et al.微波合成法制备锂离子电池正极材料Li2FeSiO4[J].Acta Physico-Chimica Sinica(物理化学学报).2009,25(5):1 004 -1 008.
[20]Kojima T,Kojima A,Miyuki T,et al.Synthesis method of the Liion battery cathode material Li2FeSiO4using a molten carbonate flux[J].J Electrochem Soc,2011,158(12):A1 340 - A1 346.
[21]Huang B,Zheng X,Lu M.Synthesis and electrochemical properties of carbon nano-tubes modified spherical Li2FeSiO4cathode material for lithium-ion batteries[J].J Alloy Compd,2012,525:110 -113.
[22]Zhang M,Chen Q,Xi Z,et al.One-step hydrothermal synthesis of Li2FeSiO4/C composites as lithium-ion battery cathode materials[J].J Mater Sci,2012,47(5):2 328 - 2 332.
[23]Gong Z L,Li Y X,He G N,et al.Nanostructured Li2FeSiO4electrode material synthesized through hydrothermal-assisted sol-gelprocess[J].Electrochem Solid State Lett,2008,11(5):A60 - A63.
[24]Rangappa D,Murukanahally K D,Tomai T,et al.Ultrathin nanosheets of Li2MSiO4(M=Fe,Mn)as high-capacity Li-ion battery electrode[J].Nano Lett,2012,12(3):1 146 - 1 151.
[25]YAN Zi-peng(燕子鹏),CAI Shu(蔡舒),ZHOU Xing(周幸),et al.正极材料纳米Li2FeSiO4/C的溶胶-凝胶法合成及电化学性能[J].Journal of the Chinese Ceramic Society(硅酸盐学报),2012,40(2):734 -738.
[26]Guo H J,Cao X A,Li X Q,Li L M,et al.Optimum synthesis of Li2Fe1-xMnxSiO4/C cathode for lithium ion batteries[J].Electrochim Acta,2010,55(27):8 036 -8 042.
[27]Hao H,Wang J,Liu J,et al.Synthesis,characterization and electrochemical performance of Li2FeSiO4/C cathode materials doped by vanadium at Fe/Si sites for lithium ion batteries[J].J Power Sources,2012,210:397 -401.
[28]Zhang S,Deng C,Fu B L,et al.Doping effects of magnesium on the electrochemical performance of Li2FeSiO4for lithium ion batteries[J].J Electroanal Chem,2010,644(2):150 - 154.
[29]Huang X,Chen H,Zhou S,et al.Synthesis and characterization of nano-Li1.95FeSiO4/C composite as cathode material for lithium-ion batteries[J].Electrochim Acta,2012,60:239 -243.
[30]Armand M,Tarascon J M,Arroyo-de Dompablo M E.Comparative computational investigation of N and F substituted polyoxoanionic compounds:the case of Li2FeSiO4electrode material[J].Electrochem Commun,2011,13(10):1 047-1 050.
Research progress in cathode material poly-anionic lithium iron silicate
ZHANG Zheng,MA Shen-si,KOU Dan,LIU Xing-quan
(State Key Laboratory of Electronic Thin Film and Integrated Devices,Research&Development Center for New Power Materials and Integrated Power Devices,School of Microelectronics and Solid State Electronics,University of Electronic Science and Technology of China,Chengdu,Sichuan610054,China)
The structure and charge-discharge mechanism of lithium iron silicate(Li2FeSiO4)were introduced.The synthesis methods of Li2FeSiO4were summarized,such as high temperature solid state method,sol-gel method,self-propagating combustion method,microwave method,molten salt method,spray pyrolysis method and hydrothermal(solvothermal)method,their advantages and disadvantages were compared.The ways to improve electrochemical performance of this kind of cathode material such as carbon coating and onic doping were discussed.An insight into the research trends was outlined.
Li-ion battery;poly-anionic;cathode material;lithium iron silicate(Li2FeSiO4);orthosilicate
TM912.9
A
1001-1579(2013)06-0357-04
张 峥(1986-),男,辽宁人,电子科技大学微电子与固体电子学院博士生,研究方向:锂离子电池电极材料;
马慎思(1985-),男,四川人,电子科技大学微电子与固体电子学院硕士生,研究方向:锂离子电池电极材料;
寇 丹(1987-),女,四川人,电子科技大学微电子与固体电子学院硕士生,研究方向:锂离子电池电极材料;
刘兴泉(1964-),男,四川人,电子科技大学微电子与固体电子学院教授,博士生导师,研究方向:新能源材料与集成能源器件,本文联系人。
国家自然科学基金(21071026),电子科技大学杰出人才引进项目(08JC00303)
2013-04-30

