污废水预处理试验研究
韦海浪
(西北工业大学,西安710072)
ABS树脂的生产企业主要采用乳液接枝本体SAN(acrylonitrile-styrene,丙烯腈—苯乙烯共聚物)掺混生产工艺[1],废水主要来自3个方面,其中酸洗废水为最大水量,占废水排放总量的80%以上,同时以苯酚、二苯异丙醇、有苯乙烯、苯乙酮、3-羟基丙腈等有毒的芳香类和有机腈类污染物[1]为主.如果采用传统的生化处理方法,则没有好的效果.而电芬顿法是一种高级氧化方法,可以由原位电化学产生芬顿试剂氧化水体中的有机物,设备相对简单、自控化程度高、周期短、占地少、无需要辅加化学药剂,所以颇受业界关注[2-8].现就酸性废水进行预处理,研究废水中有毒、难降解污染物的电芬顿氧化转化能力.
1 试验材料与方法
1.1 试验试剂及仪器
试验试剂:Na2SO4(分析纯,北京化工厂)、FeSO4·7H2O(分析纯,国药集团化学试剂有限公司)、NaOH(分析纯,北京化工厂)、CaO(分析纯,北京化工厂)、H2SO4(分析纯,北京化工厂)、H2O2(含量为30%,分析纯,北京化工厂)、二氯甲烷(色谱纯,美国Mreda)、次氯酸钠(分析纯,有效Cl≥10%,天津晨福化学试剂厂)、O3(试验室自制).
试验仪器:OxiTop IS 12试验室BOD5分析仪(WTW公司,德国),CTL-12型化学需氧量速测仪(承德市华通环保有限公司),臭氧发生器(北京同林科技公司),7890-5975型GC-MS(安捷伦公司,美国),FL-7000型三维荧光分光光度计(日立公司,日本),UV-1700型紫外可见分光光度计(岛津公司,日本).
1.2 分析方法
1.2.1 样品的前处理
检测之前,样品需要进行处理,具体步骤为:
(1)取20 mL样品,用40%硫酸溶液调节溶液pH至2.0左右,再用二氯甲烷萃取3次(每次用10 mL二氯甲烷),萃取液用无水硫酸钠干燥;
(2)步骤(1)处理后样品溶液,用6 mol/L的NaOH溶液调节溶液pH值至12.0左右,再用和步骤(1)相同的萃取方法萃取3次,萃取液用无水硫酸钠干燥;
(3)酸碱条件下萃取的两种萃取液均匀混合,然后利用KL512型氮吹仪(北京同林科技有限公司)将混合萃取液浓缩至1 mL;
(4)利用GC-MS检测.
1.2.2 气质联用色谱的测定条件和方法
采用7683B系列自动进样器进行进样,进样量为1μL;选用HP-5MS型色谱柱(30 m×250μm×0.25μm),色谱柱流速设定为1 mL/min;进样口温度260℃,采用分流模式(分流比为5∶1);EM电压为1329 eV,四级杆温度为 150℃,离子源温度为 230℃,辅助通道温度为 260℃,扫描质量范围为10~700 amu;后运行的柱箱温度为280℃,后运行的色谱柱流速1 mL/min,后运行时间为5 min,柱温箱升温程序如表1所示.
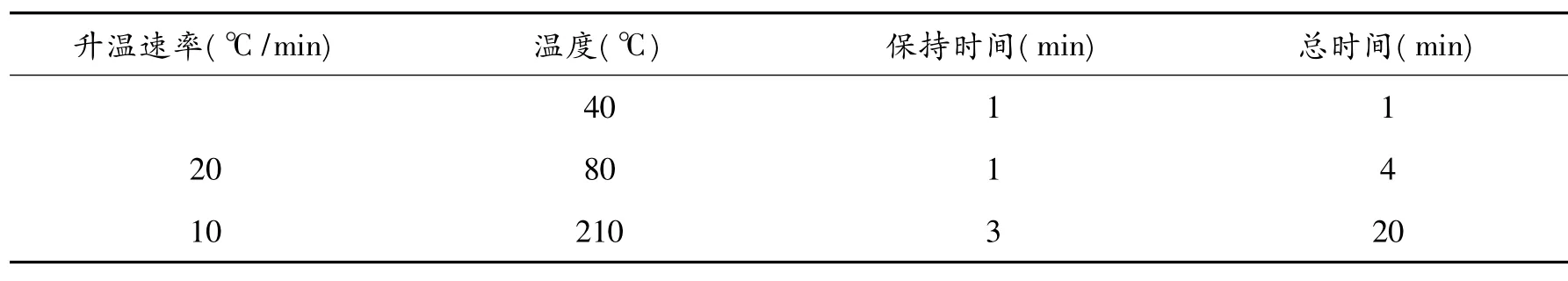
表1 GC-MS柱温箱升温程序
1.3 试验方法
如图1所示为电芬顿反应器,其尺寸为10.0 cm×4.0 cm×15.0 cm(L×B×H),阳极为表面涂有锡锑氧化物的网状钛基电极板 10.0 cm×10.0 cm(L×B),阴极为厚为1.0 cm 的炭毡子 10.0 cm×10.0 cm(L×B),反应器底部安装一个布气板.反应器间歇运行,每次运行添加300 mL的ABS凝聚干燥工段废水,然后通电进行电芬顿处理.在不同的运行条件下、不同的时间点分别取样进行COD及气质联用色谱分析,研究电芬顿对该废水中有毒有害有机物的分解转化能力.
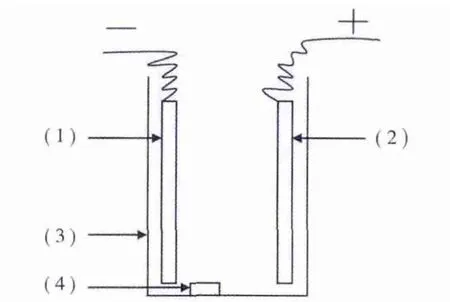
图1 电芬顿反应器结构示意图
2 结果与讨论
2.1 Fe2+离子浓度对COD去除率的影响
国内外对炭毡子作为阴极进行电芬顿反应分解有毒难降解污染物方面进行了大量的研究,发现Fe2+离子浓度对电芬顿反应有较大的影响[9].主要表现为两方面:Fe2+离子浓度偏低时,会影响催化 H2O2生成·OH的反应,如反应方程式(1)所示;Fe2+离子浓度偏高时,过量的Fe2+离子会参与消耗·OH的副反应,如反应方程式(2)所示.国外文献的报道中[10-11],用小尺寸的电极板做机理研究时,Fe2+离子的最优化浓度为0.1 mmol/L.当炭毡子电极板的尺寸增大时,相应的Fe2+离子浓度也需要有一定的增加.这主要是因为炭毡子电极板的面积增加,会使产生的H2O2浓度相应的增加,那么作为芬顿反应的催化剂Fe2+离子浓度也需要相应的增加.
本试验用到的炭毡子电极板为200mm×140mm×10mm,面积相对较大,不能够直接以0.1mmol/L的Fe2+离子浓度作为最优化条件,需要优化最佳Fe2+离子浓度.

分别在 Fe2+离子浓度为 0.1、0.3、0.6、0.9、1.2 mmol/L 的条件下,采用电芬顿氧化法处理凝聚干燥工段废水,电极板间电流为1 A(电流密度为10 mA/cm2),处理时间为2 h,废水pH值3.0.如图2所示,随着Fe2+离子浓度的升高,COD的去除效果先升高后降低.在Fe2+离子浓度为0.6 mmol/L时,电芬顿氧化法对该废水的COD去除率最高,达到45.62%.因此,最佳Fe2+离子浓度为0.6mmol/L.
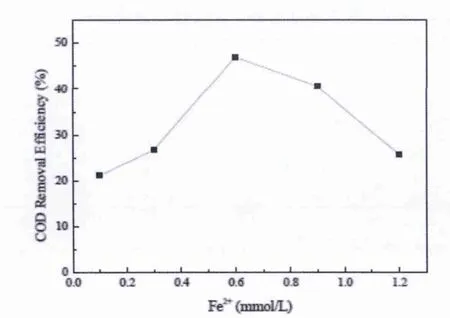
图2 Fe2+离子浓度对COD去除率的影响
2.2 处理时间的影响
在电极板间电流为1 A(电流密度为10 mA/cm2),废水pH值为3.0,Fe2+离子浓度为0.6 mmol/L的条件下,进行电芬顿氧化法处理 ABS凝聚干燥工段废水(COD浓度为1350 mg/L).分别在处理时间为0.5、1、1.5、2、3、4 h情况下,取水样进行COD测定,研究电芬顿氧化处理时间对该废水COD去除的影响.如图3所示,可以发现在最初的2 h,电芬顿氧化法对废水COD去除率随着处理时间的增加而快速增加至45.64%;连续处理2 h后,随着处理时间的增加,废水COD去除率仅由45.64%增加至48.53%,即说明电芬顿氧化作用仅能够快速地分解废水中较易分解的特征污染,而该废水中大部分较难降解的污染物不能够被电芬顿氧化分解.
由图4可以看出,凝聚干燥废水经过4 h的电芬顿氧化处理之后,废水中的苯乙酮、2-苯异丙醇和3,3-硫代丙二腈等3种特征污染物基本被氧化分解了;而废水中的2-氰基乙醚在第4 h的峰高和峰面积相对于原水有一定的减少,说明其部分被氧化分解;双(2-氰基乙基)胺经过4 h电解后,其峰高和峰面积基本没有变化,说明该物质未被电解氧化分解.
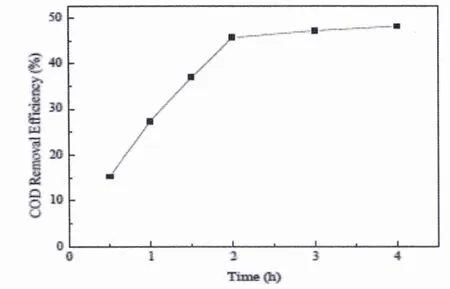
图3 处理时间对COD的去除率的影响
2.3 电芬顿氧化对废水中特征污染物的去除
分别对凝聚干燥工段废水及电芬顿处理1 h、2 h、4 h出水进行 GC-MS测试,检测分析电芬顿氧化对废水中5种主要特征污染物的去除.图4为4种水样的GC-MS测试分析的总离子流程图,表2为凝聚干燥工段废水中5种主要特征污染物.
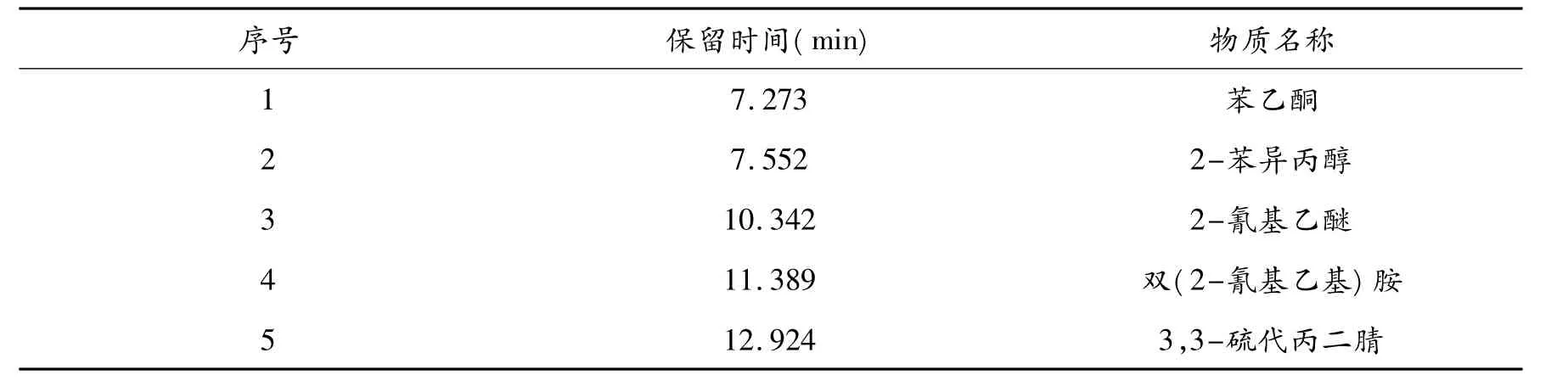
表2 ABS凝聚干燥工段废水中的5种主要特征污染物
因此,表明电芬顿氧化法对凝聚干燥工段废水中的苯乙酮和2-苯异丙醇等芳香类化合物具有很好的分解转化能力,而不能够高效地分解转化废水中2-氰基乙醚和双(2-氰基乙基)胺等丙烯腈二聚物.电芬顿氧化作用对废水中特征污染物的去除情况和废水COD去除的结果一致,即电芬顿作用仅能分解转化ABS废水中的芳香类污染物.

图4 GC-MS测试的总离子流程图
3 结论
研究表明:当Fe2+离子浓度为0.6 mmol/L时,电芬顿氧化法对该废水的 COD去除率最高,达到45.62%.电芬顿法对凝聚干燥工段废水中的苯乙酮和2-苯异丙醇等芳香类化合物具有很好的分解转化能力,但不能够高效地分解转化废水中难降解的2-氰基乙醚和双(2-氰基乙基)胺等丙烯腈二聚物.因此,电芬顿氧化能分解转化ABS废水中大量的芳香类污染物.
[1]赖波,周岳溪,宋玉栋,等.一种定性分析ABS生产废水中溶解性有机物的方法[J].光谱学与光谱分析,2011,31(3):784-788.
[2]胡成生,王刚,吴超飞,等.含甲醛毒性废水电-Fenton试剂氧化技术研究[J].环境科学,2003,24(6):106-111.
[3]Brillas E,Boye B,Banos MA,et al.Electrochemical degradation of chlorophenoxy and chlorobenzoic herbicides in acidic aqueousmedium by the peroxi-coagulation method[J].Chemophere,2003,51:227-235.
[4]解清杰,马涛,王琳玲,等.六氯苯污染沉积物的电-Fenton法处理[J].华中科技大学学报(自然科学版),2005,33(3):122-124.
[5]Shen Z,Yang J,Hu X,et al.Duelelectrodes oxidation of dye wastewater with gas dif fusion cathode[J].Environ Sci Technol,2005,39:1819-1826.
[6]Yuan SH,Lu X H.Comparison treatment of various chlorophenols by electro-Fentonmethod:relationship between chlorine content and degradation[J].Journal of Hazardous Materials,2005,118(1-3):85-92.
[7]Yuan SH,Tian M,Cui Y P,et al.Treatment of nit rophenols by cathode reduction and Electro-Fenton methods[J].JHazard Mater,2006,137:537-580.
[8]Wu GM,Yuan SH,Huang Y H,etal.Degradationmechanism of indole by anodic oxidation and electro2Fenton[J].Huazhong University of Science and Technology(Nature Science Edition),2007,35:126-128.
[9]Jin Anotai,LU ming-chun.Parichat Chewpreecha.Kinetics of aniline degradation by Fenton and electro-Fenton processes[J].Water Research,2006,40(9):1841-1847.
[10]Ugur Kurt,Omer Apaydin,Talha Gonullu M.Reduction of COD in wastewater from an organized tannery industrial region by E-lectro-Fenton process[J].Journal of Hazardous Materials,2006,143(1-2):402-408.
[11]Marcio Pimentel,Nihal Oturan,Marcia Dezotti,et al.Phenol degradation by advanced electrochemical oxidation process electro-Fenton using a carbon felt cathode[J].Apply Catalysis B:Environment,2008,83(1-2):140-149.

