二氧化钛微晶的制备与表征分析
吴海真,王自键
(渭南师范学院化学与生命科学学院,陕西渭南714000)
0 引言
二氧化钛(TiO2)是一种白色固体或粉末状的两性氧化物,俗称钛白粉,分子量79.9,沸点2500℃ ~3000℃,熔点1830℃ ~1850℃.TiO2的晶型结构有三种,其中比较常见的是锐钛矿型和金红石型,另外还有板钛矿型.纳米微晶是采用物理或化学方法合成的一类具有纳米微结构的新型材料.TiO2微晶的比表面积较大,表面吸附性能强、表面活性突出活跃[1].TiO2微晶还有良好的物理与化学性能,具有抗紫外线、抗菌、自洁净、抗老化的功效,被广泛地应用于抗紫外材料、光催化[2]、自洁玻璃、化妆品、造纸工业等.
目前制备TiO2的工艺很多,通常我们根据不同需求来制备各种品质的粒子,根据所需粒子的外观及组成、使用的不同领域等因素用不相同的制备方法制备[3],国内外目前普遍被大家认同使用的方法主要包括液相法和气相法[4].气相法反应绝大部分是在高温下极短时间内完成的,对反应器的物理特性、材质、提供动力及添加原料的方式等都有极高的要求,因此,目前气相法在中国还处在实验室试验阶段;相比来说,液相法原料来源多、价格便宜、生产设备要求不高,可以投入工业生产[5].溶胶—凝胶法制备二氧化钛:有机、无机盐等作为原料,在有机介质中进行缩聚和水解反应,溶液经过溶胶凝胶化过程得到湿凝胶,湿凝胶再经过加热、干燥和煅烧后得到二氧化钛的粉体.该反应物理化学过程是:由溶胶变成凝胶的过程发生水解聚合反应,水解聚合反应也是一对同时开始反应的竞争反应.此方法由于合成温度低、条件容易控制而被人们广泛接受[6].在低温下制备高纯度、粒径分布均匀的单组分或多组分分子级纳米粉体[7-9],是极为理想的TiO2微晶制备方法[10].
1 实验部分
1.1 实验原料及实验设备
实验原料:钛酸丁酯、无水乙醇、冰醋酸、浓盐酸等均为分析纯.
实验仪器:激光粒度分析仪(Easysizer20,麦克莫瑞提克仪器有限公司),综合热分析仪(DTG-60A/60AH,日本岛津公司),集热式恒温加热磁力搅拌器(DF-101B,上海广英仪器有限责任公司),电热鼓风干燥箱(101-2AB,南京标华环保有限公司),马弗炉(SX2,西安莱安工贸有限公司),X-射线衍射仪(XRD-6000,日本岛津公司).
1.2 实验原理
通过溶胶—凝胶法合成TiO2微晶的步骤中,最关键的步骤就是溶胶、凝胶的形成.这种方法实质就是钛酸丁酯的水解、缩聚反应,它包含典型的化学反应方程式[11]是:
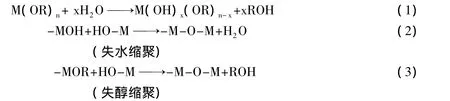
最后获得的氧化物结构、形态,关键在于第一、第二两个反应式的反应进程,若金属—氧桥—聚合物达到一定的宏观尺寸,金属—氧桥—聚合物会形成网状物,就生成了凝胶[12].
1.3 实验步骤
(1)将20 mL的钛酸丁酯和一定量的冰醋酸(钛酸丁酯与冰醋酸的比例分别为10∶3、10∶3.5和10∶4)混合并快速搅拌,再将60 mL无水乙醇在快速搅拌下缓慢加入其中,制备出A溶液,然后用浓盐酸调节pH=3;(2)将40 mL的无水乙醇与蒸馏水按1∶1的比例混合,制备出B溶液;(3)在快速搅拌下将B溶液装入分液漏斗中缓慢加入到A溶液中,不断搅拌使之成为均匀淡黄色透明溶液,然后停止搅拌.将溶液在空气中放置陈化12 h以上,形成二氧化钛湿凝胶,然后再将湿凝胶放入真空干燥箱中80℃烘干得到黄色晶体,再经研磨后于400℃、500℃、600℃和700℃下焙烧得到白色粉末TiO2微晶.
2 结果与讨论
2.1 抑制剂(冰醋酸)的加入对凝胶时间的影响
钛酸丁酯的水解反应十分迅速,它有活泼的丁氧基反应基团,能和含有羟基或质子的物质反应,在一定条件下也可与一些小分子或聚合物发生醇解和酸解反应,所以需加入冰醋酸来调节水解速率,抑制沉淀的生成且可以形成稳定的溶胶,达到延长凝胶时间的目的[12].

表1 钛酸丁酯/冰醋酸不同比例的凝胶时间
在其他实验条件不变的情况下,室温下加入不等量的冰醋酸,得到的凝胶时间如表1所示.从表1可以看出,凝胶时间随着冰醋酸用量增大而延长,它对凝胶透明度的影响不大.
2.2 不同制备条件对二氧化钛微晶粒径尺寸的影响
在粒度分析中有几个重要的表征参数:
(1)D50:累计分布百分数达到50%时所对应的粒径值,它是反映粉体粒度特性的一个重要指标,又被称作中位径或中值粒径;(2)D(4,3):表示体积平均粒径,一般情况下,它的值与D50非常接近,但是如果粒度分布严重不对称时也会显著不一致;(3)D(3,2):表示面积平均粒径,它在理论上与比表面积成反比;(4)D10:代表小于该直径的颗粒体积(重量)占颗粒总体积(重量)的10%;(5)D90:代表小于该直径的颗粒体积(重量)占颗粒总体积(重量)的90%.
2.2.1 抑制剂用量对二氧化钛微晶粒径尺寸的影响
溶胶—凝胶法制备二氧化钛实质上就是钛酸丁酯的水解与缩聚反应,加入的冰醋酸量不同,就是指延缓水解速度的程度不同,那么制备出的粉体的粒径尺寸与分散也不同.加入CH3COOH后,发生络合反应,CH3COO-作为配位体.反应发生多配位基团聚合,在水的作用下发生水解然后水解醇盐可以通过羟基缩合,然后进一步发生交联支化形成聚合物,聚合物的支化程度和凝胶中胶体的团聚情况关键在于水解和缩合的相对反应速率[12].

表2 钛酸丁酯/冰醋酸不同比例的粒径尺寸
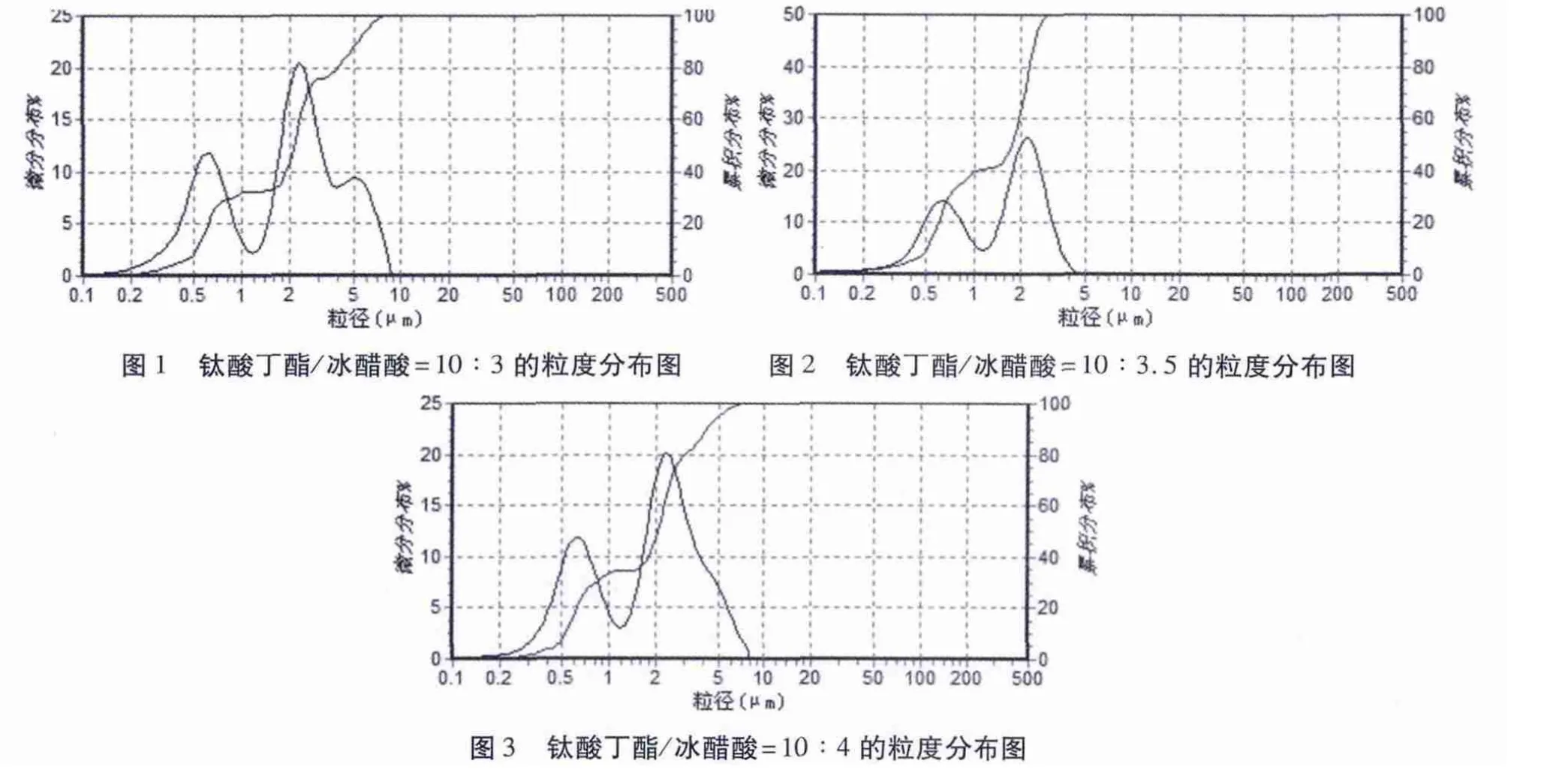
由表2可以看出,粉体都是微米级的.当钛酸丁酯与冰醋酸的比例为10∶3.5时,二氧化钛微晶的粒径尺寸最小,比例为10∶4时次之,比例为10∶3时最大;由图1、图2和图3可以看出,比例为10∶3.5时的粒度分布的峰最窄,10∶4时次之,10∶3时最宽.峰越窄则说明分散得越好.用溶胶—凝胶方法制备的粉体,粒子间团聚较明显,颗粒粒径较大.钛酸丁酯/冰醋酸的比例为10∶3.5时制得的粉体最佳.一般来说,纯样品出现的应该是单峰,若出现双分布的情况,则可能是测量时样品的浓度太高,或者是粒子表面带电太低而出现聚焦簇.
2.2.2 煅烧温度对二氧化钛微晶粒径尺寸的影响
在马弗炉中煅烧,样品会发生晶粒长大和相转换,在高温下粒子更容易发生团聚,晶粒尺寸会增加.随着温度的升高,小粒子之间的碰撞加剧,颗粒聚集速率增大,同时粒子表面单分子外延和表面反应速率加快,从而使粒径增大,分布变宽.
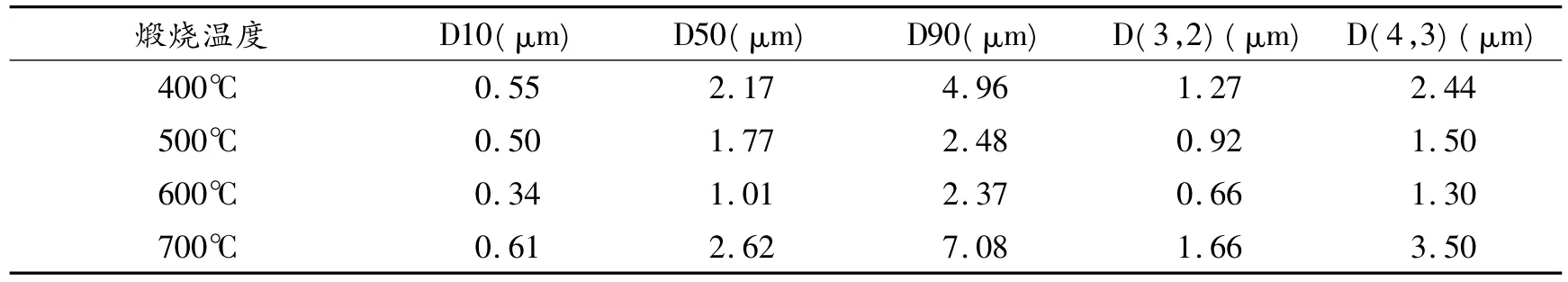
表3 不同煅烧温度下的粒径尺寸

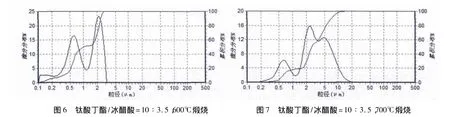
由图4至图7和表3可知,煅烧温度在700℃以下的粉体颗粒粒径大小区别不大;当温度达到700℃时,颗粒粒径尺寸明显增加,分散性也降低.这是由于高温影响了晶粒尺寸与分布.这里的纯样品粒度分布也出现了双峰,是由于粒子的团聚.
2.3 二氧化钛微晶的XRD图谱分析
图8是不同煅烧温度下二氧化钛的XRD图谱,结果显示,在煅烧温度为400℃时,所有的峰值对应锐钛矿相的晶面(110)(004)(200)(105)和(204),这与标准卡片上的标准值相一致(JCPDS NO.21-1272),晶格参数经计算,得到a=b=3.785,c=9.514,这与卡片的标准值基本一致;在煅烧温度为700℃时,所有的峰值对应金红石相的晶面(110)(101)(111)和(211),这与标注卡片上的标准值一致(JCPDS NO.21-1276),晶格参数通过计算得到a=b=4.593,c=2.959,这与标准值基本一致;在煅烧温度为500℃和600℃时,所有的峰值同时对应锐钛矿相与金红石相的晶面.从图谱上基本没有看到任何的杂质特征峰,这就表明粉体在400℃煅烧时生成结晶度良好的锐钛矿相;在500℃和600℃时由锐钛矿相转变金红石相,体系中锐钛矿相和金红石相共存;当温度升高至700℃时,已经得到了结晶度良好的金红石相.在溶胶—凝胶法反应过程中,加入冰醋酸,能够促进TiO2从无定形结构转变为锐钛矿相或金红石相,在酸性条件下,水解反应速率减慢,制得的无定形纳米TiO2具有更规整的结构,有利于晶体的成核与生长,从而在较低温度下即可由锐钛矿相转变为金红石相[2].

从峰强的情况来看,在500℃、600℃时锐钛矿相都是主相.根据普遍采用的定量分析公式

计算可得在500℃时锐钛矿相和金红石相所占比例分别为95%和5%,而在600℃时它们所占的比例分别为58%和42%.根据谢乐公式可以估算晶粒平均尺寸,在煅烧温度为400℃时,其晶粒平均尺寸为13.4 nm;当温度为700℃时,其平均尺寸为91.9 nm.
2.4 二氧化钛微晶的TG-DTA表征分析
以上XRD物相分析和TG-DTA分析的结果表明,经热处理后,亚稳态的锐钛矿相将会被稳定态的金红石相取代.干燥后的二氧化钛的TG-DTA分析曲线如图9所示,可以看出,差热(DTA)曲线有一大一小两个吸热峰.第一个吸热峰很大,位置大约是在100℃,与之相应的热重(TG)曲线也发生了明显变化,这表明样品在此温度范围出现较大比例的失重.该峰对应样品颗粒表面吸附的水分的散失引起的吸热反应.第二个峰很小,约在482℃,此时对应的热重(TG)曲线变化不明显,表明样品的质量没有发生多大变化,这对应于样品经锐钛矿相向金红石相转变过程,属于一级相变.在200℃和380℃ 左右出现了放热峰,前者样品重量有些许变化,这是由于有机物燃烧放热的结果,后者则是粉体由无定形态向锐钛矿相转变放热的结果,样品重量基本不变[13].
3 结论
采用钛酸丁酯、无水乙醇为原料,通过溶胶—凝胶法成功制备了TiO2微晶,考察钛酸丁酯与冰醋酸的比例和煅烧温度两个制备条件对TiO2凝胶时间及其晶粒尺寸与晶相的影响.(1)结果表明,钛酸丁酯/冰醋酸=10∶4时,凝胶时间最长;当钛酸丁酯/冰醋酸=10∶3.5,煅烧温度为600℃时制备的颗粒粒径最佳.(2)样品的热稳定性良好,在400℃下煅烧会呈现锐钛矿相,晶粒平均尺寸为13.4 nm;粉末在500℃和600℃煅烧后得到锐钛矿相与金红石相的混合相;在700℃下煅烧样品完全呈现金红石相,晶粒平均尺寸为91.9 nm.
[1]王丽颖,崔海宁,曾广赋,等.二氧化钛纳米微晶的制备及性质的研究[J].光谱学与光分析,1997,17(4):45-49.
[2]刘满红,胡远飞,王锐,等.超声制纳米TiO2及光催化降解活性深蓝的研究[J].工业水处理,2010,30(6):25-27.
[3]孙黎,齐建全,吴音,等.二氧化钛纳米粉体的加糖热解法制备[J].稀有金属材料与工程,2009,38(S2):943-945.
[4]卢帆,陈敏.溶胶—凝胶法制备粒径可控纳米二氧化钛[J].复旦学报(自然科学版),2010,49(5):592-596.
[5]苗利利,王水利.纳米二氧化钛制备工艺的研究[J].纳米科技,2006,5(3):47-50.
[6]潘祖仁.高分子化学[M].北京:北京化学工业出版社,2002.
[7]张彭义,余刚,蒋展鹏.光活性二氧化钛膜的制备与应用[J].环境科学进展,1998,6(5):50-56.
[8]Harizanov O,Ivanovat T,Harizanovaa A.Study of sol-gel TiO2and TiO2-MnO obtained from apeptized solution[J].Materials Letters,2001,49(3-4):165-171.
[9]Piscopoa A,Robertd D,Weber J V.Comparison between there activity of commercial and synytic TiO2photo catalysts[J].Journal of Photo-chemistry and Photobiology A:Chemistry,2001,139(2):253-256.
[10]冶银平,周惠娣,陈建敏.纳米TiO2粉体的制备及其表征[J].纳米技术与精密工程,2005,3(1):19-21.
[11]单凤君,穆柏春.溶胶—凝胶法制备纳米TiO2粉体优化及性能测试[J].辽宁化工,2004,33(6):328-330.
[12]董素芳,赵素梅.溶胶—凝胶法制备二氧化钛凝胶的影响因素分析[J].现代技术陶瓷,2005,(3):10-12.
[13]余海湖,余丁山,周灵德,等.二氧化钛微晶结构相变与光致发光[J].发光学报,2006,27(2):239-241.

