黏红酵母产油脂培养基的响应面优化
李市场 张鹏鹏 杨 娜 张 晶 王永杰
(河南科技大学食品与生物工程学院,洛阳 471003)
微生物油脂是微生物以碳水化合物、碳氢化合物和普通油脂为碳、氮源,辅以无机盐生产的一种商业价值较高的油脂[1]。随着世界人口的不断增多,动植物油脂的生产已无法满足市场需求,所以开发利用微生物进行油脂的工业化生产成为一大研究热点。
微生物油脂具有生长周期短,不受气候季节变化影响,不占用耕地等的优点,但是微生物油脂也有其局限性,最明显的一点就是微生物细胞通常含油量低,仅含2% ~3%的油脂,无法满足工业化生产的要求,但是在特定条件下某些微生物干菌体含油率可达80% ~90%,油脂产量可达15 g/L左右,这使微生物油脂的工业化生产成为可能[2]。目前国内外主要通过菌种筛选及诱变和优化发酵条件等手段来提高油脂产量[3]。为了提高微生物油脂产量,将单因素试验和响应面分析法(RSM)用于黏红酵母菌体的发酵培养基的优化,以油脂含量为响应值,采用多元二次回归拟合出方程,得培养基各营养物质的最佳配比。
1 材料与方法
1.1 菌种
黏红酵母(Rhodotorula glutinis)D30:中国工业微生物菌种保藏中心(CICC)的黏红酵母31596诱变所得的高产菌株[4]。
1.2 培养基
斜面培养基:加入2%琼脂和2%蛋白胨的10%麦芽汁,pH:5.8,115 ℃,灭菌30 min。
种子培养基:加入2%蛋白胨的10%麦芽汁,pH:5.8,115 ℃,灭菌 30 min。
发酵培养基(g/L):葡萄糖:80;蛋白胨:1.8;KH2PO4:2.5;pH:5.8,115 ℃,灭菌 30 min。
1.3 培养工艺
斜面培养:转接斜面后置于28℃的恒温培养箱中,培养48 h,4℃保藏;
种子培养:从斜面刮取3环菌体,接种于种子培养基中(250 mL三角烧瓶装液30 mL),28℃摇床转速为190 r/min培养20 h。
发酵培养:按9%的接种量接种于发酵培养基中(装液量为250 mL三角瓶装液30 mL),28℃摇床转速为190 r/min培养96 h。
1.4 油脂提取
由于黏红酵母所产生的油脂属于胞内物质,要提取出油脂必须要对细胞进行破碎[5-6]。向离心收集好的菌体加入10 mL 4 mol/L盐酸,振荡混匀,室温放置30 min后,沸水浴5 min,-20℃速冷10 min;然后使用超声波细胞破碎仪进一步破碎细胞,超声功率200 W,全程时间5 min,超声时间3 s,间歇时间4 s。
加入2倍体积氯仿∶甲醇(2∶1)提取液,充分振荡,4 000 r/min离心25 min,取氯仿层,加等体积0.1%氯化钠溶液,混匀,4 000 r/min离心25 min,取氯仿层,挥发除去氯仿即得油脂[7-8]。
1.5 气相分析油脂组成
1.5.1 样品的处理
取适量油脂样品置于10 mL具塞刻度试管中,加入石油醚-无水乙醚(4∶3)的混合溶剂5 mL,振荡溶解,再加入0.5 mol/L溶液4 mL振荡1 min,静置10~15 min后加入1 mL蒸馏水,静置分层,取上清液进样[9]。
1.5.2 气相色谱条件
选用美国安捷伦6890N气相色谱仪,采用DBWAX(30 m ×0.25 mm ×0.25 μm)毛细管石英柱;FID检测器;载气为高纯氮气;恒流模式,流速1 mL/min,尾吹气流量:30 mL/min;H2流速:40 mL/min,空气流速:400 mL/min,进样量:1 μL,分流比:1∶100;进样口温度:250℃:检测器温度:270℃柱温采用三级程序升温:初温90℃,以7℃/min升温至190℃,再以3℃/min升温至215℃保持10 min,再以20℃/min升温至230℃,保持5 min。
2 结果与分析
2.1 单因素优化试验
2.1.1 碳源对黏红酵母D30油脂产量的影响
选用葡萄糖 20、40、60、80、100 g/L 5 个梯度进行研究,发现在加入量在20~80 g/L之间时,油脂的产量随着葡萄糖的增加而增加,到80 g/L时候达到最大值,此时油脂的产量为2.73 g/L。当葡萄糖的加入量大于80 g/L时,油脂的产量反而减少。这说明葡萄糖加入量过高过低都不利于菌体生长和产油脂。若加入过低,培养基中没有足够的碳源供菌体生长;加入量过高,可能导致培养基中产生较高的糖浓度,从而抑制菌体的生长和油脂的合成。所以80 g/L即为菌体产脂的最佳碳源加入量。

图1 碳源加入量对油脂产量的影响图
2.1.2 氮源对黏红酵母D30油脂产量的影响
由图2蛋白胨与油脂产量的影响关系可知:蛋白胨作为微生物生长的氮源,当氮源的加入量为1.2~1.5 g/L随蛋白胨的增大油脂产量略微上升,当大于1.5 g/L时油脂产量急剧下降,这是因为氮源促进黏红酵母的生长繁殖,生物量随氮源的增加而增多,但是过量的氮源又不利于菌体中油脂的积累。因此,初步确定蛋白胨的添加量为1.5 g/L。

图2 氮源加入量对油脂产量的影响
2.1.3 无机盐对黏红酵母D30油脂产量的影响
由图3可以看出,当KH2PO4的加入量在2.0~3.0 g/L之间时,随着KH2PO4的加入量的增大,油脂的积累逐渐的增加,在3.0 g/L时达到最大值。当加入量大于3.0 g/L时,油脂的产量却开始下降,所以,KH2PO4的加入量选用3.0 g/L作为最优的加入量。
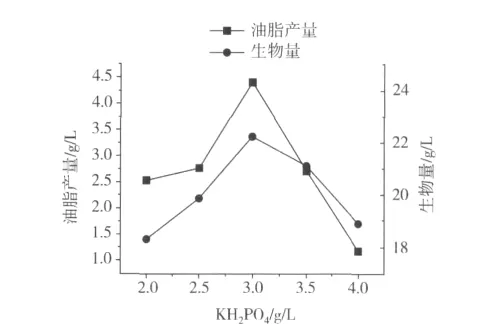
图3 KH2PO4对油脂产量的影响
由以上单因素试验,初步得出培养基的配方为(g/L):葡萄糖:80,蛋白胨:1.5,KH2PO4∶3。
由于单因素试验是在固定其他成分不变的情况下,只选取一个变量进行研究,没有考虑到各成分间的交互作用。所以,为了考察各成分间的交互作用,需要利用响应面设计对培养基进行进一步的优化。
2.2 响应面优化黏红酵母发酵培养基
2.2.1 响应面分析因素水平的选取
利用Box-Behnken试验设计[10]对培养基的3种成分葡糖糖、蛋白胨、KH2PO43个显著因素进行优化试验。以葡糖糖(X1)、蛋白胨(X2)、KH2PO4(X3)为变量,每个变量按低、中、高3个水平分别以-1、0、+1进行编码,其中高低值分别为中间值得正负1.5倍。试验因素及水平见表1。

表1 响应面分析因素和水平
2.2.2 响应面法分析结果
根据表1的因素和水平,以X1、X2、X3为自变量,以最后所得油脂重量为响应值(Y),试验方案及结果见表2。
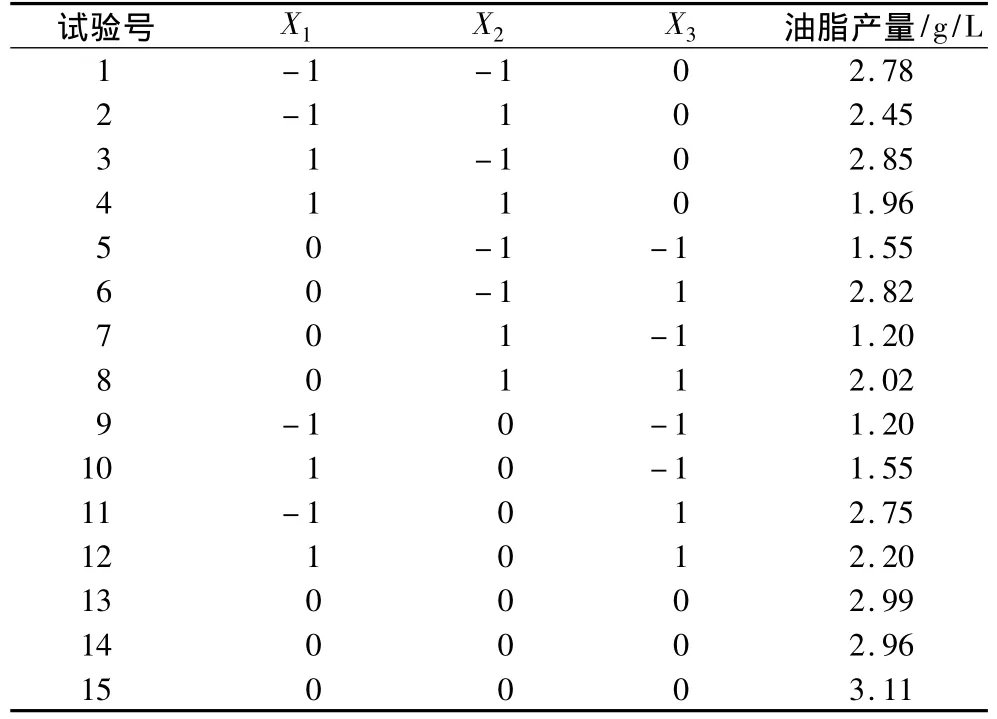
表2 响应面分析试验方案及结果
以油脂产量为响应值。根据表2中Box—Behnken设计的试验结果。运用SAS软件[11]对表2的结果进行二次回归分析。得到二次回归方程(predictive model for Y)如下:

从方差分析表3可以看出模型在α=0.01水平上回归显著,失拟项反映的是试验数据与模型不相符的情况,P=0.753 157 >0.1,失拟不显著,因此模型选择正确[12]。同时,一次项、平方项、交叉项均对响应值有显著性影响。从表3可模拟分析可信度,通过模拟分析可知,其中复相关系数的平方R2=99.67%说明模型可以解释99.67%试验所得油脂产量的变化。表明方程拟合较好。

表3 回归方程的方差分析
2.2.3 响应面图及等高线
因子的交互作用效应可以从响应曲面的坡度变化及等高线的形状得到反映,响应曲面坡度的平缓与陡峭程度,表明在培养基配比变化时黏红酵母产油量的响应灵敏程度[13-14]。如果响应曲面坡度相对平缓,响应值不敏感;反之,如果响应曲面坡度非常陡峭,表明响应值非常敏感,等高线的形状为椭圆形表示因素交互作用显著。为圆形则表示因素交互作用可忽略。

图4 Y=f(X1,X2)的响应面与等值线
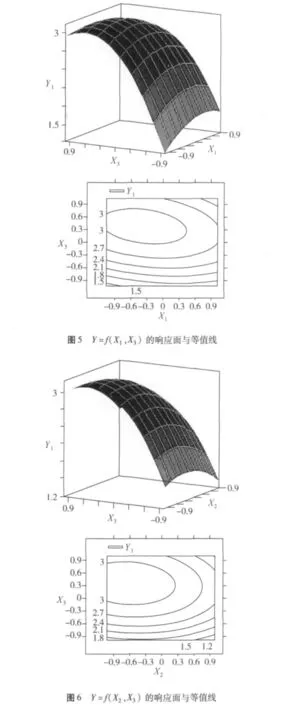
图4~图6直观地反映了各因素对响应值的影响,由等值线图可以看出存在极值的条件应该在圆心处[15]。比较3组图可知:葡萄糖(X1)对油脂产量的影响较为显著,表现为曲线较陡,而KH2PO4(X3)、蛋白胨(X2)次之,表现为曲线较为平滑,且随其数值的增加,响应值变化较小。
可得出 X1、X2、X3存在极值点,Y1的最大估计值为3.49 g/L,对应的因素浓度为葡萄糖73.40 g/L,蛋白胨1.06 g/L,磷酸二氢钾3.56 g/L。
2.2.4 验证试验
根据响应面分析得到发酵培养基最佳工艺参数为:葡萄糖 73.40 g/L,蛋白胨 1.06 g/L,磷酸二氢钾3.56 g/L。在此条件下,油脂产量的理论预测值可达到 3.49 g/L。
为了验证响应面分析的可靠性,采用上述最佳工艺参数进行验证试验,用诱变后的高产菌株D30进行验证试验,经过3次平行。

表4 优化条件下的验证试验
3 油脂脂肪酸组成
将提取得到的油脂甲酯化后进行气相色谱分析,其结果如表5
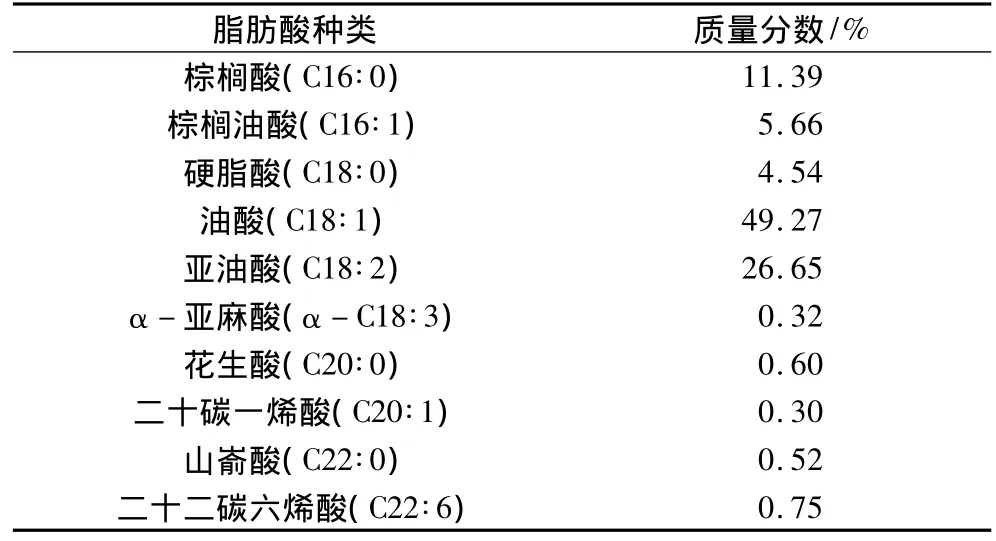
表5 脂肪酸组成及含量
结果显示,黏红酵母油脂中C16~C18的脂肪酸质量分数约为97.83%,且多不饱和脂肪酸的质量分数高达26.97%。
4 高产突变株D30的发酵动力学分析
把菌株D30接入发酵培养基进行摇瓶培养,每隔24 h取样检测其各项发酵参数如生物量、油脂产量和残糖等,结果见图7。
从D30的发酵曲线可以看出,油脂产量和生物量的增长曲线基本一致,发酵培养2 d后进入快速增长期,油脂产量随着生物量的增加而增加,同时残糖量快速减少。发酵培养6 d后进入稳定生长期,油脂开始大量积累。在10 d时,生物量和油脂产量达到最大值,分别为47.98 g/L(菌体湿重)和 7.81 g/L,此时为发酵终点。达到发酵终点以后,生物量和油脂产量均开始下降,可能是因为葡萄糖将消耗尽,菌体自溶,油脂被当做碳源被菌体利用。
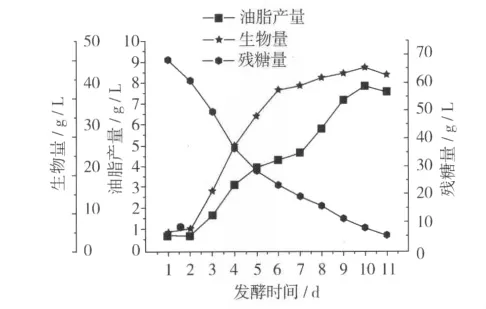
图7 D30的发酵曲线
5 结论
采用Box—Behnken设计和SAS软件分析确定出主要因素的最适浓度,得到最适发酵培养基(g/L)为:葡萄糖 73.40、蛋白胨 1.06、磷酸二氢钾 3.56,通过验证试验测得最适培养基发酵生成的油脂为3.49 g/L,比初始条件下油脂的产量提高了13%。经气相色谱分析,其多不饱和脂肪酸的质量分数高达26.97%。然后又对高产菌株的发酵特性进行研究,在10 d时,菌体量和油脂产量达到最高,糖浓度已经降到最低,此时达到发酵终点,生物量为47.98 g/L(菌体湿重),油脂产量达到7.81 g/L,具有较高的研究和应用价值。
回归方程所得到的最佳预测值与验证值非常接近,说明响应面分析法提供的模型较真实的拟合了实际情况,因此用响应面法优化油脂培养基是有效可行的。
[1]周林.生物油脂研究概况[J].粮食与食品加工,2011,18(1):20-23
[2]相光明,刘建军,赵祥颖,等.产油微生物研究及应用[J].粮食与油脂,2008(6):7-11
[3]李建,刘宏娟,张建安,等.微生物油脂研究进展及展望[J].现代工业,2007,27(2):133 -136
[4]李市场,刘红霞,朱朝阳,等.低能离子注入油脂高产菌株黏红酵母(Rhodotorula glutinis)的选育[J],中国粮油学报,2011,26(8):31 -35
[5]薛照辉,吴谋成.微生物油脂进展[J].山西食品工业,2002(2):10-12
[6]李市场,古绍彬,姚建铭,等.低能 N+离子·紫外线和60Co-γ射线对黑曲霉产木聚酶的诱变效应[J].安徽农业科学,2007,35(17):5080 -5081,5116
[7]董欣荣,曹健,赵斌,等.几种真菌油脂的检测与提取[J].郑州工程学院学报,2002,123(1):14-18
[8]周德庆.微生物学实验手册[M].上海科学技术出版社,1983:32-34
[9]咸漠,康亦兼,刘延等.菌油脂肪酸碱法甲酯化的研究[J].吉林大学自然科学学报,2001(1):103-105
[10]王敏,李市场,刘红霞,等.响应面优化黏红酵母油脂提取工艺的研究[J].中国油脂,2010,35(4):7-11
[11]孔凡敏,赵祥颖,田延军,等.酸热法提取酵母油脂条件的研究[J].中国酿造,2010,218(5):143 -146
[12]J A Singleton,L F Stikeleather.A solvent extractor system for the rapid extraction of lipids and trace bioactive micronutrients in oilseeds.[J].JAOCS,1999,76(12):1461 -1466
[13]Ward O P.Microbial production of long- chain polyunsaturated fatty acid[J].Inform,1995(6):683 -688
[14]张嘉,沈丹虹,郑晓冬.1株高产油脂酵母菌株的诱变选育及其发酵条件研究[J].浙江大学学报:农业与生命科学版,2009,35(5):497 -502
[15]张寒俊,刘大川,李永明.响应面分析法在菜籽浓缩蛋白制备工艺中的应用[J].中国油脂,2004,29(8):41 -44.

