响应面方法优化罗汉果籽油提取工艺及脂肪酸组成分析
王海波 李昌宝 吴雪辉 朱 斌 李 丽 孙 健 钟 鑫
(广西壮族自治区食品药品检验所1,南宁 530021)
(广西农业科学院农产品加工研究所2,南宁 530007)
(华南农业大学食品学院3,广州 510642)
罗汉果果实营养丰富,主要含有三萜类化合物、黄酮苷类化合物、果糖、氨基酸、脂肪酸、甘露醇、维生素及其他微量元素[1],具有提高免疫功能、保护肝脏及抑菌作用[2]、降血糖[3]、抗氧化[4]等作用;近年来,国内外对罗汉果的研究颇多,但主要集中在非糖类的甜味物质葫芦素烷三萜类化合物的研究上[5-7],对其他成分如氨基酸、黄酮、维生素、罗汉果籽油等也有研究,但文献记载不多。据程菊英等[8]报道,罗汉果种仁质量分数达41.1%,其中油酸和亚油酸分别占总脂肪酸的20.9%和52.3%,是医药上治疗冠心病和预防血管硬化较理想的油脂。此外,还含有14.7%的棕榈酸,这3种脂肪酸均为人体必需的,具有较高的开发价值。
以干燥的罗汉果籽为原料,研究各种萃取条件对罗汉果籽油得率的影响,并对罗汉果籽油进行脂肪酸组成分析,为罗汉果的综合利用和罗汉果籽油保健食品的开发提供理论依据,并解决罗汉果甜苷加工企业下脚料处理问题,使罗汉果渣变废为宝,提高罗汉果的附加值。
1 材料与方法
1.1 试验材料
罗汉果籽:经提取罗汉果甜甙后的罗汉果籽,桂林吉福斯生物有限公司。罗汉果籽含水量(15.3±0.2)%,含油率(10.11 ±0.4)%。
石油醚、正己烷、无水乙醇、三氯甲烷、丙酮、冰乙酸、环己烷、盐酸、氢氧化钾、硫代硫酸钠、碘化钾、冰乙酸:天津大茂化学试剂厂。
1.2 试验仪器
BS110S电子分析天平:北京赛多利斯天平有限公司;HK-02A中药粉碎机:广州兴荣机械设备公司;101-Ⅰ电热鼓风干燥箱:上海沪南科学仪器联营厂;HH-Ⅰ电热恒温水浴锅:上海悦丰仪器仪表有限公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂。
1.3 罗汉果籽油脂的提取
1.3.1 罗汉果籽油的提取工艺
罗汉果籽→干燥→粉碎→过筛→称重→加热回流萃取→减压蒸馏及回收溶剂→计算得率→测定脂肪酸组成
1.3.2 响应面法优化罗汉果籽油提取工艺
基于前期单因素预试验的基础,采用响应面方法中的Box-Behnken设计,在单因素试验的基础上,以萃取时间(A),料液比(B)和萃取温度(C)3个因素为自变量,选出各因素合适的上下水平值,以罗汉果籽油的得率(Y)为因变量,运用Design Expert8.0.6软件,根据 Box-Benhnken中心组合试验设计原理,进行响应面分析,各因素水平和相应编码见表1。

表1 响应面因素水平及编码
1.3.3 罗汉果籽油得率的计算
罗汉果籽油萃取完成后,使用旋转蒸发仪在(80±1)℃下蒸发掉溶剂后,测定瓶子加上油样的质量,直到恒重为止,计算公式如下:

式中:m1为空瓶质量/g;m2为空瓶的质量+油样的质量/g;m0为罗汉果籽粉末质量/g。
1.4 罗汉果籽油的品质分析
1.4.1 水分及挥发物质
按照GB/T 5528—1995植物油脂水分及挥发物含量测定法测定。
1.4.2 过氧化值、酸价、碘值、皂化值
按照GB/T 5538—2005规定的方法测定。
1.5 罗汉果籽油的GC-MS分析
油样前处理:称取1.00 g样品,以10 mL二氯甲烷溶解,加入适量无水硫酸钠置于4℃冰箱脱水12 h后过滤,滤液使用气相色谱-质谱联用仪进行检测。
气相色谱条件:HP-INNOWAX毛细管柱(30×0.25 mm,0.25 μm)。柱温:程序升温,初始温度 60℃维持3 min,以10℃·min-1升温至140℃,保持5 min,以 5 ℃·min-1升温至 250 ℃,保持 15 min。载气为高纯氮气,恒定流速:2.0 mL·min-1,进样量1μl,分流比10∶1。进样口温度:250℃。
质谱条件:接口温度280℃,EI离子源,电离能量70 eV,离子源温度230℃,四极杆温度150℃。扫描方式:全扫描25~300 u。溶剂延迟2 min。
2 分析测定方法
2.1 响应面试验
选取萃取时间(A)、料液比(B)和萃取温度(C)3个因素,对提取工艺进行响应面分析,具体方案和结果见表2。

表2 响应面设计表及试验结果
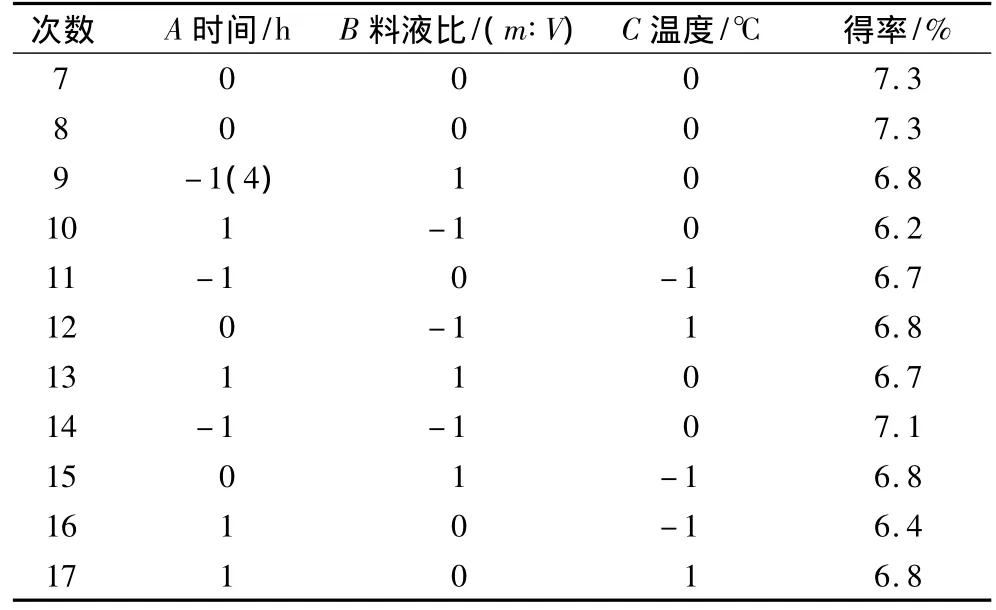
续表
2.2 模型的建立及显著性分析
对表3的数据进行处理,得到预测模型如下:
得率 =7.32 - 0.12X1+0.075X2+0.075X3+
方差分析结果如表3所示。
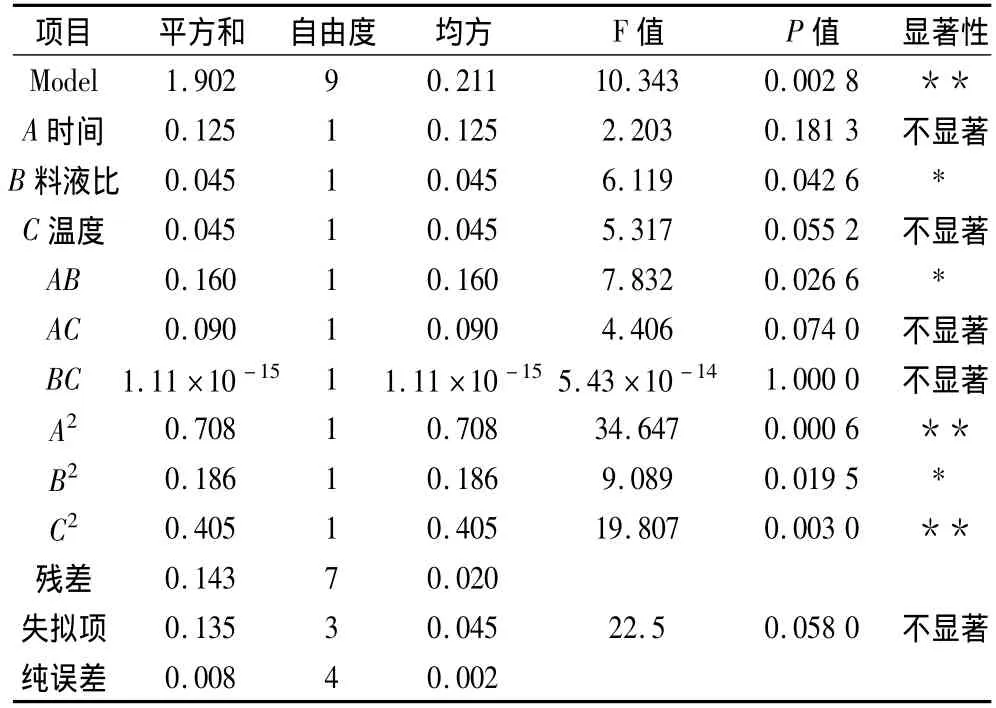
表3 方差分析表
从表3中可以看出,用上面的方程描述因子回归的P<0.05,方程回归显著,同时相关系数 R2=0.930 1,说明这种试验方法是可靠的,能够很好地描述试验结果,使用该方程代替真实的实验点进行分析是可行的。方差分析结果中,B项P<0.05说明提料液比影响显著,BC,AC项则P>0.05,说明这两项的交互作用相对较弱。同时,拟合回归模型效应达到显著水平(P<0.05)失拟项在P=0.05水平上不显著(P=0.058 0>0.05),因此可用该回归方程代替试验真实点对试验结果进行分析。
进行因子分析,结果如表4所示。

表4 回归方程各因素F值及F值检验
由表4可知,料液比对罗汉果籽油的得率的影响最大,其次是温度,萃取时间的影响最小。
2.3 响应曲面分析
3个因子交互作用的响应面如图1~图3所示。


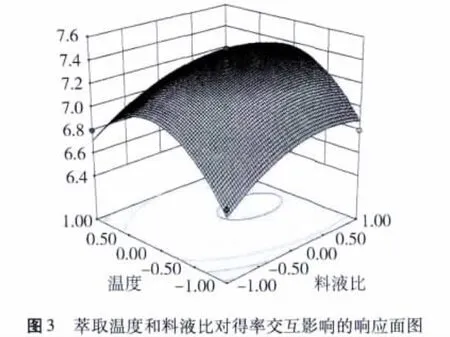
由图1~图3可见,萃取时间、萃取温度和料液比的交互作用对萃取率的影响显著,与显著性检验分析结果一致。
2.4 罗汉果籽油最优萃取工艺条件及验证
预测得出最优工艺条件为:萃取时间为6 h,料液比为1∶6,萃取温度为80℃。进行了3次验证性试验,结果分别为 8.29%、8.15%和 8.19%,与得率8.27%基本一致。因此,由响应面优化得到的罗汉果籽油萃取最优工艺条件为:萃取时间为6 h,料液比为1∶6,萃取温度为80℃。
2.5 罗汉果籽油品质分析
罗汉果籽油感官和理化分析见表5。
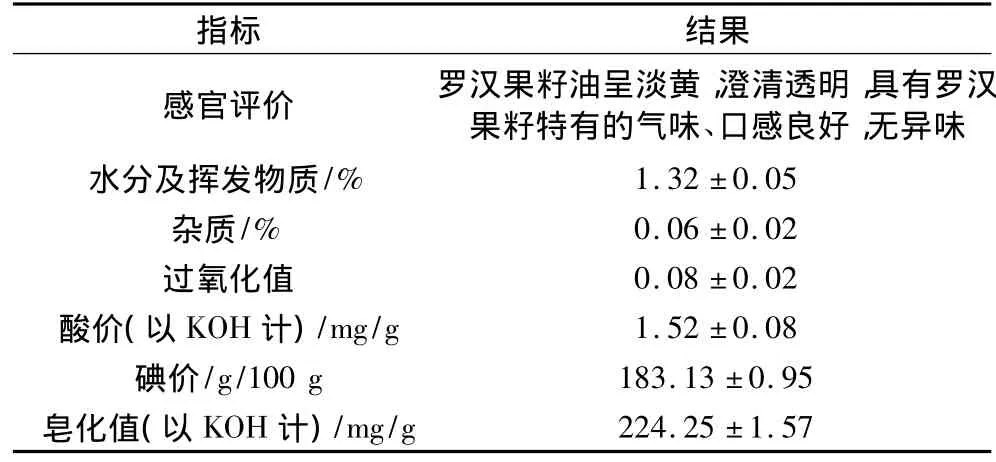
表5 罗汉果籽油感官和理化分析
2.6 罗汉果籽油脂肪酸组成定性和定量分析
罗汉果籽油脂肪酸组成定性和定量分析使用气相色谱-质谱联用仪进行定性分析,检出12种成分,总离子流图见图4。色谱峰相应的质谱图检索采用谱库进行检索,并逐个解析各峰相应的质谱图,其结果见表6。

图4 罗汉果籽油脂肪酸甲酯总离子流图
由图4可见,罗汉果籽油中主要含有9种不同的脂肪酸,经过谱库检索和各峰对应质谱图的解析,发现所分析罗汉果籽油所含各种脂肪酸组成成分如表6所示。
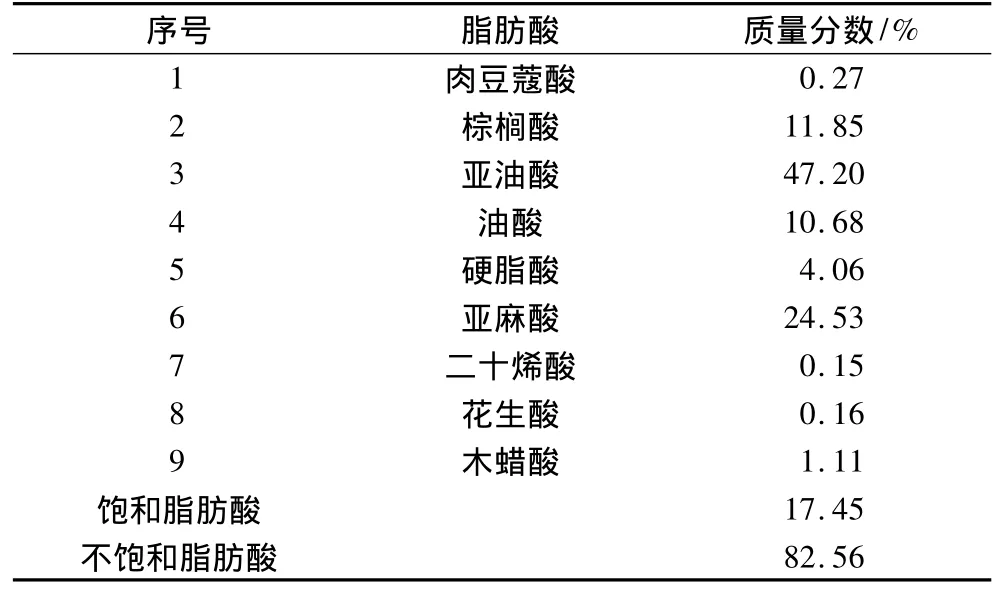
表6 罗汉果籽油脂肪酸组成
GC-MS结果显示罗汉果籽油中含有9种脂肪酸,其中不饱和脂肪酸占82.56%,多不饱和脂肪酸占总脂肪酸组成的 71.73%,主要成分是亚油酸(47.20%)和亚麻酸(24.53%)。
3 结论
3.1 萃取温度、萃取时间及料液比均对罗汉果籽油的得率有影响,其中料液比对罗汉果籽油的得率的影响最大达到了显著水平,其次是温度,萃取时间的影响最小。罗汉果籽油的最佳萃取工艺为:料液比为1∶6,萃取时间为6 h,水浴温度80℃,此时的萃取率为8.17%。
3.2 GC-MS结果显示罗汉果籽油中含有9种脂肪酸,其中不饱和脂肪酸占82.56%,多不饱和脂肪酸占总脂肪酸组成的71.73%,主要成分是亚油酸(47.20%)和亚麻酸(24.53%),是理想的食用油原料。
[1]Wurzburg O B.Modified starch properties and uses[J].Academic N.Y,1986,104 -107
[2]王雪芬,陈再智.罗汉果的药理及其应用研究[J].中药材,2003,26(10):771 -772
[3]张俐勤,戚向阳,陈维军,等.罗汉果皂苷提取物对糖尿病小鼠血糖、血脂及抗氧化作用的影响[J].中国药理学通报,2006,22(3):237 -240
[4]戚向阳,陈维军,张俐勤,等.罗汉果皂甙清除自由基及抗脂质过氧化作用的研究[J].中国农业科学,2006,39(2):382-388
[5]Xia Y,Rivero - Huguet M E.,Hughes BH.,et al.Isolation of the sweet components from Siraitia grosvenorii[J].Food Chemistry,2008,107(3):1022 -1028
[6]陈全斌,杨瑞云,义祥辉,等.RP-HPLC法测定罗汉果鲜果及甜甙中总黄酮含量[J].食品科学,2003,24(5):133-135
[7]陈全斌,程忠泉,杨建香,等.罗汉果种仁油中角鲨烯的高效液相色谱分析[J].广西科学,2006,13(2):118 -20
[8]程菊英,罗四莲,吕清华,等.广西植物油脂的研究——五十种植物种子的油脂成分[J].广西植物,1980(2):26.

