响应面优化小麦粉制备脂肪替代物的酶解工艺
钟昔阳 徐玉红 张淑芬 吴 欣 郑 志
(合肥工业大学生物与食品工程学院,合肥 230009)
近年来流行病学研究发现,高脂肪膳食被认为是肥胖症、高血脂、糖尿病等的诱因之一,特别是饮食中饱和脂肪酸过高,会引发胆囊炎以及乳腺癌、结肠癌等疾病[1-2]。营养学家一直提倡减少日常饮食中油脂的摄入量,但单纯减少食品中脂肪的含量会给产品风味及口感带来不良影响,从而影响消费者对产品的可接受性[3]。因此,开发生产一类既具有脂肪功能特效又能降低能量摄入的脂肪替代产品是当前食品工业的一个热点研究方向。
脂肪替代物是一类具有脂肪的部分或全部性质,在体内消化、分解所释放的能量比天然脂肪少或不被消化吸收,加入到低脂或无脂食品中,具有与同类全脂食品相同或相近的感官效果,但提供的总能量却明显降低的物质[4]。目前,脂肪替代物在人造黄油、冷冻食品和焙烤类食品中得到广泛应用[5-6],市场已经陆续推出了Simplesse、Olestra、MaltrinM040等多种商业化产品[7]。
利用各类淀粉制备脂肪替代物是当前脂肪替代物开发生产加工领域的一个研究热点[8],但在制备过程中需要先从各类农作物原料中分离出淀粉后才能加工,这使得加工过程变得繁琐、生产成本高,利用富含淀粉的农作物原料不经分离、直接加工制备脂肪替代物,其生产过程相对简洁、成本低,但目前还鲜见报道。本研究基于此,直接以小麦粉为原料,采用酶法水解制备脂肪替代物,研究其酶解工艺参数并对所得产品的性质进行初步评价。论文研究成果以期寻找一种简洁制备脂肪替代物的新方法,丰富我国脂肪替代物产品的开发生产。
1 材料与方法
1.1 材料与试剂
小麦粉(淀粉质量分数70.61%,蛋白质质量分数11.2%):安徽丰大股份有限公司。
耐高温α-淀粉酶(食品级,10 000 U/mL):无锡三茶化工有限公司;盐酸(AR):上海中试化工总公司;3,5-二硝基水杨酸(AR):上海展云化工有限公司;重蒸酚(AR):北京索莱宝科技有限公司;氢氧化钠(AR)、酒石酸钾钠(AR)、亚硫酸氢钠(AR):天津市博迪化工有限公司。
1.2 仪器与设备
BL-220H型电子天平:日本岛津公司;HH-2型数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;DHG-9070A型电热恒温鼓风干燥箱:上海雷韵试验仪器制造有限公司;UDK-152型自动凯氏定氮仪:意大利VELP公司;LG-04型高速粉碎机:瑞安市百信药机机械厂;722E型可见分光光度计:上海光谱仪器有限公司;TA-XT plus型物性检测仪:英国Stable Micro System公司;SC-3614型低速离心机:安徽中科中佳科学仪器有限公司;JSM-6490LV型电镜扫描仪:日本电子株式会社。
1.3 试验方法
1.3.1 小麦粉基脂肪替代物的工艺流程
称取小麦粉配制成一定浓度的料液→90℃水浴糊化→添加耐高温α-淀粉酶→加酸灭酶(1 mol/L盐酸调pH<2)→调pH(用1 mol/L氢氧化钠中和至pH 6.5左右)→55℃恒温鼓风干燥→粉碎过筛得产品。
1.3.2 DE(Dextrose Equivalent)值测定
DE值是指还原糖占干物质的量[9],当DE值越大时表明还原糖含量越高,所能提供的能量越多。

式中:m1为测定产物中还原糖的质量,m为称取干物质的质量。还原糖以葡萄糖含量计,以3,5-二硝基水杨酸法测定葡萄糖含量[10]。
1.3.3 持水性测定
参照文献[11]配制10%的溶液,在离心力4 000 r/min下离心20 min,记录析出水的质量计算持水性。

式中:m1为配制的样品溶液中水的总质量,m2为离心后离去水的质量,m为称取干脂肪替代物的质量。
1.3.4 凝胶强度的测定[12]
在70℃下配置质量分数(15%、20%、25%、30%、35%)的脂肪替代物溶液,并在4℃的冰箱中放置12 h以形成凝胶,采用TA-XT plus型物性检测仪测定凝胶强度。设置参数:探头直径0.5 mm,下压前速度2.0 mm/s,下压速度 1.0 mm/s,下压距离4 mm,下压后速度2.0 mm/s。凝胶强度定义为探头接触凝胶后下压到4 mm位置时单位面积上承受的破裂力。
1.3.5 脂肪替代物的扫描电子显微镜观察[13]
用导电双面胶将样品粉末固定在样品台上并涂抹均匀,用洗耳球吹去多余的样品,在真空离子溅射喷金后,放入扫描电子显微镜中进行观察,拍摄具有代表性的样品颗粒形貌。
1.4 数据处理
试验数据采用Excel 2003和Design-Expert 8.0软件分析处理。
2 结果与分析
2.1 影响小麦粉基脂肪替代物的单因素试验
2.1.1 底物浓度对DE值和持水性影响
配制5%、10%、15%、20%、25%、30%的小麦粉溶液,90℃、15 min水浴糊化,调溶液pH 6.5后加入2.5 U/g耐高温α-淀粉酶酶,酶解6 min,测定产物的DE值和持水性,试验结果如图1所示。
由图1可知:DE值随底物浓度的增加而降低,持水性先上升后下降,在底物质量分数为25%时持水性最大为213.83% ,DE值为4.13%。这可能是由于当底物浓度较低时,料液中水的含量大,淀粉能够充分吸水糊化,酶解时淀粉酶与底物接触的机率大、酶解较充分,产品的DE值较大;底物浓度增加时,淀粉充分糊化的程度减小,酶解程度降低,产品的DE值也随之降低[14-15]。利用淀粉酶解制备脂肪替代物一般要求DE值小于5,此时其流变学上才具有一定的凝胶强度,方可模拟脂肪的某些功能性质[16]。综合考虑,本试验选择25%为最佳的底物浓度。

图1 底物浓度对DE值和持水性影响
2.1.2 酶解时间对DE值和持水性影响
配制25%的小麦粉溶液,90℃、15 min水浴糊化,调溶液pH 6.5后添加2.5 U/g耐高温α-淀粉酶,酶解4、5、6、7、8、9 min,测定产物的 DE 值和持水性,试验结果如图2。
由图2可得出:DE值随酶解时间增加而增加,持水性先增加后下降,在酶解7 min时持水性最大为202.60%,DE值为4.77%。这可能是由于随着时间的增加,淀粉酶酶解淀粉的程度增大,DE值随之而增大。DE值增大时淀粉键断裂程度增大,空间网络结构增大、持水能力增加;但是随时间增加酶解程度越大,淀粉被水解为小分子,键断裂程度越大,与水结合能力减弱持水性则减小。故本试验选择7 min为最佳酶解时间。
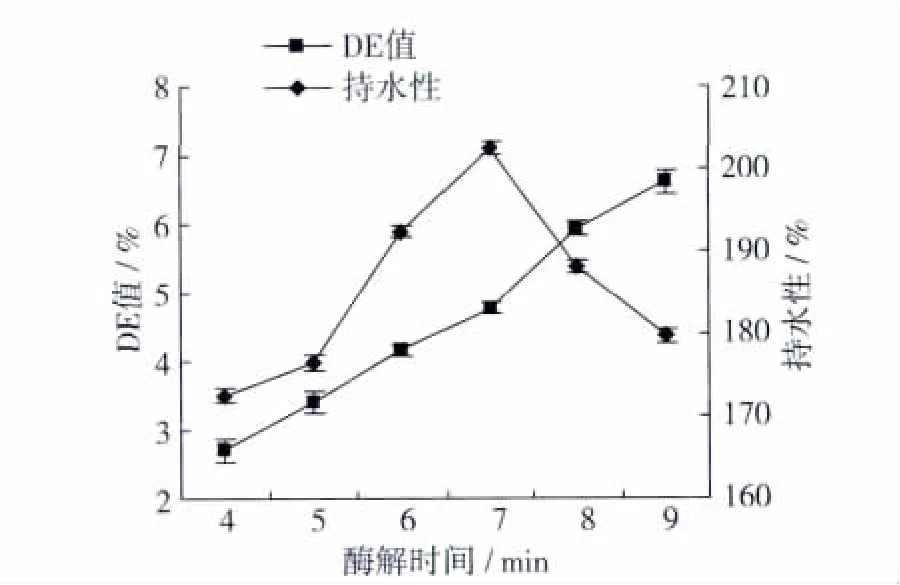
图2 酶解时间对DE值和持水性影响
2.1.3 酶添加量对DE值和持水性的影响
配制25%的小麦粉溶液,90℃、15 min水浴糊化,调溶液 pH 6.5 后添加 0.5、1.5、2.5、3.5、4.5、5.5 U/g耐高温α-淀粉酶,酶解7 min,测定产物的DE值和持水性,试验结果如图3。
由图3可得出:DE值随酶添加量增加而升高,持水性先增加后下降,在添加2.5 U/g的酶时持水性最大为190.59%,DE值为4.22%。这可能是由于随着淀粉酶量的增加,酶与底物接触的机率增大[17],酶解程度增大,DE值增加。随着酶解程度的增加,淀粉与水结合形成网络三维结构增大,吸水能力增强,持水性增大;当酶解程度达到一定程度时,键断裂程度大,空间网络结构吸水能力减弱,持水性减小。故本试验选择2.5 U/g为最佳的酶添加量。
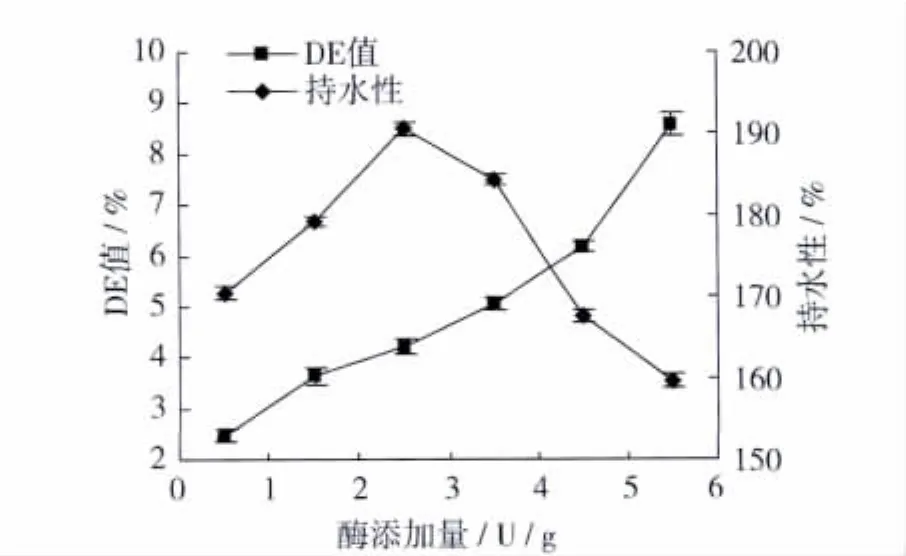
图3 酶添加量对DE值和持水性的影响
2.2 响应面试验设计酶水解工艺
2.2.1 响应面试验设计及试验结果分析
根据单因素试验中底物浓度(X1)、酶解时间(X2)、酶添加量(X3)3个因素选定因素水平,持水性在因素变化范围内具有中心点,更符合响应面试验设计[18-19],以持水性(Y)指标进行方程预测,同时测定DE值作为参考指标。因素水平见表1,响应面试验结果见表2。

表1 响应面试验因素与水平表
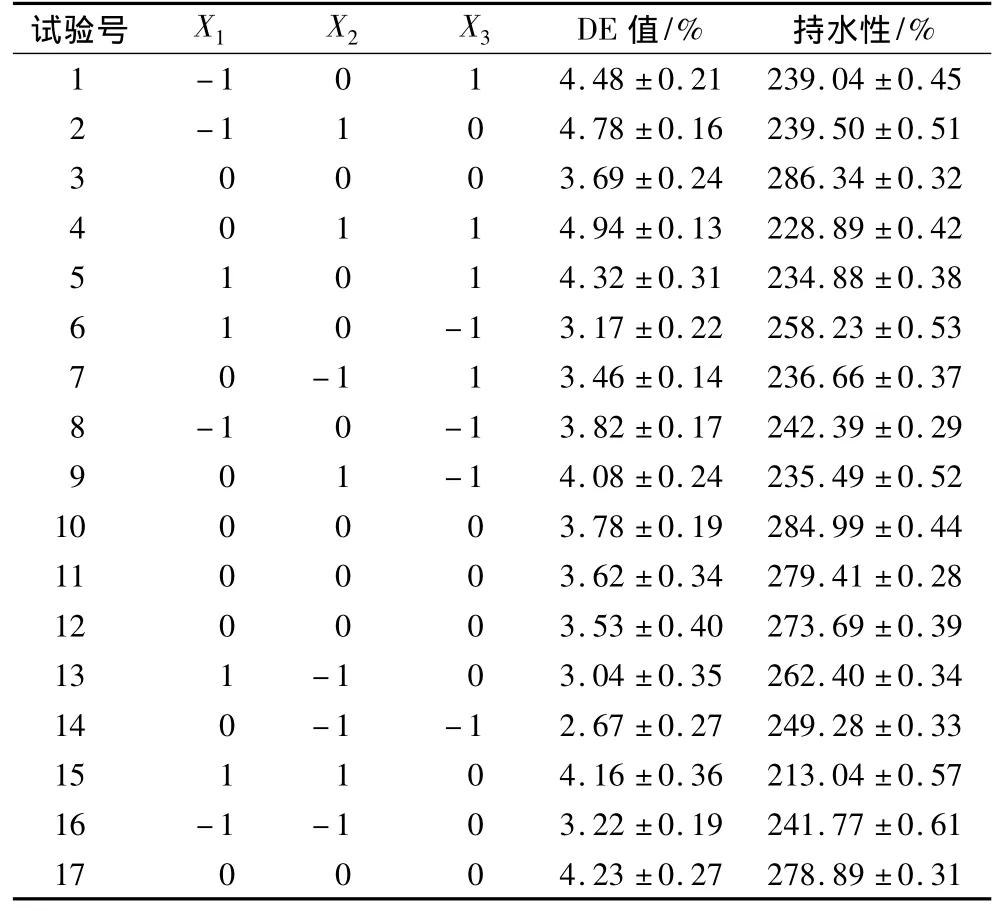
表2 响应面试验设计及结果
利用Design-Expert 8.0软件对表2试验数据进行二元回归拟合,得到产物的持水性(Y)对底物浓度(X1)、酶解时间(X2)、酶添加量(X3)的预测方程如下:

由表3方差分析结果可以看出,模型P=0.000 2<0.05,模型达到显著,失拟项 P=0.253 0 >0.05,不显著,因此二次模型成立。R2为0.966 1,大于0.9表明有不到4%的变量不能由模型解释。应用此模型可以分析预测酶法制备脂肪替代物的工艺条件,其中一次项X2、X3均显著,X1不显著,二次项 X1X2显著其他不显著,交互项均显著[20],所以得出影响产物持水性的主次因素为:酶解时间>酶添加量>底物浓度。
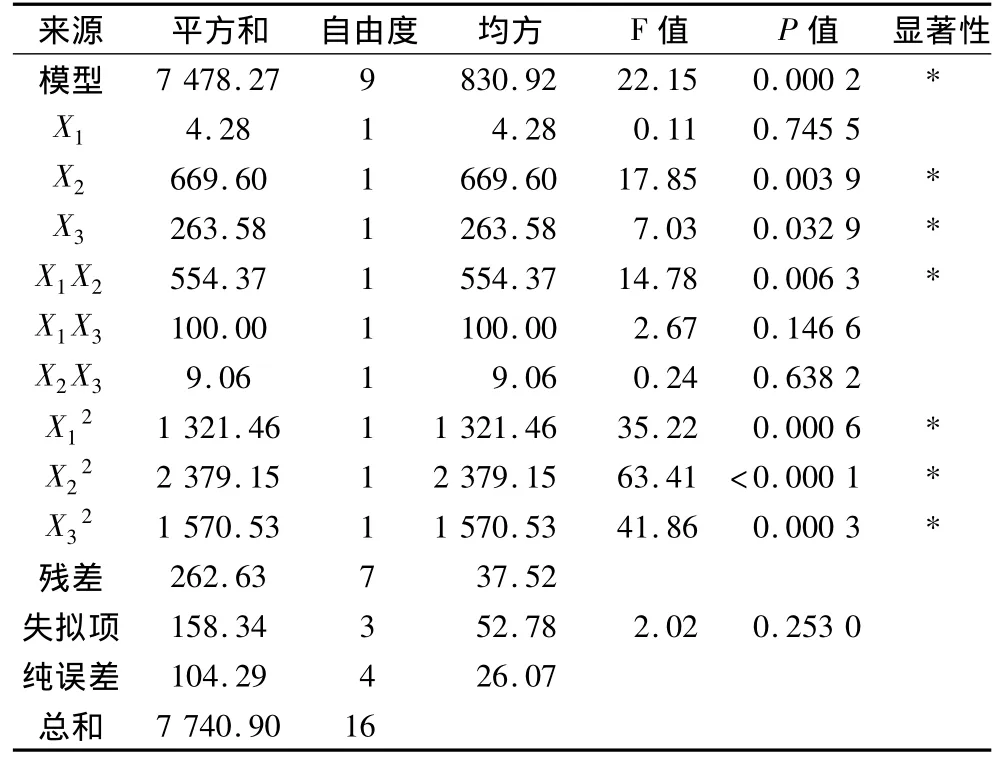
表3 响应值的二次模型方差分析
2.2.2 响应面和等高线分析
各因素影响持水性的曲面图和等高线如图4所示。
从等高线图可知:等高线均呈椭圆,表示底物浓度和酶解时间、底物浓度和酶添加量、酶解时间和酶添加量之间的交互作用明显[21-22],都对产物的持水性有影响。
由图4a可看出:固定酶添加量为2.5 U/g,随着加酶解时间和底物浓度的增大,持水性明显上升,之后随着底物浓度和酶解时间的增加,持水性有下降趋势,在交叉区域持水性存在一个极大值点[23-24],此时能够确定一组最佳的底物浓度和酶解时间;由图4b可看出:固定酶解时间为6 min时,随着底物浓度和酶添加量的增大,持水性明显上升,之后随着底物浓度和酶添加量的增加,持水性有下降趋势,在交叉区域持水性存在一个极大值点,此时能够确定一组最佳的底物浓度和酶解时间;由图4c可看出:固定底物质量分数为25%,随着酶解时间和酶添加量的增大,持水性明显上升,之后随着酶解时间和酶添加量的增加,持水性有下降趋势,在交叉区域持水性存在一个极大值点,此时能够确定一组最佳的酶解时间和酶添加量。
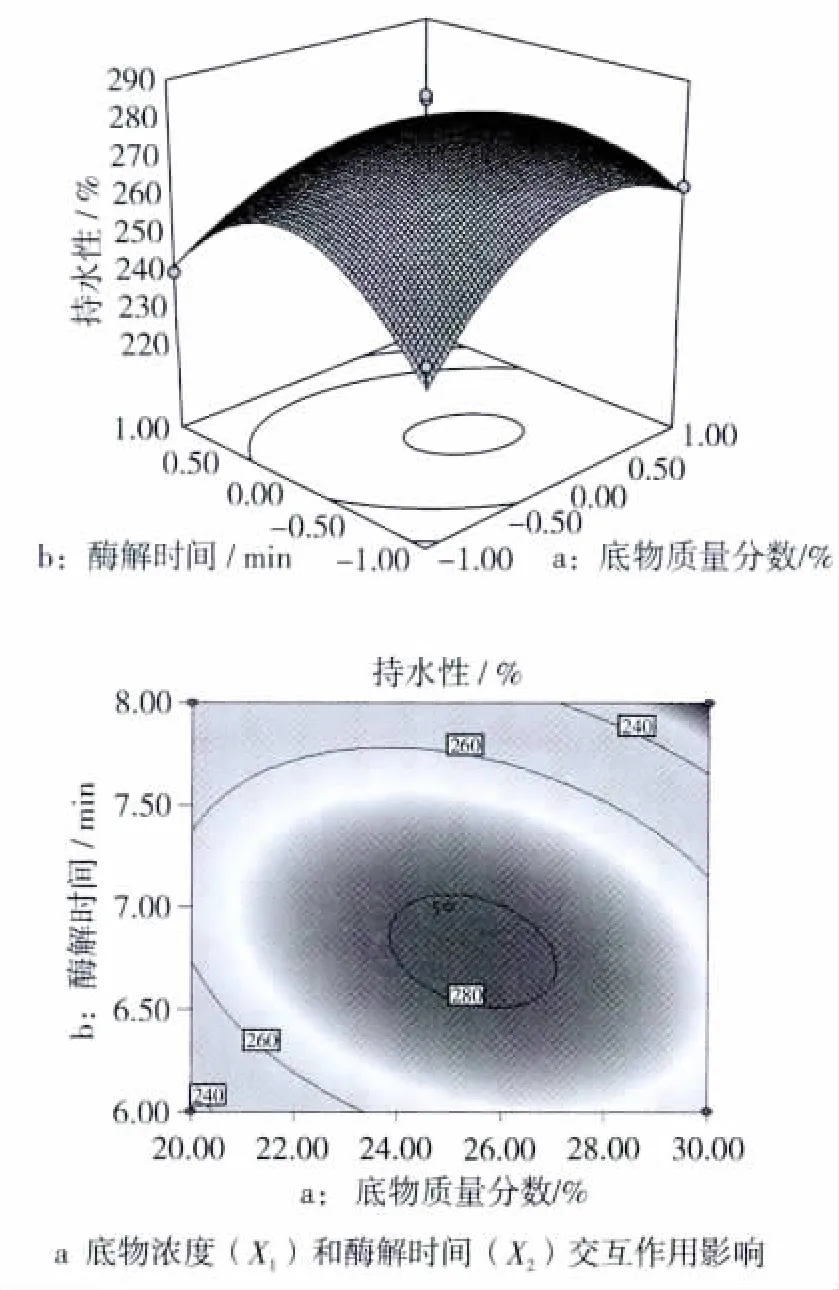
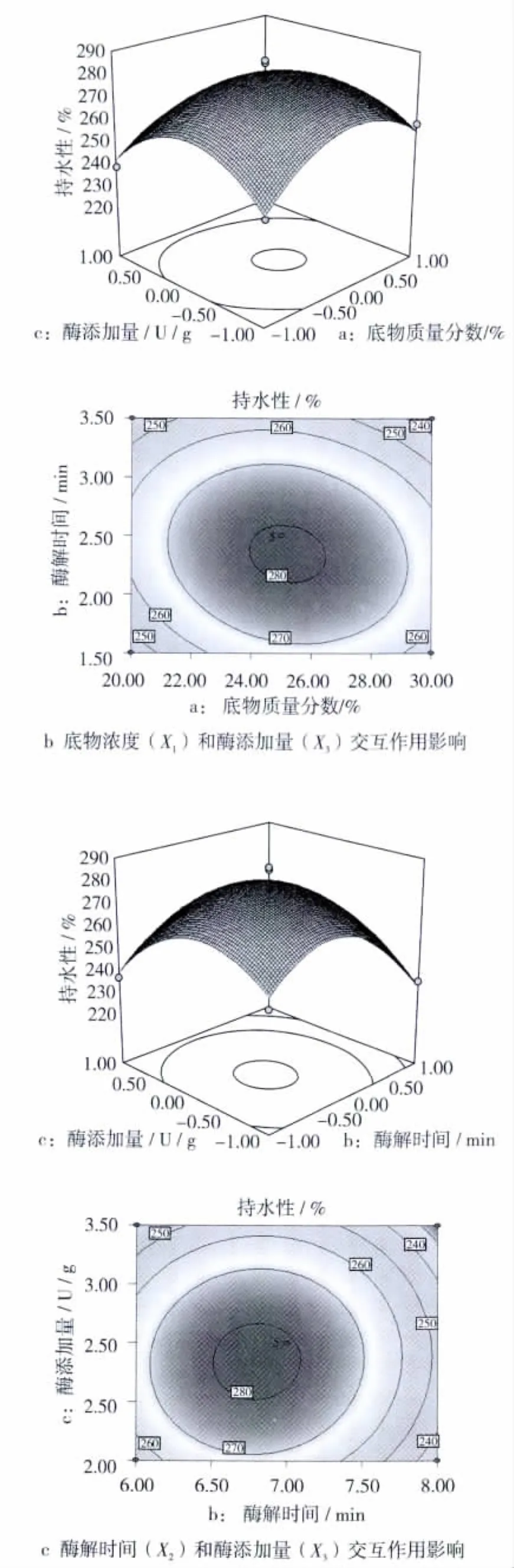
图4 各因素交互作用对持水性的响应面和等高线
2.2.3 优化最佳工艺条件
利用Design-Expert 8.0软件分析,结合二次回归方程预测最佳酶解工艺参数,分析出最佳参数为:底物浓度25.60%,酶添加量 2.33 U/g,酶解时间6.77 min,此时持水性的预测值能达到282.25%,经验证测定该条件下测得持水性为273.69%,与预测值基本一致,说明该方程与实际情况相符合,拟合程度较好。
2.3 脂肪替代物的凝胶强度
淀粉被水解程度的增加导致体系所形成的凝胶之间的网状结构的交联程度不断减弱,所能形成的凝胶强度就将越小[25]。作为一种品质优异的脂肪替代物,需要有较好的凝胶强度,方可模拟脂肪润滑的口感。选择上述最优条件下所得脂肪替代物,在70℃下配制不同质量分数(15%、20%、25%、30%、35%)的溶液测定其凝胶强度,具体结果如表4所示。

表4 70℃时不同浓度溶液的凝胶强度
由图表4可知,在70℃时15%溶液的凝胶强度最低,形成凝胶的能力最弱,随着浓度的增加凝胶强度逐渐增加。这可能是由于随着浓度增加,淀粉与水在形成凝胶时溶液中多余的水分呈流动形态,水的含量越多流动越明显,形成凝胶的能力较弱,水分减少时能充分吸收水分并保持凝胶状态,凝胶强度增加[26-27]。但浓度越大能够自由流动的水减少,反而影响替代脂肪的口感。
2.4 脂肪替代物的扫描电镜分析
在上述最优制备条件下得到的脂肪替代物是一种浅白色的黏稠糊状物质,具有小麦粉的天然香味和较好的润滑口感。对其进一步干燥粉碎,所得的产物为颗粒细腻的白色粉末状物质。为探明所得脂肪替代物的微观结构特征,比较酶解前后结构性质的变化,对原料小麦粉和最优条件下脂肪替代物进行扫描电镜观察,所得结果如图5所示。
由图5可看出:小麦粉中颗粒多以圆形的形态存在,颗粒表面光滑、大小不一,蛋白质嵌在淀粉的内部和表面[28],而在相同放大倍数的条件下经过酶解处理的小麦粉制得的脂肪替代物颗粒形态与原面粉发生了很大的变化,颗粒表面明显的受到倾蚀,外形不再光滑规则,而是变得粗糙,颗粒尺寸减小。这可能是由于在淀粉酶的作用下,淀粉被酶解成小分子,直链淀粉断裂,面粉颗粒的表面呈现被侵蚀的现象,变得不再平滑。

图5 小麦粉和脂肪替代物扫描电镜图
3 结论
3.1 通过响应面优化试验,酶解小麦粉制备脂肪替代物的持水性与各因素间关系的预测方程为:

由各因素的显著性分析得出影响产物持水性的因素依次为:酶解时间>酶添加量>底物浓度。
3.2 由模型和曲面图分析优化得到最佳工艺参数:底物质量分数25.60%,酶添加量 2.33 U/g,酶解时间6.77 min,此时持水性的预测值能达到282.247%,经验证测定该条件下测得持水性为273.69%,表明模型建立合理,预测的结果较为准确。
3.3 最优工艺条件下脂肪替代物的凝胶强度、电子显微镜扫描表明,小麦淀粉分子结构在酶解过程破坏中遭到破坏。
[1]Lundman P,Boquist S,Samanegard A,et al.A high - fat meal is accompanied by increased plasmainterleukin-6 concentrations[J].Nutrition,Metabolism and Cardiovascular Diseases,2007,17(3):195 -202
[2]Howard B V.Dietary fat and cardiovascular disease:putting the women's health Initiative in perspective[J].Nutrition,Metabolism and Cardiovascular Diseases,2007,17(3):171 -174
[3]姚怀芝,姚惠源.脂肪替代品的现状及展望[J].广州食品工业科技,2003,19(2):73 -74
[4]Miller G D,Groziak S M.Impact of fat substitutes on fat intake[J].Lipids,1996,31(1):293 -296
[5]贾士杰.脂肪替代物的应用概述[J].中国乳业,2006(7):53-55
[6]宫艳艳.脂肪替代物的分类及在食品中的应用[J].中国食品添加剂,2009(2):67-71
[7]杨铭铎,于亚莉,高峰.食品生产中脂肪代用品的研究进展[J].食品科学,2002,23(8):310 -314
[8]杨玉玲,许时婴.淀粉为基质的脂肪替代品[J].食品工业科技,2002,23(12):85 -87
[9]Ljubica D,Jovan J,Peter D.Relation between viscous characteristics and dextrose equivalent of maltodextrins[J].Starch,2004,56(11):520 -525
[10]赵凯,徐鹏举,谷广烨.3.5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536
[11]于明晓,郭顺堂.挤压组织对脱脂花生蛋白粉的持水性和持油性的影响[J].食品工业科技,2007,28(1):87 -90
[12]陈龙.芋头淀粉脂肪模拟品的制备及应用的研究[D].重庆:西南大学,2011
[13]Mcbonough C M,Anderson B J,Ronney L W.Structural characteristics of steam -flaked sorghum[J].Cereal Chemistry,1997,74(5):542 -547
[14]张斌,罗发兴,罗志刚.马铃薯淀粉基脂肪模拟物的工艺研究[J].现代食品科技,2009,25(6):629 -632
[15]刘辉琴.淀粉基脂肪替代用品的制备及应用研究[D].河南:河南工业大学,2009
[16]徐毅华,曲静然.淀粉基脂肪替代物的研究应用概况[J].粮食加工,2011,36(3):46 -48
[17]刘怀伟,孔保华,武晗,等.马铃薯淀粉基质脂肪模拟物制备工艺的研究[J].食品与发酵工业,2006,32(11):50-54
[18]Ferreiraa SL C,Brunsb R E,Ferreiraa H S,et al.Box - Behnken design:an alternative for the optimization of analytical methods[J].Analytical Chemical Acta,2007,597(2):179 -186
[19]杨文雄,高彦祥.响应面法及其在食品工业中的应用[J].中国食品添加剂,2005(2):68 -71
[20]欧阳辉,余佶,陈小原,等.响应面分析法优化湘西月见草籽油的超临界萃取工艺研究[J].食品科学 2010,31(2):42-45
[21]张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J].食品科学,2010,31(16):33 -37
[22]陈海华,鲁军.响应曲面法优化狭鳕鱼皮明胶的微波辅助提取工艺[J].食品与发酵工业,2009,35(8):168-174
[23]张艳荣,丰艳,孙丽琴,等.响应面法优化米糠挤出工艺及其物性研究[J].食品科学,2010,31(20):146-151
[24]Liang Renjie.Optimization of extraction process of Glycyrrhiza glabra polysaccharides by response surface methodology[J].Carbohydrate Polymers,2008,74(4):858 - 861
[25]酆渊.酶解大米制备脂肪替代品及其在烘焙领域中的应用[D].无锡:江南大学,2009
[26]杨玉玲,许时婴,王璋.籼米为基质的脂肪替代品的凝胶性质[J].中国粮油学报,2003,18(5):8-11
[27]郝新蕾,张连富.低DE值麦芽糊精凝胶特性研究[J].中国粮油学报,2010,25(3):29 -33
[28]朱帆,徐广文,姚历,等.小麦淀粉颗粒的微观结构研究[J].食品科学,2010,29(5):93 -96.

