阿司匹林与氯吡格雷对小鼠血小板P-选择素抑制作用的比较☆
林志坚郭淮莲孙凯韩晶岩
阿司匹林和氯吡格雷是临床上最常用的抗血小板药物,已经被写入各国缺血性脑卒中的防治指南[1,2]。阿司匹林与氯吡格雷抗血小板作用的比较多见于临床试验中[3],观察指标多为新发缺血事件的发生率。目前国内外尚未见基于血小板功能实验室指标的比较这两种药物药效的报道。血小板膜表达P-选择素是血小板活化的重要标志,本研究拟利用流式细胞技术测定血小板膜P-选择素阳性率的方法,比较阿司匹林和氯吡格雷对小鼠血小板活化的抑制作用。
1 材料与方法
1.1 研究对象 雄性昆明小鼠(8周龄,体质量35~40g),清洁级,40只,由北京大学医学部实验动物科学部提供,随机分为4组:对照组,阿司匹林组、氯吡格雷组、阿司匹林+氯吡格雷组,每组10只。其中对照组血标本又分为阴性对照组和胶原活化组。
1.2 实验方法
1.2.1 灌胃 将阿司匹林、氯吡格雷、阿司匹林+氯吡格雷分别溶解于0.5%羧甲基纤维素钠(Carboxymethylcellulose sodium,CMC-Na)溶液配制成相应的混悬液。对照组小鼠给予0.5%CMC-Na溶液(0.01 mL/g)灌胃;阿司匹林组小鼠给予阿司匹林混悬液15 mg/kg灌胃[按人与动物用药剂量换算公式[4]:小鼠剂量(mg/kg)=9.01×成人阿司匹林剂量(100 mg)/成人体重(60 kg)计算得出];氯吡格雷组小鼠给予氯吡格雷混悬液11.26 mg/kg灌胃[计算方法同上:小鼠剂量(mg/kg)=9.01×成人氯吡格雷剂量(75 mg)/成人体重(60 kg)];阿司匹林+氯吡格雷组小鼠给予阿司匹林+氯吡格雷混悬液(15 mg/kg,11.26 mg/kg)灌胃。灌胃每日1次,共7d。
1.2.2 采血 第7d灌胃后1h采用眼球摘除法取全血于3.8%枸橼酸钠抗凝EP管中。
1.2.3 胶原激活 取对照组小鼠全血10μL加入生理盐水10μL(分别取2管),混匀,37℃孵育15 min作为阴性对照组;另取对照组小鼠全血10μL加入100μg/mL胶原10μL(美国Sigma公司产品)(分别取2管),混匀,37℃孵育15min作为胶原活化组。其余各组取全血10μL分别加入100μg/mL胶原10μL(分别取2管),混匀,37℃孵育15min。
1.2.4 流式细胞检测 在上述经过处理的标本中,对照管加入异硫氰酸荧光素标记仓鼠抗小鼠CD61单克隆抗体(CD61-FITC)1 μL,试验管加入抗小鼠CD61-FITC 1 μL、藻红蛋白标记小鼠抗小鼠CD62P单克隆抗体(CD62P-PE)2μL(按照说明书操作)。混匀室温避光孵育20 min,然后再加入1 mL冷的磷酸缓冲液(PBS)。采用流式细胞仪(美国BD FACSCalibur公司)检测,以CD61-FITC和侧散射光散点图设血小板门,测定血小板膜CD62P(P-选择素)表达阳性百分率。
1.3 统计学处理 采用SPSS 17.0进行统计学分析,数据以(±s)表示,多个样本均数比较采用单因素方差分析(one way ANOVA),组间均数比较采用LSD-t检验,检测水准α=0.05。
2 结果
阴性对照组、胶原活化组、阿司匹林组、氯吡格雷组、阿司匹林+氯吡格雷组血小板膜P-选择素阳性率见表1。
表1 各组血小板膜P-选择素阳性率比较(±s,%)
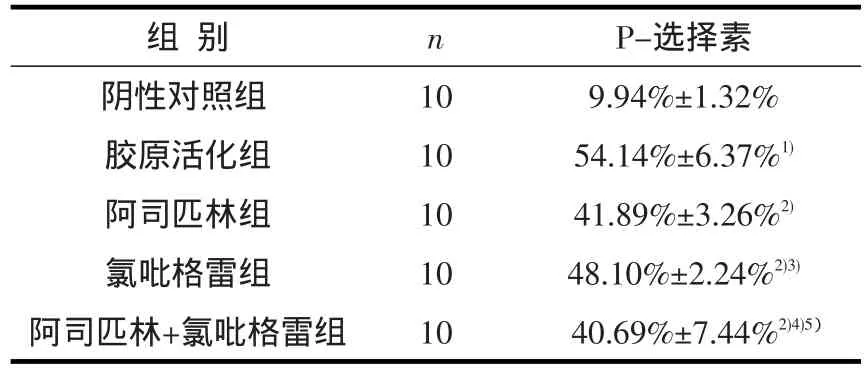
表1 各组血小板膜P-选择素阳性率比较(±s,%)
1):与对照组比较P<0.05;2):与胶原活化组比较P<0.05;3):与阿司匹林组比较P<0.05;4):与氯吡格雷组比较P<0.05;5):与阿司匹林组比较P>0.05
组别阴性对照组胶原活化组阿司匹林组氯吡格雷组阿司匹林+氯吡格雷组n 10 10 10 10 10 P-选择素9.94%±1.32%54.14%±6.37%1)41.89%±3.26%2)48.10%±2.24%2)3)40.69%±7.44%2)4)5)
3 讨论
抗血小板药物在非心源性缺血性脑卒中和TIA的预防和治疗中起重要作用,阿司匹林和氯吡格雷是临床上应用最广泛的抗血小板药物,这两种药物疗效的直接比较见于多个临床试验中,如CAPRIE试验[3],研究发现氯吡格雷与阿司匹林相比可显著减少新发缺血事件(联合终点包括非致死性心梗、缺血性卒中或血管死亡)的发生率;MATCH试验[5]发现,近期发生短暂性脑缺血发作或缺血性脑卒中患者联合使用氯吡格雷和阿司匹林与服用氯吡格雷和安慰剂相比,前者并未减少主要终点事件(心肌梗死、缺血性卒中、血管性死亡事件及因急性缺血事件再住院)的发生,而3个月后明显增加了出血的风险。目前国内外尚未见到基于血小板功能实验室指标的比较这两种药物药效的报道。
临床上药物的作用可能受患者年龄、病情、合并症、依从性、合并用药等因素的干扰,动物实验可避免上述因素的干扰。传统用于评价抗血小板药效的血小板聚集率检测重复性欠佳,标本准备过程繁琐、费时[6]。P-选择素主要存在于血小板α颗粒内,血小板活化后,α颗粒与血小板质膜融合,P-选择素表达在血小板表面[7],P-选择素与其配体结合后起信号转导作用,活化靶细胞或改变其功能状态,从而介导白细胞-内皮细胞、白细胞-血小板间反应,最终导致组织损伤[8]。血小板膜P-选择素表达是血小板活化的重要标志,采用荧光抗体标志P-选择素,利用流式细胞技术可比较准确的检测血小板膜P-选择素阳性率。因此,本研究采用流式细胞技术检测血小板膜P-选择素阳性率,进而比较抗血小板药物的作用。
国内外多个有关抗血小板药物的研究[9,10]均采用服药7d后取血测血小板功能。研究表明[11],阿司匹林口服经胃肠道完全吸收后迅速降解为水杨酸,反复用药后水杨酸盐的半衰期可维持5-18h,其对血小板的抑制在1~4 d达到稳态。氯吡格雷75mg每日一次重复给药,从第1 d开始明显抑制ADP诱导的血小板聚集,抑制作用逐步增强并在3~7 d达到稳态。因此,本研究选择在给药7 d后采血。
本研究发现,加入胶原后,血小板膜P-选择素阳性率明显升高,提示胶原可刺激血小板活化。胶原是启动血小板粘附、聚集过程强有力的血管壁成份。血小板有2个受体在血小板-胶原相互作用起重要作用,即糖蛋白Ⅵ(GPⅥ)和整合素α 2β1。血小板特异性GPⅥ(62 kDa)是免疫球蛋白超家族的一个成员,其与胶原的亲和力低,不能单独介导稳定的血小板粘附,但对血小板稳定的粘附到胶原上起关键作用,因为它通过结合的FcRγ链诱导强大的信号途径;整合素α2β1经过活化后由低亲和力构象转化为高亲和力构象,胶原结合到整合素α2β1促进血小板活化和紧密粘附途径的下游步骤的进行。
阿司匹林通过不可逆的抑制环氧化酶-1(cyclooxygenase-1,COX-1),使花生四烯酸不能合成前列腺素,血栓素A2(thromboxane A2,TxA2)合成受阻,从而抑制血小板的聚集;氯吡格雷是一种噻吩吡啶类化合物,选择性抑制二磷酸腺苷(adenosine diphosphate,ADP)与血小板膜ADP受体结合及继发的ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化,从而抑制血小板聚集。氯吡格雷还能阻断其它激动剂通过释放ADP引起的血小板聚集。许多研究[12]采用ADP激活血小板释放P-选择素,而本研究选择的胶原引起的P-选择素的表达不是阿司匹林、氯吡格雷直接药理作用的靶点,因此可以客观的比较阿司匹林、氯吡格雷对血小板活化的抑制作用。
本研究发现:①阿司匹林、氯吡格雷及阿司匹林+氯吡格雷可以抑制胶原引起的血小板膜P-选择素的表达,提示上述药物均可以抑制胶原引起的血小板活化。②阿司匹林对胶原引起的血小板活化的抑制作用较氯吡格雷强。提示阿司匹林对血小板活化的抑制作用可能优于氯吡格雷,这与某些临床试验结果存在差异[3],可能的原因是本研究以胶原诱导的血小板膜P-选择素表达为观察指标,而临床试验随访新的缺血事件的发生;其次,临床试验中有各种临床因素的影响;另外,本研究观察时间短、为一周,而临床试验随访时间长,多在半年或1年以上[3,13]。③阿司匹林+氯吡格雷对胶原诱导的血小板活化的抑制作用与单用阿司匹林相当。这一点与临床试验结果一致。临床研究提示联合使用阿司匹林+氯吡格雷比单独使用阿司匹林没有显著获益,而双联抗血小板治疗出血的风险高于单独使用阿司匹林或氯吡格雷[14]。
本研究的不足之处在于仅测定P-选择素,而未检测血小板膜糖蛋白GPⅡb/Ⅲa纤维蛋白原受体。静息血小板表面的GPⅡb/Ⅲa不能结合纤维蛋白原,当血小板活化后,隐蔽状态的GPⅡb/Ⅲa表达于血小板表面,同时使GPⅡb/Ⅲa的结构和空间构象及周围微环境的改变,使纤维蛋白原受体结合部位暴露,获得受体活性,并与之结合,引起血小板聚集。GPⅡb/Ⅲa与纤维蛋白原的结合是血小板聚集的最后通路[15]。GPⅡb/Ⅲa与纤维蛋白原结合,引起血小板聚集,促进血栓形成,在脑缺血缺氧性损伤起重要的作用。有研究表明【16】,GPⅡb/Ⅲa纤维蛋白原受体与急性脑梗死患者病情严重程度呈正相关。今后的研究将完善这个指标的检测。
综上所述,胶原可诱导小鼠血小板膜P-选择素阳性率升高;阿司匹林、氯吡格雷及阿司匹林+氯吡格雷能抑制胶原诱导的血小板活化,在预防和治疗非心源性缺血性脑卒中和TIA起重要作用;阿司匹林对胶原诱导的小鼠血小板活化的抑制作用较氯吡格雷强;阿司匹林+氯吡格雷对胶原引起的小鼠血小板活化的抑制作用与单用阿司匹林相当。阿司匹林和氯吡格雷对血小板活化抑制作用的比较仍需扩大样本量进一步研究。
[1]中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组.中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010[J].中华神经科杂志2010,43(2):154-160.
[2]Furie KL,Kasner SE,Adams RJ,et al.Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack:a guideline for healthcare professionals from the american heart association/american stroke association[J].Stroke,2011,42(1):227-276.
[3]CAPRIE Steering Committee.A randomised,blinded,trial of clopidogrel versus aspirin in patients at risk of ischaemic events(CAPRIE)[J].Lancet,1996,348(9038):1329-1339.
[4]赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010,22(5):52-53.
[5]Diener HC,Bogousslavsky J,Brass LM,et al.Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients(MATCH):randomised,double-blind,placebo-controlled trial[J].Lancet,2004,364(9431):331-337.
[6]Harrison P.Assessment of platelet function in the laboratory[J].Hamostaseologie,2009,29(1):25-31.
[7]Yamazaki M,Uchiyama S,Iwata M.Measurement of platelet fibrinogen binding and p-selectin expression by flow cytometry in patients with cerebral infarction[J].Thromb Res,2001,104(3):197-205.
[8]Htun P,Fateh-Moghadam S,Tomandl B,et al.Course of platelet activation and platelet-leukocyte interaction in cerebrovascular ischemia[J].Stroke,2006,37(9):2283-2287.
[9]金英玉,辛晓敏,张云平,等.反复脑梗死患者服阿司匹林后血小板聚集功能的变化[J].中国实验诊断学,2006,10(3):269-270.
[10]Berrouschot J,Schwetlick B,von Twickel G,et al.Aspirin resistance in secondary stroke preverntion[J].Acta Neurol Scand 2006,113(1):31-35.
[11]郎森阳.抗血小板药物[M]//匡培根.神经系统疾病药物治疗学.北京:人民卫生出版社,2002:137-140.
[12]Eriksson AC,Jonasson L,Lindahl TL,et al.Static platelet adhesion,flow cytometry and serum TXB2 levels for monitoring platelet inhibiting treatment with ASA and clopidogrel in coronary artery disease:a randomised cross-over study[J].J Transl Med,2009,7:42.
[13]Hankey GJ,Hacke W,Easton JD,et al.Effect of clopidogrel on the rate and functional severity of stroke among high vascular risk patients:a prespecified substudy of the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization,Management and Avoidance(CHARISMA)trial[J].Stroke,2010,41(8):1679-1683.
[14]Ruland S.Safety of clopidogrel and aspirin for stroke prevention:implications of the CHARISMA trial[J].Drug Saf,2008,31(6):449-458.
[15]Schneider DJ.Anti-platelet therapy:glycoprotein IIb-IIIa antagonists[J].Br J Clin Pharmacol,2011,72(4):672-682.
[16]张炘,段传志,李铁林,等.血小板活化特异性标志物PAC-1和CD62p与急性脑梗死病情严重程度的相关性[J].中国神经精神疾病杂志,2011,37(11):698-701.

