缺陷型和非缺陷型精神分裂症患者早期认知视觉图形记忆功能☆
丁蕾 邓伟 王强 马小红 李名立 韩媛媛 刘祥 李涛
精神分裂症是一种异质性、多因素致病的疾病。1988年,Carpenter等[1]提出了“缺陷型精神分裂症”的概念,定义一类具有原发且持续的阴性症状,非继发于其他因素(如:抗精神病药、抑郁症状、思维障碍、幻觉或妄想)相对同质的精神分裂症亚型。缺陷型/非缺陷型精神分裂症在发病因素、临床表现、病程、治疗反应及预后的差异[2]提示:缺陷型患者可能具有独特的脑损伤机制,可表现特征性的认知功能缺损。但目前报道仅限于两型患者认知缺损程度轻重的差异[3],其研究对象均为病程迁延的慢性患者。本研究纳入新起病的首发精神分裂症患者,选择存在即刻与延迟双时相多指标的视觉图形记忆进行认知测试,试图找到缺陷型患者特征性的早期认知缺损特点,为此类精神分裂症的病因学研究提供指导方向。
1 对象和方法
1.1 研究对象 来自2003年1月至2006年12月于四川大学华西医院心理卫生中心住院或门诊的患者。纳入标准:①符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-IV)精神分裂症诊断标准;②16~45岁;③右利手,汉族,小学毕业或以上文化程度;④首次发病,从未用过任何抗精神病药、抗抑郁药、苯二氮䓬类或其他影响中枢神经系统药物。排除标准:①患神经系统及严重内分泌或代谢性疾病;②伴其他DSM-IV轴I或II疾病;③对检查不合作或不能有效完成测验;④色盲或色弱。共纳入199例精神分裂症患者。使用缺陷型精神分裂症诊断量表中文版(Schedule for the Deficit Syndrome,SDS)[4]进行缺陷型/非缺陷型的诊断分型,该量表已被证明具有良好的信度和效度[5]。因采用SDS诊断缺陷型需阴性症状至少持续1年以上,为保证分型准确,采用多时间点(半年和1年后)SDS随访策略进行复核。199例患者被分为缺陷型组51例和非缺陷型组148例,两组年龄、性别等人口学资料分布,及阳性与阴性症状量表(Positive and Negative Symptom Scale,PANSS)得分见表1。
表1 三组人口学资料及患者PANSS得分(±s)
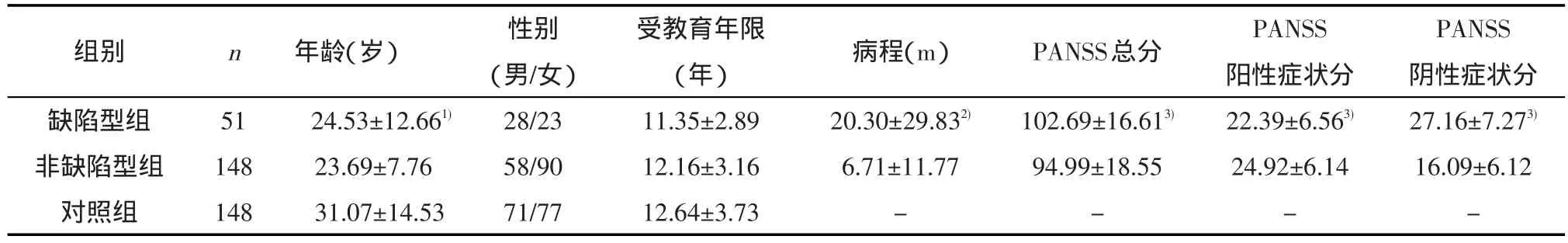
表1 三组人口学资料及患者PANSS得分(±s)
1)与非缺陷型组和对照组比较,经方差分析,P<0.05;2)与非缺陷型组比较,经Wilcoxon秩和检验,P<0.05;3)与非缺陷型组比较,经独立样本t检验,P<0.05
受教育年限(年)11.35±2.89 12.16±3.16 12.64±3.73组别缺陷型组非缺陷型组对照组n 51 148 148年龄(岁)24.53±12.661)23.69±7.76 31.07±14.53性别(男/女)28/23 58/90 71/77病程(m)20.30±29.832)6.71±11.77-PANSS总分102.69±16.613)94.99±18.55-PANSS阳性症状分22.39±6.563)24.92±6.14-PANSS阴性症状分27.16±7.273)16.09±6.12-
正常对照组为社区及广告募集的志愿者。纳入标准:①16~45岁;②右利手、汉族、小学毕业以上文化,成都市五城区生活3年以上的健康公民;③从未患任何精神疾病;④精神疾病家族史阴性。排除标准:①患神经系统及严重内分泌或代谢性疾病;②对检查不合作或不能有效完成测验;③色盲或色弱。共纳入148名对照,年龄、性别等人口学资料分布见表1。
三组年龄(F=15.15,P<0.01)差异有统计学意义,性别分布和受教育年限差异无统计学意义(P>0.05)。缺陷型组较非缺陷型组病程更长(Z=-3.31,P<0.01)。缺陷型组 PANSS总分(t=2.66,P=0.01)和阴性症状分(t=10.58,P<0.01)均高于非缺陷型组,而阳性症状分(t=-2.49,P=0.01)低于非缺陷型组。
本项目得到四川大学华西医院伦理委员会批准实施。由患者及志愿者本人或监护人签署知情同意书。
1.2 研究方法 收集受试者访谈时的年龄、性别、受教育年限等一般人口学信息,患者组收集病程信息。入院3d内由有经验的精神科医师对患者进行PANSS评定。
使用剑桥神经认知测试自动化软件(the Cambridge Neuropsychological Test Automated Battery,CANTAB)中视觉图形记忆(Pattern Recognition Memory,PRM)测试项对所有受试者的记忆功能测评。受试者被要求记下依次显示的12幅抽象、不同颜色且难以用言语描述的图形。每幅图形显示3s,识别完毕后要求受试者在12对图形中(每对包括一幅刚显示过的及一幅相似的错误干扰图形)判断出哪幅是刚看到过。完成后,另外依次显示12幅图形,20min后进行判断。两次识别过程分别称为“即刻记忆模式”与“延迟记忆模式”。测试指标:①平均正确反应时长,即受试者在即刻/延迟记忆模式中从出现图形到正确点击图形所需反应时间的平均值,以ms计量,代表认知功能效率;②记忆正确率,即受试者在即刻/延迟记忆模式中正确点击图形数与测试图形总数(12个)的百分比值,代表认知功能准确性。
1.3 统计学方法 采用混合效应模型,控制年龄、性别、受教育年限,比较三组间PRM相关指标的差异,不符合正态分布数据采用秩次转换后比较。为更直观比较,计算经性别、年龄、受教育年限校正后PRM相关指标的残差,并根据对照组残差的均值和标准差,对三组的残差进行Z-score标准化,得到各组校正后的PRM相关指标Z-score标准化值。以上统计分析过程在SAS 8.2中完成。控制年龄、性别、受教育年限,分别对两组亚型患者组的PRM相关指标与临床症状严重程度(PANSS量表分)进行偏相关分析。以上过程在SPSS 17.0中完成。检验水准α为0.05,双侧检验。
2 结果
2.1 两患者组与对照组PRM相关指标比较 即刻记忆模式:控制年龄等因素后与对照组相比,缺陷型组反应时长更长(Z=-3.02,P<0.01),非缺陷型组与对照组无差异(Z=-1.92,P=0.05);缺陷型组(t=2.10,P=0.04)与非缺陷型组(t=2.84,P=0.01)的正确率均降低。患者两组之间反应时长(Z=-0.233,P=0.82)与正确率(t=0.05,P=0.96)无统计学差异。见表2和图1。
延迟记忆模式:控制年龄等因素后与对照组相比,缺陷型组与非缺陷型组均表现反应时长更长(Z=-4.555,P<0.01;Z=-2.10,P=0.04),正确率更低(t=6.08,P<0.01;t=5.49,P<0.01)。两患者组间也存在统计学差异:缺陷型组比非缺陷型组反应时长更长(Z=-3.02,P<0.01),正确率更低(t=6.08,P<0.01)。见表2和图1。
2.2 两患者组PRM相关指标与症状严重程度的相关分析 缺陷型组中,校正年龄等因素后,仅即刻记忆模式反应时长与PANSS阳性症状分正相关(r=0.53,P=0.01);余PRM指标与临床症状严重程度均无统计学相关性(均P>0.05)。非缺陷型组中,校正后的即刻记忆模式反应时长与PANSS总分(r=0.37,P=0.01)和阴性症状分(r=0.33,P<0.01)正相关;延迟记忆模式正确率与PANSS总分(r=-0.44,P<0.01)、阴性症状分(r=-0.32,P<0.01)及阳性症状分(r=-0.34,P<0.01)均呈负相关。见表3。
3 讨论
精神分裂症患者在记忆、执行功能、注意等维度存在广泛的神经认知功能缺损[6]。这些缺损既见于慢性患者,也见于首发患者。既往缺陷型认知功能的研究仅选择了慢性患者,认为其与非缺陷型相比只局限于严重程度轻重差异[3]。本研究首次对首发未用药缺陷型/非缺陷型精神分裂症患者进行认知功能研究,发现该亚型患者特征性的视觉图形认知功能缺损。
表2 缺陷型、非缺陷型组及对照组的PRM相关指标比较(±s)
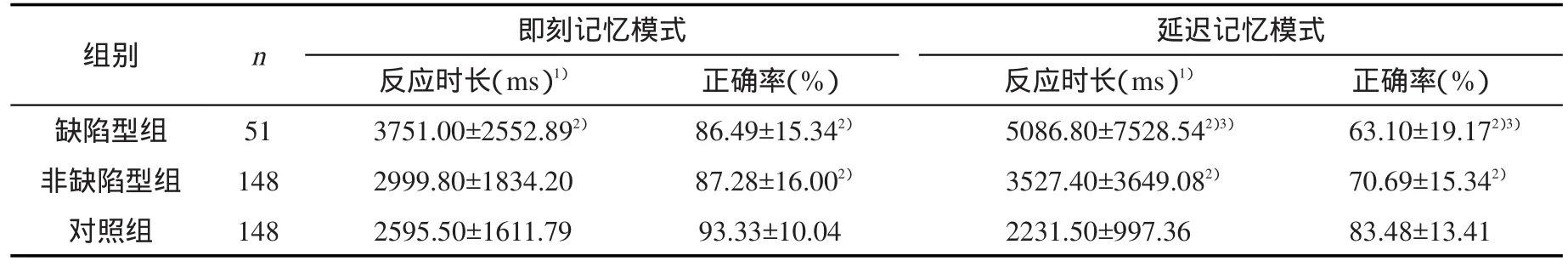
表2 缺陷型、非缺陷型组及对照组的PRM相关指标比较(±s)
1)经秩次转换后进行组间比较;2)与对照组比较,经LSD-t检验,P<0.05;3)与非缺陷型组比较,经LSD-t检验,P<0.05
组别缺陷型组非缺陷型组对照组n 51 148 148即刻记忆模式反应时长(ms)1)3751.00±2552.892)2999.80±1834.20 2595.50±1611.79正确率(%)86.49±15.342)87.28±16.002)93.33±10.04延迟记忆模式反应时长(ms)1)5086.80±7528.542)3)3527.40±3649.082)2231.50±997.36正确率(%)63.10±19.172)3)70.69±15.342)83.48±13.41
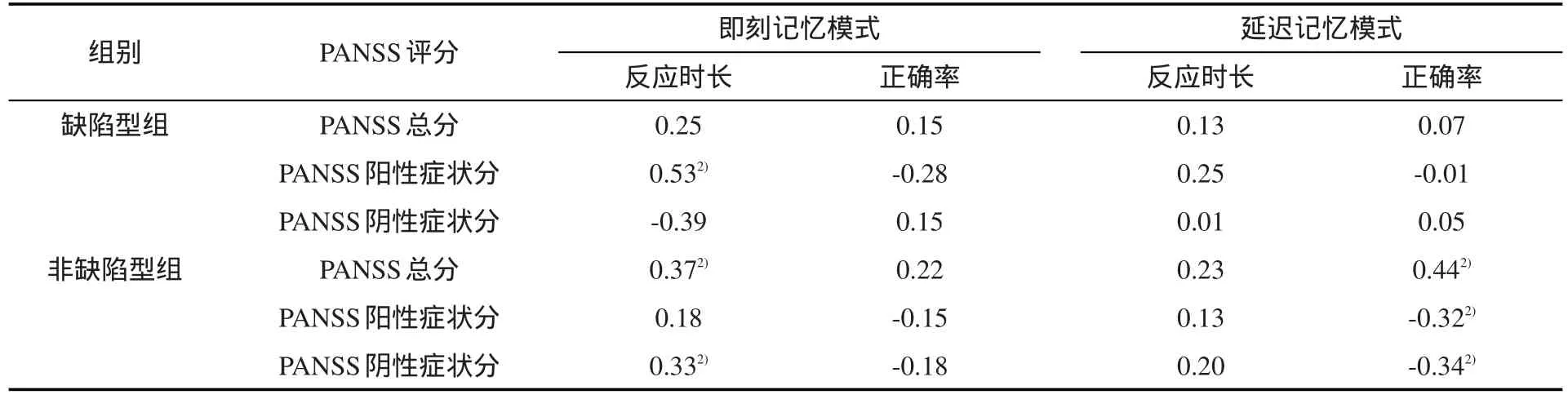
表3 缺陷型和非缺陷型组PRM相关指标与症状严重程度的偏相关分析(r)1)
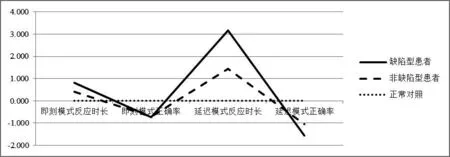
图1 三组PRM相关指标Z-score标准化残差图 以对照组所示线条为参照,上方表示反应时长较对照组更长,正确率较对照组更高;下方表示反应时长更短,正确率更低。图中反映出延迟记忆模式差异幅度较即刻记忆模式差异幅度更大。
视觉图形记忆是高级认知活动最重要的记忆基础,包括识记、保持、提取等阶段。选用的PRM工具测试的是无意义图形记忆,具有即刻与延迟双时相。分别对这两时相的准确性和反应时长指标进行比较,可得到不同亚型在不同时相的多变量变化规律。该工具属于CANTAB测试,是目前公认信效度俱佳的精神疾病认知研究电脑触屏测试工具[4,7-8]。
本研究发现,在即刻时相,缺陷型较非缺陷型患者视觉图形记忆准确性并未受到更严重的损害,这一结果得到了Janos等[9]研究的支持,该研究也得出缺陷型较非缺陷型患者短时记忆功能未下降的结论,但并未继续测试延迟记忆。而本研究克服了这一不足,进一步发现缺陷型患者在延迟时相图形记忆准确性受损更重。这种缺陷型/非缺陷型视觉图形记忆准确性受损严重程度在即刻时相无差异,延迟时相有差异,是缺陷型精神分裂症特征性的认知缺损。
图形记忆反应时长,指调动认知资源完成测试任务所花的时间。非缺陷型在即刻时相虽然准确性下降,但反应时长并未延长。而缺陷型不论在即刻还是延迟时相中,始终表现为反应时间延长,提示图形记忆的识记、保持、提取效率全面下降。这种双时相记忆效率下降也是缺陷型精神分裂症特征性的认知缺损。
精神分裂症认知和症状的关系是目前的研究热点。多数研究提示精神症状,尤其是阴性症状越严重,认知缺损越显著[10]。本研究提示:即刻时相仅记忆反应时长与临床症状相关,而延迟时相仅记忆准确性与临床症状相关。非缺陷型延迟时相图形记忆准确性与所有临床症状维度均相关,符合上述“症状越重,认知缺损越重”的特点。相反,缺陷型图形记忆准确性受损不论在即刻或是延迟时相均与临床症状无关,是独立于临床症状稳定存在的。这种独立性是首次报道,既往研究未发现的原因在于:①并未将缺陷型/非缺陷型分开研究,而缺陷型在首发精神分裂症中的比例仅占15%[11],因此研究结果以非缺陷型占主导地位;②并未将原发和继发阴性症状区分开,非缺陷型的阴性症状是继发的,而非原发。换句话说,显示出相关性的阴性症状是继发阴性症状。因此,相关性的准确表述应为:视觉图形记忆缺损独立于原发阴性症状。
近年,视觉图形记忆的脑机制研究以Cowell等[12]提出的“腹侧视觉流-嗅周皮层-海马”假说为代表,其指出颞叶是图形记忆的高级中枢,海马的作用是回想记忆,即对具体细节等特异信息的即刻提取;而颞中回嗅周皮质的功能与熟悉性记忆有关。因此,即刻时相图形记忆缺损多与海马功能下降有关,延迟记忆缺损与颞中回嗅周皮质有关。缺陷型患者延迟时相图形记忆准确性下降更严重,提示缺陷型颞中回嗅周皮质受损程度可能更严重。国内王晓晟等[13]的结构脑影像研究发现:缺陷型存在左颞中回灰质体积缺损,而非缺陷型双侧颞中回无缺损。这为我们的猜测提供了局部脑结构缺损证据。颞中回嗅周皮质功能和/或结构缺损可能是缺陷型精神分裂症视觉图形记忆缺损的脑机制。
本研究也存在一定不足,目前仅为横断面研究,不能回答认知缺损对药物治疗反应、预后等方面所起的作用,故需进一步随访跟踪,多时点纵向观察。此外,本研究中各组人群间的年龄与受教育年限难以保持全都匹配,主要因精神分裂症常青年起病,患者文化程度相对偏低。虽统计时对年龄、受教育年限因素进行校正,但更好的策略是增大样本量,同时尽量控制混杂因素。本研究的认知功能指标较单一,可在进一步研究中与其他具有双时相的记忆测试整合分析,有助于更深入全面地揭示缺陷型精神分裂症记忆缺损的特征,为早期区分缺陷型精神分裂症提供认知诊断手段。
综上所述,精神分裂症患者在疾病早期认知功能视觉图形记忆即受到损害。缺陷型在疾病早期该功能受到的损害更严重,主要为延迟时相图形记忆受损,该缺损独立于原发阴性症状,记忆效率始终降低。因此,缺陷型精神分裂症是一类具有特征性的认知缺损特点的精神分裂症亚型,延迟视觉图形记忆认知功能可能作为缺陷型/非缺陷型精神分裂症的分型指标。
[1]Carpenter WT Jr,Heinrichs DW,Wagman AM.Deficit and nondeficit forms of schizophrenia:the concept[J].Am J Psychiatry,1988,145(5):578-583.
[2]Kirkpatrick B,Buchanan RW,Ross DE,et al.A Separate disease within the syndrome of schizophrenia[J].Arch Gen Psychiatry,2001,58(2):165-171.
[3]Galderisi S,Maj M.Deficit schizophrenia:An overview of clinical,biological and treatment aspects[J].Eur Psychiatry,2009,24(8):493-500.
[4]Kirkpatrick B,Buchanan RW,McKenney PD,et al.The Schedule for the Deficit Syndrome:an instrument for research in schizophrenia[J].Psychiatry Res,1989,30(2):119-123.
[5]王湘,姚树桥,樊旭辉,等.缺陷型精神分裂症诊断量表中文版的信效度研究[J].中国临床心理学杂志,2005,13(4):392-395.
[6]Szöke A,Trandafir A,Dupont ME,et al.Longitudinal studies of cognition in schizophrenia[J].Br J Psychiatry,2008,192(4):248-257.
[7]Stip E,Lecardeur L,Sepehry AA.Computerised Assessment of Visuo-spatial Cognition in Schizophrenia—An Exploratory Meta-analysis of CANTAB Findings[J].European Psychiatric Review,2008,1(2):48-54.
[8]Potvin S,Briand C,Prouteau A,et al.CANTAB explicit memory is less impaired in addicted schizophrenia patients[J].Brain Cogn,2005,59(1):38-42.
[9]Réthelyi JM,Czobor P,Polgár P,et al.General and domain-specific neurocognitive impairments in deficitand non-deficit schizophrenia[J].Eur Arch Psychiatry Clin Neurosci,2012,262(2):107-115.
[10]Dominguez Mde G,Viechtbauer W,Simons CJ,et al.Are Psychotic Psychopathology and Neurocognition Orthogonal?A Systematic Review of Their Associations[J].Psychol Bull,2009,135(1):157-171.
[11]Kirkpatrick B,Fenton WS,Carpenter WT Jr,et al.The NIMH-MATRICS consensus statement on negative symptoms[J].Schizophr Bull,2006,32(2):214-219.
[12]Cowell RA,Bussey TJ,Saksida LM.Components of recognition memory:Dissociable cognitive processes or just differences in representational complexity?[J].Hippocampus,2010,20(11):1245-1262.
[13]王晓晟,王湘,颜莉蓉,等.运用基于体素的脑形态测量学法检测缺陷型及非缺陷型精神分裂症患者脑灰质结构异常[J].中华行为医学与脑科学杂志,2010,19(7):587-590.

