配对盒4基因Arg121Trg多态性与2型糖尿病的相关性
邓德耀,袁文丽*,杨双娟,冯 倩,高宗鹰,方 芳,李显丽
(1.云南省第二人民医院检验科,云南昆明650021;2.中国科学院昆明动物研究所遗传资源与进化国家重点实验室,云南昆明650223;3.云南省第二人民医院内分泌科,云南昆明650021)
胰岛特异性转录因子-配对盒4(paired box4,Pax4)基因属于编码促进胚胎组织细胞增殖、分化及存活的转录因子家族。Pax4基因表达对于维持胰岛细胞表型及胰岛β细胞的增殖和分化具有至关重要的作用[1-2],它的基因多态性可能与糖尿病的发生相关[3-9]。本研究应用高分辨率熔解曲线(high resolution melting,HRM)方法,对云南省昆明地区430例2型糖尿患者群Pax4基因Arg121Trg多态性(rs114202595)进行分析,旨在探讨Pax4基因Arg121Trg多态性与2型糖尿患者群的相关性。
1 资料与方法
1.1 研究对象
本研究选择了云南省昆明地区具有医疗记录的430例2型糖尿病患者(T2DM)、200例糖耐量减低人群(IGT)和446例性别和年龄相匹配的OGTT正常的体检人群(NGT),并获得了受试者的知情同意。糖尿病及糖耐量减低诊断采用WHO1999年诊断标准。
1.2 试剂
即用PCR扩增试剂盒(上海生工生物工程有限公司),LightCycler 480高分辨率熔解扩增试剂盒(德国罗氏诊断有限公司)。
1.3 实验方法
1.3.1 临床资料收集:所有研究对象采用统一调查表进行调查,内容包括一般情况、个人史、家族史以及药物使用情况等。研究对象行OGTT试验后在日立7600全自动生化分析仪上测定血糖。胰岛素和C肽均用放射免疫法检测。稳态模型胰岛素抵抗指数HOMA-IR=FPG×FINS/22.5,稳态模型胰岛素分泌指数HOMA-β=20×FINS/(FPG-3.5)。
1.3.2 基因组DNA制备:酚-氯仿-异戊醇法提取基因组DNA,紫外分光光度计对DNA浓度进行测定,将所有DNA样品稀释至20 ng/μL。
1.3.3 引物的合成:根据Primer 3.0软件设计Pax4基因的引物。上游引物序列:5'-GTAGGTGGAGAC AGATGGGAAA-3';下游引物序列:5'-GTAGTCCCTG GTCCTCCTGTAA-3'。引物由上海生工生物工程有限公司合成,用HPLC纯化。
1.3.4 HRM检测:Pax4基因 Arg121Trg多态性PCR体系:10 ng的基因组DNA、1×PCR Master mix、2.0 mmol/L MgCl2、200 nmoL的正反向引物,并用PCR级别的水补足至20 μL。PCR条件:95℃预变性10 min后行触底PCR,即95℃ 10 s,65℃ ~55℃退火15 s,72℃ 10 s,55个循环,其中前10个循环65℃ ~55℃,每个循环退火温度降1度,后45个循环退火温度维持55℃。HRM分析条件:95℃1 min,40℃ 1 min,熔解曲线数据收集从65℃到95℃,温度上升率为1℃/s,且每升高1℃进行15次数据采集。最后40℃冷却10 s。应用gene scanning软件进行实时数据检测和分析。随机选取不同熔解曲线的产物共20例测序验证基因型结果。以测序得到的野生纯合子GG(Arg/Arg)、突变杂合子GA(Arg/Trg)和突变纯合子AA(Trg/Trg)分别作为标准品,分析其他DNA样本基因型。
1.4 统计学分析
2 结果
3组间年龄、性别构成比无差异。与NGT组相比,IGT及 T2DM组的 FBG、PBG均有升高 (P<0.01)。IGT和T2DM组的FINS和C0min均显著高于NGT组(P<0.05);IGT组PINS和C120min均显著高于NGT组(P<0.01)和T2DM组(P<0.05)。IGT、T2DM组的HOMA-IR均显著高于NGT组(P<0.01),而T2DM组的HOMA-β则显著低于NGT组(P<0.01)和IGT组(P<0.05);从 NGT到 IGT到T2DM过程中,HOMA-IR逐渐增加(表1)。
Pax4基因Arg121Trg单核苷酸多态性位点基因型(图1)明显的分为 GG(Arg/Arg,蓝色曲线)、GA(Arg/Trg,红色曲线)、AA(Trg/Trg绿色曲线)3型,且与测序结果一致(图2)。
GG纯合子(Arg/Arg)在T2DM组中的频率0.909,在IGR组中为0.935,在NGT组为0.939;A等位基因(Trp121)和G等位基因(Arg121)的频率在3组间分布如表2所示。T2DM组Arg121Trg单核苷酸多态性GA+AA基因型(Arg/Trg+Trg/Trg)人群的胰岛素使用率为69.2%,显著高于GG基因型(Arg/Arg)人群(P=0.001)。而GG基因型和GA+AA基因型的表型间的其他指标 FBG、FINS、C0min、PBG、PINS、C120min、HOMA-IR和HOMA-β见表3所示。
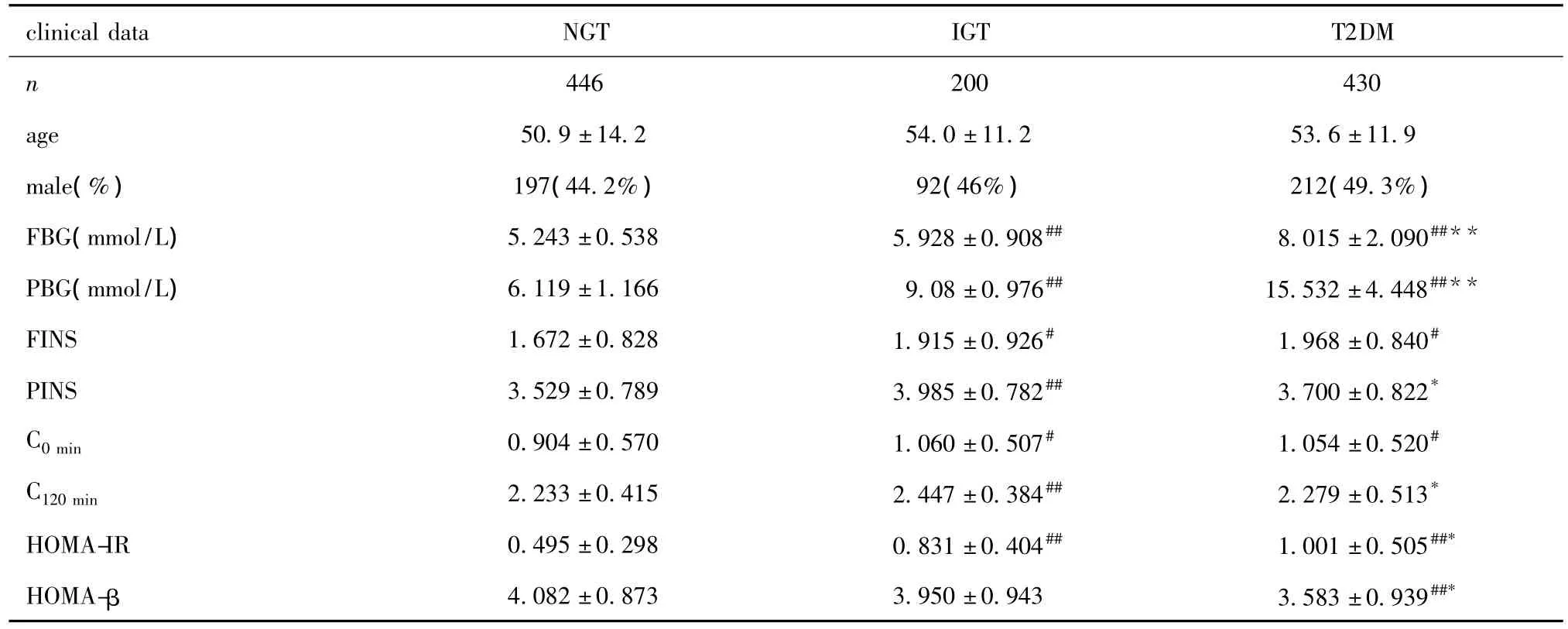
表1 NGT、IGT和T2DM组个体临床变量比较Table 1 The clinical data in normal group,glucose tolerance group and diabetes group
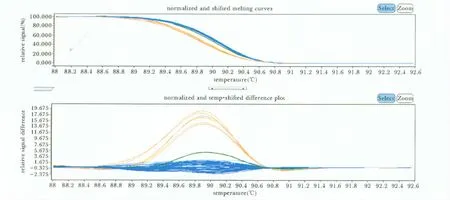
图1 Pax4基因Arg121Trg多态性3种不同基因型的高分辨率熔接曲线图Fig 1 Genotyping of Arg121Trg polymorphism of Pax4 by high resolution melting

图2 Pax4基因Arg121Trg多态性3种不同基因型的测序图Fig 2 Genotyping of Arg121Trg polymorphism of Pax4 by sequencing
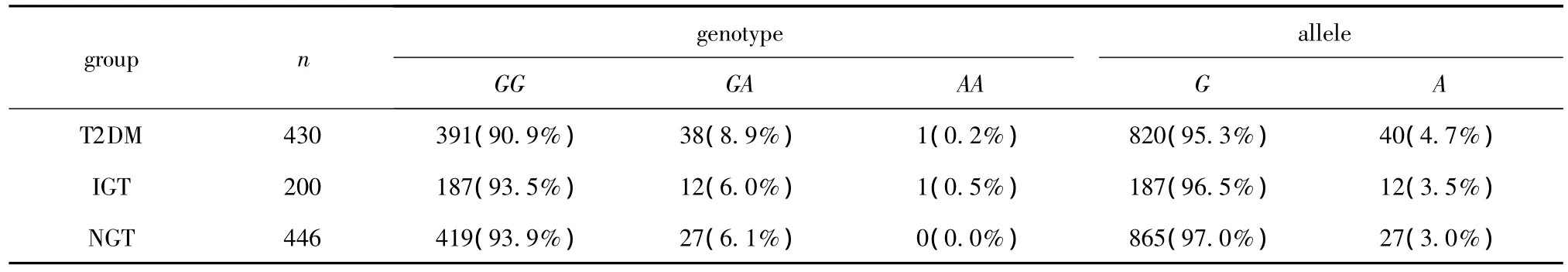
表2 T2DM组、IGT组和NGT组Pax4基因Arg121Trg基因型与等位基因分布频率Table 2 The distribution frequencies of genotype and allele of Arg121Trg among type 2 diabetes group,impaired glucose tolerance group and normal group
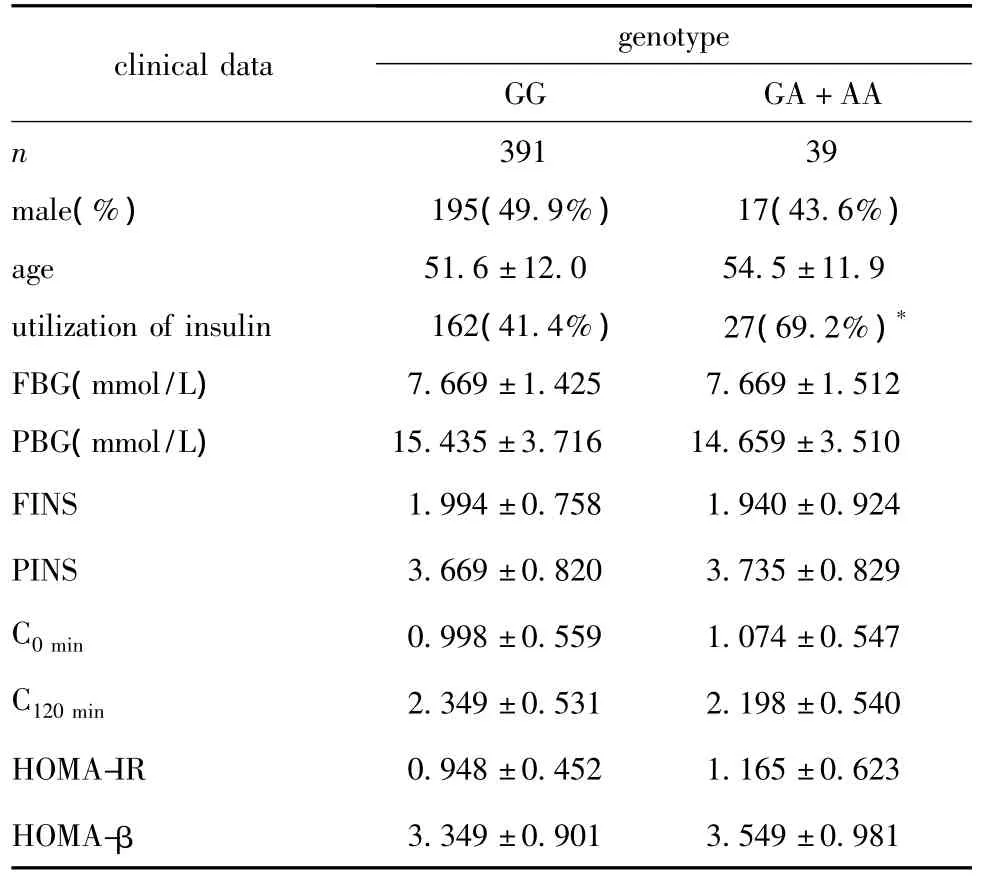
表3 T2DM组Pax4基因Arg121Trg基因多态性与临床变量Table 3 The polymorphism of Arg121Trg of Pax4 gene and clinical data in type 2 diabetes group
3 讨论
在本研究中,云南省昆明地区430位T2DM患者Pax4基因rs114202595位点GG基因型及A等位基因频率与日本人[7]、印度北部[8]及中国湖南省人群[9]的文献报道不尽一致,且3组间未见显著性差异。这些不同国家和地区Trg121分布频率的差异很可能源于遗传异质性、群体差异或者是基因和环境的相互作用。本研究中T2DM组患者FBG平均水平在8.015左右,但FINS和C0min水平较IGT组未见明显升高,同时PINS和C120min均显著低于IGT组。说明本研究中T2DM人群存在一定程度的胰岛β细胞分泌功能的早期损害。值得注意的是,本研究中T2DM组GA+AA基因型人群的胰岛素使用率比GG基因型显著增加,此结果与日本793例2型糖尿病患者不同基因型研究中胰岛素使用情况一致[7]。结合起来分析,Pax4基因 Arg121Trg位点 A等位基因可能是2型糖尿患者群胰岛β功能进展性紊乱的一个分子标记。也就是说,含有A等位基因的T2DM人群存在严重的胰岛素缺乏,他们需要更早接受胰岛素治疗来代替口服降糖药物治疗。当然,本研究样本量较小,尚需进一步的大样本量前瞻性研究加以证明。
本研究还发现T2DM组Pax4基因Arg121Trg多态性两种基因型间的临床变量除胰岛素使用率外,其他指标均无明显差异,而在日本人的研究中观察到Trp121携带者第一相C-肽分泌水平显著高于对照人群[7],以湖南省人群为受试对象的研究发现R等位基因携带者餐后胰岛素水平显著高于W等位基因携带者[9],但在本研究中并未观察到上述差异。此结果提示,除Pax4基因Arg121Trg多态性外,还可能存在其他的未证实因素共同影响胰岛β细胞的分泌功能。Pax4基因Arg121Trg多态性A等位基因(Trp121),作为2型糖尿患者群胰岛β功能进展性紊乱的分子标记之一,也许并未对其可能出现的胰岛素分泌能力紊乱做出重要的贡献,而仅是其发生的因素之一。
本研究只是在应用HRM方法的基础上对较小样本T2DM人群Pax4基因Arg121Trg位点进行了多态性分析,并推测A等位基因(Trp121)可能是2型糖尿患者群胰岛β功能进展性紊乱的一个分子标记,含有A等位基因(Trp121)的2型糖尿患者群需要更早接受胰岛素治疗来代替口服降糖药物治疗。当然,精确的评估尚需通过大规模临床试验和流行病学研究予以证实。
[1]Liang XD,Guo YY,Sun M,et al.Streptozotocin-induced expression of Ngn3 and Pax4 in neonatal rat pancreatic αcells[J].World J Gastroenterol,2011,17:2812 -2820.
[2]Hu He KH,Lorenzo PI,Brun T,et al.In vivo conditional Pax4 overexpression in mature islet β-cells prevents stressinduced hyperglycemia in mice[J].Disbetes,2011,60:1705-1715.
[3]Jo W,Endo M,Ishizu K,et al.A novel PAX4 mutation in a Japanese patient with maturity-onset diabetes of the young[J].Tohoku J Exp Med,2011,223:113-118.
[4]Dusatkova P,Vesela K,Pruhova S,et al.Lack of PAX4 mutations in 53 Czech MODYX families[J].Diabet Med,2010,27:1459-1460.
[5]Haaland WC,Scaduto DI,Maldonado MR,et al.A-betasubtype of ketosis-prone diabetes is not predominantly a monogenic diabetic syndrome[J].Diabetes Care,2009,32:873-877.
[6]周敏,张英,张冬梅等.Pax4基因多态性与胰岛自身抗体阴性酮症倾向糖尿病的关系[J].中南大学学报,2010,35:215-221.
[7]Tokuyama Y,Matsui K,Ishizuka T,et al.The Arg121Trp variant in PAX4 gene is associated with β-cell dysfunction in Japanese subjects with type 2 diabetes mellitus[J].Metabolism,2006,55:213-216.
[8]Chavali S,Mahajan A,Tabassum R,et al.Association of variants in genes involved in pancreatic β-cell development and function with type 2 diabetes in North Indians[J].J Hum Genet,2011,56:695 -700.
[9]Gong ZC,Huang Q,Dai XP,et al.NeuroD1 A45T and PAX4 R121W polymorphisms are associated with plasma glucose level of repaglinide monotherapy in Chinese patient with type 2 diabetes[J].Br J Clin Pharmacol,2012,74:501-509.

