慢性乙型肝炎患者外周血单个核细胞Toll样受体3的表达降低
周兰英,蒋乐龙,李定梅,阎 青,于红缨,姚志军,向开敏
(1.怀化医学高等专科学校,湖南怀化418000;2.怀化市第一人民医院,湖南怀化418000;3.中南大学湘雅三医院,湖南长沙410013)
乙型肝炎 (hepatitis B,HB)是由乙型肝炎病毒 (hepatitis B virus,HBV)感染机体后所引起的疾病。乙型肝炎是一个世界性公共卫生问题,全球约20亿人曾感染过HBV,其中3.5亿人为慢性感染者,我国的慢性乙肝患者约9 300万人[1]。已有的大量研究证实,慢性乙肝与多种慢性肝病、肝硬化和肝细胞癌的发生有关,严重危害人类的身体健康[2-4],有关慢性乙肝的致病机制和防治方法的研究是感染性疾病研究中的重点之一[5]。天然免疫是机体抵抗病毒感染的重要防线,在乙型肝炎病毒感染时同样发挥着重要作用[6-7]。而 Toll样受体 (Toll-like receptor,TLR)既是天然免疫的重要组成分子,也是联系天然免疫与适应性免疫的重要纽带[8]。本研究拟通过检测慢性乙肝患者外周血单个核细胞TLR3的表达以及血清中相关细胞因子含量,同时比较患者体内HBV的DNA复制水平,明确乙型肝炎病毒感染与TLR3表达之间的联系,为探索乙肝病毒的致病机制提供新的实验证据。
1 材料与方法
1.1 研究对象
选择2011-03—2012-03在中南大学湘雅三医院就诊的慢性乙肝患者25例,根据肝穿刺病理结果及其他临床资料,参照慢性乙型肝炎防治指南(2010 年版)确诊[9],轻度12 例,中度 10 例,重度3例。其中男性20例,女性5例,年龄范围:21~53岁,平均年龄34.3岁。根据患者血清HBeAg的状态和HBV拷贝数将上述患者分为复制活跃组(HBeAg阳性,且 HBV DNA拷贝数 >1×105copies/Ml,n=15)和复制不活跃组(HBeAg阴性,且HBV DNA 拷贝数介于1×103~1×105copies/mL,n=10)。同时选择来院体检的健康志愿者25例作为健康对照组,其中男性20例,女性5例,年龄范围:20~54岁,平均年龄30.6岁。血清HBsAg及HBV DNA均为阴性,无心、肝、肾、消化道、代谢异常和神经等系统疾病史。
1.2 研究方法
1.2.1 主要试剂:血清HBV DNA检测试剂盒(广州达安基因股份有限公司);TNF-α、IFN-β ELISA检测试剂盒(晶美公司);Ficoll淋巴细胞分离液(Sigma公司);Trizol及反转录试剂盒(Promega公司),Taq DNA Polymerase(TaKaRa公司),引物合成由上海生工完成;小鼠抗人TLR3荧光抗体以及同型对照抗体(eBioscience公司),破膜剂(Fix&Perm)(Beckman公司)。小鼠抗人TLR3抗体、小鼠抗人β-actin多克隆抗体、兔抗小鼠抗体及ECL试剂盒(Santa Cruz公司)。
1.2.2 标本采集与保存:所有对象均于清晨采集空腹静脉血5 mL,其中3 mL全血加入肝素钠抗凝管,应用Ficoll淋巴细胞分离液分离PBMC;另2 mL全血不抗凝,在小试管中自然凝血后收集血清,取100 μL血清在30 min内进行HBV DNA检测,其余血清于-70℃保存待用。
1.2.3 血清HBV DNA检测:采用荧光定量PCR法,按照试剂盒操作说明进行,该试剂盒的最低敏感度为1×103copies/mL,本研究中慢性乙肝患者的血清HBV DNA拷贝数均高于此数值。患者血清HBeAg的情况依据门诊检验结果。
1.2.4 TLR3 mRNA表达检测:将采集到的PBMC用PBS洗涤1次后,调细胞浓度至106个/mL,取1 mL细胞悬液以Trizol法抽提总RNA,按照反转录试剂盒说明将RNA反转录为cDNA,以得到的cDNA为模板进行PCR扩增,TLR3扩增引物:上游引物:5'-GCTGGAAAATCTCCAAGAGC-3',下游引物:5'-CTTCCAATTGCGTGAAAACA-3';扩增片段长度为159 bp;以β-actin为内对照,扩增引物:上游引物:5'-GGGAAATCGTGCGTGACAT-3',下游引物:5'-GT CAGGCAGCTCGTAGCTCTT-3';扩增片段长度为106 bp。扩增后通过凝胶成像,经全自动凝胶成像分析仪扫描DNA条带灰度值,软件分析条带灰度比值,以β-actin的mRNA为参照,计算TLR3 mRNA的相对表达量。
1.2.5 流式细胞术检测TLR3表达:将采集到的PBMC用PBS洗涤1次后,调细胞浓度至106个/mL,取500 μL,加入破膜剂孵育20 min后,再加入 FITCTLR3单抗在4℃下避光继续孵育20 min,PBS洗涤1次,重悬细胞,0.5%多聚甲醛固定后,流式细胞仪检测。
1.2.6 免疫印迹检测TLR3表达:将剩余的PBMC用细胞裂解液裂解,BCA法测定裂解液总蛋白浓度,将裂解液蛋白样品(50 μg总蛋白/泳道)经10%SDS-PAGE电泳后,转移至PVDF膜;分别加入抗TLR3及抗 β-actin抗体(一抗)在37℃孵育2 h,PBS-T洗膜4次;辣根过氧化酶标记的兔抗小鼠IgG抗体(二抗)与膜孵育1 h,PBS-T洗膜4次,ECL试剂盒检测印迹蛋白,X线片扫描后,用图像分析软件分析。
1.2.7 细胞因子检测:按照相关ELISA试剂盒说明书进行操作,每份血清设复孔,450 nm波长下酶标仪测定样本的吸光度值(A),通过标准曲线计算样本浓度。
1.3 统计学分析
2 结果
2.1 各组PBMC中TLR3 mRNA的表达
复制不活跃组以及复制活跃组慢性乙肝患者PBMC的TLR3 mRNA表达水平均显著低于健康对照组(P<0.05);且HBV复制活跃组的TLR3 mRNA表达水平进一步低于HBV复制不活跃组(P<0.05)(图1,表1)。
2.2 流式细胞术检测各组PBMC中TLR3的表达
两组慢性乙肝患者PBMC中TLR3+细胞百分数均显著低于健康对照组(P<0.05);且HBV复制活跃组的TLR3+细胞百分数进一步低于HBV复制不活跃组(P<0.05)(表2)。
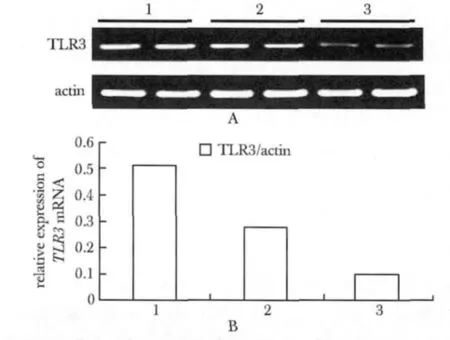
图1 RT-PCR检测TLR3 mRNA的表达Fig 1 TLR3 mRNA expression detected by RT-PCR
2.3 免疫印迹检测各组PBMC中TLR3的表达
慢性乙肝患者的TLR3表达水平低于健康对照组,且HBV复制活跃组的TLR2表达水平进一步低于HBV复制不活跃组,这与流式细胞检测结果一致(图2)。
2.4 ELISA检测各组血清中相关细胞因子的水平
慢性乙肝患者血清中的TNF-α及IFN-β水平均显著低于健康对照组(P<0.05),且HBV复制活跃组进一步低于HBV复制不活跃组(P<0.05)(表3)。
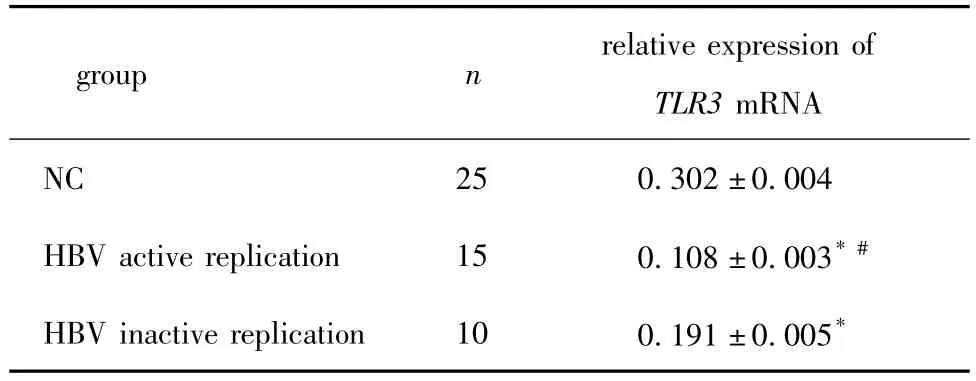
表1 PBMC中TLR3 mRNA表达Table 1 The TLR3 mRNA expression in PBMC
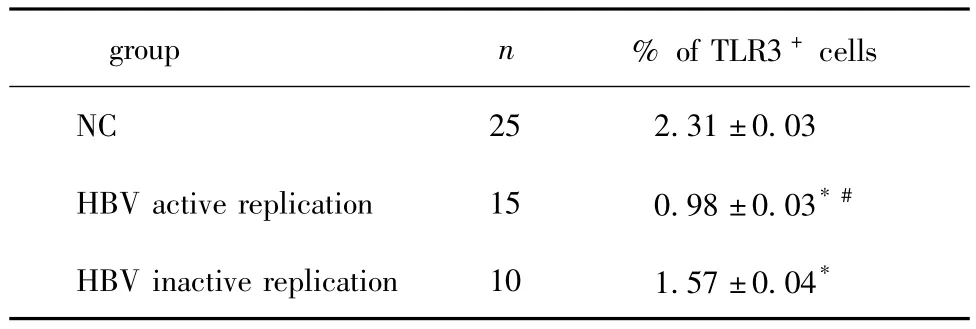
表2 PBMC中TLR3的表达Table 2 The TLR3 expression in PBMC
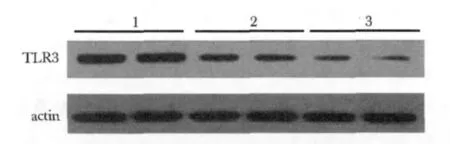
图2 免疫印迹检测PBMC中TLR3蛋白的表达Fig 2 The Western-blotting results of TLR3
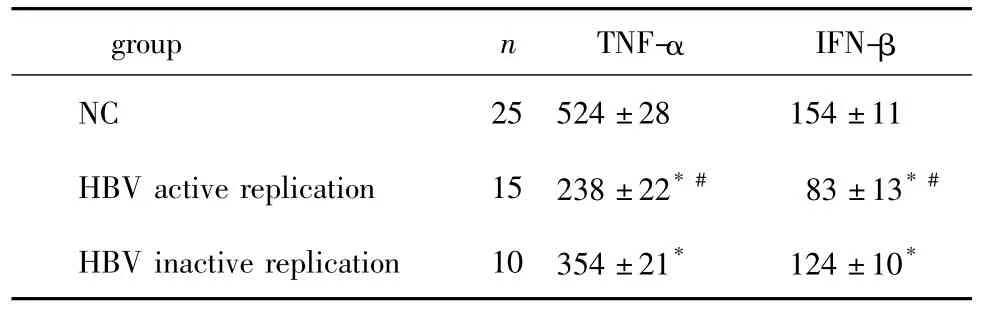
表3 外周血TNF-α及IFN-β含量(ng/L)Table 3 Concentration of TNF-α and IFN-β in peripheral blood(ng/L)
3 讨论
慢性乙型肝炎的致病机制一直是研究者关注的热点,在乙型性肝炎病毒感染过程中,宿主的抗病毒免疫功能状态将显著影响疾病的发展,同时也是影响乙肝预后的一个重要的方面[10]。机体对病毒的有效识别和清除依赖于天然免疫和获得性免疫的相互补充和协作,Toll样受体家族(TLRs)是能够识别病原体相关分子模式从而快速启动天然免疫反应,并影响获得性免疫反应的发生和发展方向的关键性分子[11]。TLRs为Ι型跨膜信号蛋白受体在进化上高度保守,不同的TLR有不同的细胞分布,而且可识别并区分不同类型的病原体。其中TLR3主要分布于体内的单核细胞和树突状细胞,在上述细胞的抗原提呈过程中发挥重要作用,TLR3可识别病毒在宿主体内复制时产生的双链RNA(dsRNA),而且与乙肝病毒的感染和致病密切相关[12]。
本研究结果显示,慢性乙肝患者外周血单个核细胞中TLR3的mRNA以及蛋白表达水平均受到抑制,而且在病毒复制活跃的个体TLR3的抑制更为明显;同时血清中与病毒免疫密切相关的细胞因子TNF-α和IFN-β的含量也表现出与TLR3相一致的趋势,即在乙肝患者体内水平下降,且降低幅度与病毒复制活性相关。这些结果强烈提示:TLR3的表达与慢性乙肝患者体内的病毒复制直接相关,乙肝病毒感染可下调TLR3的表达,这很可能是乙肝病毒抑制宿主的抗病毒免疫,导致疾病发生的重要机制。
[1]Nebbia G,Peppa D,Maini MK.Hepatitis B infection:current concepts and future challenges[J].QJM,2012,105:109-113.
[2]Kim BK,Han KH,Ahn SH.Prevention of hepatocellular carcinoma in patients with chronic hepatitis B virus infection[J].Oncology,2011,81(Suppl 1):41 -49.
[3]张雪峰,王斌,钱冬萌.循环DNA和HBV-DNA载量与原发性肝癌的相关性探讨[J].现代生物医学进展,2011,7:573 -575.
[4]姜孝新,蒋艳,谢小平.MICA基因5外显子与湖南地区汉族人群肝癌的相关性研究[J].肿瘤药学,2012,2:263-267.
[5] Petersen J.Hepatitis B in clinical practice [J].Med Monatsschr Pharm,2011,34:402-414.
[6]Abe M,Onji M.Mechanisms of the immune response against HBV infection[J].Nihon Rinsho,2011,69(Suppl 4):369-373.
[7]姜孝新,蒋艳,霍治.NKG2D配体在肿瘤免疫中作用新进展[J].肿瘤药学,2012,2:14-18.
[8]Lee CC,Avalos AM,Ploegh HL.Accessory molecules for Toll-like receptors and their function[J].Nat Rev Immunol,2012,12:168 -179.
[9]贾继东,李兰娟.慢性乙型肝炎防治指南[J].临床肝胆病杂志,2011,27:113-128.
[10]Nakamura I.The mechanisms of establishment of chronic infection of HBV [J].Nihon Rinsho,2011,69(Suppl 4):374-378.
[11] Abdelsadik A,Trad A.Toll-like receptors on the fork roads between innate and adaptive immunity[J].Hum Immunol,2011,72:1188 -1193.
[12]Li N,Li Q,Qian Z,et al.Impaired TLR3/IFN-beta signaling in monocyte-derived dendritic cells from patients with acute-on-chronic hepatitis B liver failure:relevance to the severity of liver damage[J].Biochem Biophys Res Commun,2009,390:630 -635.

