聚丙烯亚胺-聚谷氨酸苄酯多臂接枝聚合物的制备及其结构表征*
张 璇,鹏越峰,蔡青青
(1.深圳市精神卫生中心,广东深圳 518020;2.深圳市心理健康重点实验室,广东深圳 518020;3.中国科学院深圳先进技术研究院,广东深圳 518055)
随着基因治疗的不断深入,非病毒基因载体的研究越来越受到人们的重视,阳离子聚合物是近年发展起来的一种新型非病毒基因载体,由于其表面存在大量的阳离子电荷,通过与siRNA或DNA链上负电性的聚电解质 (磷酸根)的静电作用缔合成复合物,从而保护siRNA或DNA使其免受核酸酶的降解,在此过程中,含目的基因的质粒体积会被高度压缩成50~200 nm大小的纳米球,大大增强了对细胞膜的穿透能力[1-2]。聚丙烯亚胺 (Poly(propylenimine),PPI)树状聚合物1993年首次被合成出来,它的大小由代数来标明,并随代数增加而增加[3-4]。与聚酰胺 - 胺树状聚合物 (Poly(amidoamine),PAMAM)一样,PPI树状聚合物有聚胺的典型结构,外部为伯胺基团,内部为叔胺基团。与DNA的结合能力是PPI发挥转染作用的先决条件,研究发现[5],随着代数的增加,与DNA的结合能力增强,但PPI的毒性会随代数的增加而急剧增加,这大概是PPI到目前为止没有像PAMAM一样被广泛研究的原因之一。许多学者尝试着对低代数的PPI进行化学修饰以改善其作为基因载体的性能[6-8]。
具有支化结构的聚合物,尤其是树状大分子,表现出的性能是传统线性聚合物所不能达到的[9],为了减少毒性并且保持较高的转染率,许多学者研究设计出可生物降解的伪树状大分子材料 (pseudodendrimers),Russ等[10]以较小相对分子质量的PEI(oligoethylenimine,OEI)为核,通过二丙烯酸酯将包括OEI在内的低聚胺连接在OEI表面,以形成可生物降解的,富含氨基的大分子聚合物,此大分子聚合物不仅表现出很好的DNA结合能力和转染效率,而且具有明显的肿瘤靶向性。Chen等[11]以OEI为核,合成了多分枝的聚谷氨酸骨架,再将OEI接枝到聚谷氨酸骨架表面,此大分子聚合物在不同细胞系中都表现出优于PEI25K的转染效率,其转染效率受血清的影响很小。然而,OEI结构的不对称性使以OEI为核的伪树状大分子并没有典型的树状大分子的对称结构。
本研究拟对第二代树状大分子PPI表面进行修饰,使其表面接枝上聚谷氨酸苄酯,合成结构对称的多臂聚谷氨酸苄酯材料,通过对树状大分子的结构进行可控设计,从而大大增加载体的生物相容性及生物可降解性,降低其毒性,使其有望成为新型的非病毒基因载体材料。
1 实验部分
1.1 实验原料
第二代聚丙烯亚胺树状大分子 (G2.0PPI)由中国科学院深圳先进技术研究院提供 (1H NMR(CDCl3,500MHz)δ:1.33(m,4 H,NCH2CH2CH2CH2N),1.55(m,24 H,NCH2CH2CH2N),2.34(m,20 H,NCH2CH2CH2N),2.39(m,16H,NCH2CH2CH2NH2),2.67(t,16H,CH2NH2)。L-谷氨酸 (生化试剂,上海生化试剂二厂);苯甲醇、硫酸、四氢呋喃、石油醚 (30~60℃)、氯仿、乙醚 (均为分析纯,广州化学试剂厂);双 (三氯甲基)碳酸酯 (化学纯,上海化工专科学校实验化工厂)。
1.2 L-谷氨酸苄酯的 N-酸酐 (BLG-NCA)的制备
[12],于三颈瓶中加入L-谷氨酸、苯甲醇、机械搅拌下滴加一定量的硫酸,加热至70℃左右,真空脱水6 h,产物倒入含碳酸氢钠的冰水中,至冰箱中过夜,抽滤,重结晶,干燥得L-谷氨酸苄酯 (BLG)。再在反应瓶中加入新制得的BLG、四氢呋喃以及双 (三氯甲基)碳酸酯,在50℃加热10 min,再继续升温至60℃左右,待反应液转透明后继续搅拌30 min。加入低沸点的石油醚沉淀、冷藏放置12 h后,抽滤,再用石油醚洗涤数次,真空干燥得白色结晶状BLG-NCA。
1.3 聚丙烯亚胺-聚谷氨酸苄酯多臂接枝聚合物(Multi-armed PBLG,MP)的合成
将BLG-NCA加入到无水氯仿中,剧烈搅拌使其溶解,同时将G2.0PPI的无水氯仿溶液置三颈烧瓶中,室温下搅拌片刻后,往烧瓶中滴加一定量的BLG-NCA的氯仿溶液,引发剂G2.0PPI与BLGNCA的摩尔比例为1∶100。混合液在室温下搅拌72 h反应,反应完全后旋转蒸发除去绝大部分溶剂,加入冰乙醚沉淀,抽滤,室温下真空干燥24 h,得白色MP固体。
1.4 表征
1.4.1 红外光谱的测定 采用 KBr压片制备,G2.0PPI样品用其CHCl3液在 KBr晶片上涂膜制备,各样品的IR谱分析在PerkinElmer 683型红外光谱仪上进行。
1.4.2 核磁共振测定 在 Brucker公司的 AV-600型核磁共振仪进行1H NMR和13C NMR的测定,均以CF3COOD为溶剂,温度为25℃。
1.4.3 GPC测定 以聚苯乙烯作为标准物,四氢呋喃为流动相,流速为1.0 mL/min,检测温度为30℃,在Perkin-Elmer Series 200凝胶渗透色谱仪上进行。
2 结果与讨论
2.1 聚丙烯亚胺-聚谷氨酸苄酯多臂接枝聚合物(MP)的合成
共聚物的合成路线如图1所示。以G2.0PPI末端的伯胺为引发剂,用开环聚合的方法在室温下引发BLG-NCA的聚合,即得到多臂接枝聚合物MP。
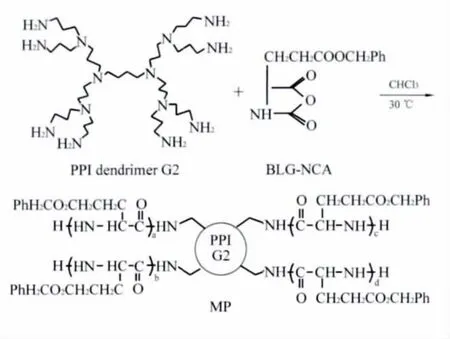
图1 MP的合成路线Fig.1 Synthetic scheme of MP
2.2 IR 光谱分析
由图 2可见,G2.0PPI的 IR图谱中 3 346 cm-1为伯胺 N-H 的伸缩振动,2 941、2 861和2 805 cm-1为 C-H 的伸缩振动,1 564 cm-1为伯胺N—H的弯曲振动,1 470、1 382和1 312 cm-1为C—H的弯曲振动。MP的IR图谱中1 735 cm-1峰代表生成的酯基中=CO的伸缩振动,而737和697 cm-1为苯环上C—H的弯曲振动,由此图谱可初步确定生成了聚谷氨酸苄酯的结构。
2.3 1H NMR 的测定
图3为以CF3COOD为溶剂的G2.0PPI、BLGNCA和MP的1H NMR谱图,G2.0PPI在 δ 3.28和3.41(峰c和d)分别为PPI上与叔胺及伯胺相连碳上的氢,从BLG-NCA的氢谱可见,δ 7.2(峰i)为苯环上的氢的信号,δ 5.1(峰h)为PBLG链段上苄基 (—CH2Ph)上的氢,δ 4.3(峰 g)为(—CH—)上的氢,δ 2.3 ~1.8 以及 2.7 ~ 2.5(峰e、f)分别属于链接苄基和主链的两组氢的信号。在MP的氢谱中g峰消失,而在δ 4.7(峰j)的位置上出现PBLG骨架上 (—CH—)峰,说明开环聚合成功。MP的氢谱中,既有G2.0PPI的峰c和d,又有PBLG侧链上的峰e、f、h和i。由图谱可确定聚合物MP的生成。根据MP中苯环上的氢 (δ 7.2)和PPI上与叔胺及伯胺相连碳上的氢(δ 3.2~3.6)的积分面积之比计算出聚合物 MP中两组分的质量比及相对分子质量,分别为1∶102及23 111,可见聚合物的实际组成与反应的投料比接近,说明反应是一种可控反应,因此可通过调节BLG-NCA单体和作为引发剂的PPI之间的摩尔比来调节聚合物的组成。

图3 G2.0PPI、BLG-NCA和 MP的1H NMR 谱图Fig.3 1H NMR spectra of G2.0PPI、BLG-NCA and MP
2.4 13C-NMR 的测定
从图4中 MP的碳谱可见,δ 173.8和 53.5(峰7和8)分别属于PBLG骨架上的两种碳(—NHCO—和—CHNHCO—)。δ 69.1(峰 12)为PBLG链段上苄基上的碳,而δ 135.0和128.7(峰13和14)为PBLG链段苯环上的碳信号。δ 27.1和29.7(峰9和10)分别属于链接苄基和主链的两组碳的信号。从G2.0PPI的碳谱可见,δ 40.6是大分子引发剂G2.0PPI中 (NH2CH2—)碳上的峰(峰4),在反应后向高场移动到δ 23.5位置,而峰1、2、3、5和6未见明显移动,说明 G2.0PPI上所有的端氨基都作为引发剂参与了反应,并同时引发了BLG-NCA的开环聚合。
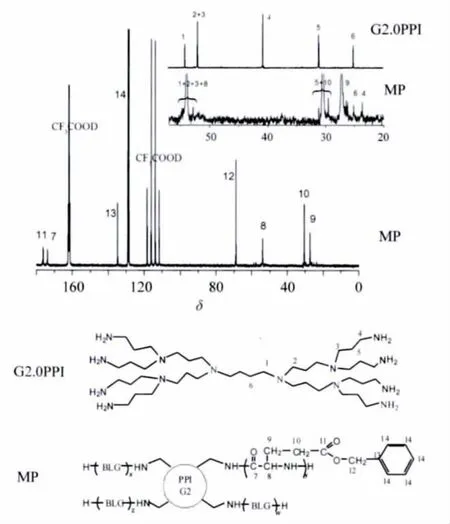
图4 G2.0PPI和MP的13C NMR谱图Fig.4 13C NMR spectra of G2.0PPI and MP
2.5 GPC 的测定
图5为MP的GPC图谱,曲线上的聚合物是单一峰,GPC计算所得的Mn为23 348,相对分子质量分布为1.385,与1H NMR计算得到的相对分子质量23 111相比,GPC测得的聚合物的相对分子质量稍微偏大,这是由于生成的多臂聚合物材料有着与GPC标样聚苯乙烯不同的流体力学行为所致。
3 结论
本研究采用开环聚合的方法,合成了 PPIPBLG多臂接枝聚合物,用 IR、1H NMR、13C NMR及GPC对共聚物进行了表征。结果证实了生成了多臂聚谷氨酸苄酯聚合物的可行性,产物中无残留反应物。此聚合物具有树状大分子的对称结构,将为进行下一步聚合物作为非病毒基因载体转染细胞的研究奠定实验基础。
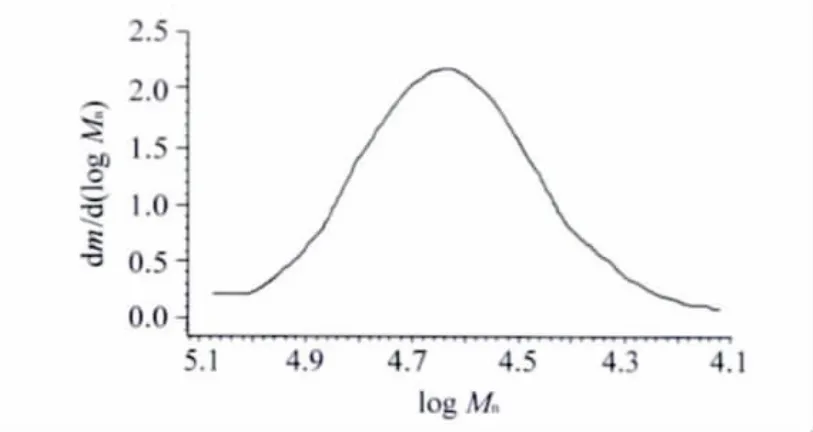
图5 MP的GPC谱图Fig.5 GPC chromatogram of MP
参考文献:
[1]PANDITA D,SANTOS J L,RODRIGUES J,et al.Gene delivery into mesenchymal stem cells:a biomimetic approach using RGD nanoclusters based on poly(amidoamine)dendrimers[J].Biomacromolecules,2011,12(2):472-481.
[2]LIU Y,REINEKE T M.Degradation of poly(glycoamidoamine)DNA delivery vehicles:polyamide hydrolysis at physiological conditions promotes DNA release[J].Biomacromolecules,2010,11(2):316 -325.
[3]SMITH D K.Dendrimers and the double helix -from DNA binding towards gene therapy[J].Curr Top Med Chem,2008,8(14):1187-1203.
[4]KLINGLER J,KAUFMANN D.Polypropylenimine generation four:a suitable vector for targeted gene alterationin vitro[J].J Drug Target,2012,20(5):474 -480.
[5]ZINSELMEYER B H,MACKAY S P,SCHATZLEIN A G,et al.The lower-generation polypropyleneimine dendrimers are effective gene-transfer agents[J].Pharm Res,2002,19(7):960 -967.
[6]KOPPU S,OH Y J,EDRADA-EBEL R,et al.Tumor regression after systemic administration of a novel tumortargeted gene delivery system carrying a therapeutic plasmid DNA[J].J Control Release,2010,143(2):215 -221.
[7]RUSS V,GÜNTHER M,HALAMA A,et al.Oligoethylenimine-grafted polypropylenimine dendrimers as degradable and biocompatible synthetic vectors for gene delivery[J].J Control Release,2008,132(2):131 -140.
[8]TARATULA O,GARBUZENKO O B,KIRKPATRICK P,et al.Surface-engineered targeted PPI dendrimer for efficient intracellular and intratumoral siRNA delivery[J].J Control Release,2009,140(3):284 -293.
[9]TOMALIA D A.Birth of a new macromolecular architecture:dendrimers as quantized building blocks for nanoscale synthetic polymer chemistry[J].Prog Polym Sci,2005,30(3/4):294 -324.
[10]RUSS V,ELFBERG H,THOMA C,et al.Novel degradable oligoethylenimine acrylate ester-based pseudodendrimers forin vitroandin vivogene transfer[J].Gene Ther,2008,15(1):18 -29.
[11]CHEN L,TIAN H,CHEN J,et al.Multi-armed poly(L-glutamic acid)-graft-oligoethylenimine copolymers as efficient nonviral gene delivery vectors[J].J Gene Med,2010,12(1):64 -76.
[12]张静夏,周永言,黄爱东.双(三氯甲基)碳酸酯法合成L-聚谷氨酸苄酯[J].化学试剂,2004,26(2):105-106.

