缺血预处理通过抑制白三烯C4生成减轻大鼠肝缺血再灌注损伤*
洪芬芳, 张大雷, 涂桂林, 郭发先, 杨树龙△
(南昌大学1基础医学院生理教研室,2医学实验教学部,江西南昌330006)
肝脏缺血再灌注(ischemia-reperfusion,I/R)损伤是一个重大临床问题[1-2],在创伤、热损伤、血容量减少、内毒素休克、重建血管外科、肝移植和肝肿瘤切除外科手术中均存在I/R损伤[3]。白三烯(leukotrienes,LTs)是经 5-脂氧化酶(5-lipoxygenase,5-LO)途径产生的一类重要前炎症花生四烯酸类物质。LTs包括半胱氨酰白三烯 (cysteinyl leukotrienes,Cys-LTs;包括LTC4、LTD4和LTE4)以及白三烯 B4(LTB4)。Cys-LTs母体复合物LTC4由肝微粒体白三烯C4合酶(leukotriene C4 synthase,LTC4S)、谷胱甘肽S转移酶(microsomal glutathione S-transferase,mGST)2和mGST3催化LTA4和还原型谷胱甘肽(reduced glutathione,GSH)结合而成[4-5]。不断增加的证据提示肝脏I/R损伤病理机制中涉及LTs[3]。我们的结果[3]也显示肝脏I/R早期LTC4产物增加可能与膜脂质过氧化以及肝脏功能和形态组织损伤使LTC4代谢产物的排泄减少有关,而LTC4的积聚可能加重肝脏I/R损伤导致的业已存在的炎症损伤。缺血预处理(ischemic preconditioning,IP)是指肝脏短暂缺血事件能对随后的长时间I/R损伤产生保护并提高其再生能力[6]。一系列证据表明IP在肝移植等涉及I/R损伤过程中具有保护作用[7-8]。但存在一些矛盾的报道[9-10],且IP减轻肝脏I/R的机制尚未完全阐明[7]。至今未见有关IP减弱大鼠肝I/R损伤会否涉及LTC4生成的研究报道。
材料和方法
1 材料
雄性SD大鼠(250~300 g)18只,由南昌大学实验动物中心提供。LTC4和前列腺素B2(prostaglandin,PGB2)均购自Cayman。血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspertate aminotransferase,AST)活性和肝组织GSH检测试剂盒系南京建成公司产品。
2 方法
2.1 肝I/R损伤动物模型建立 成年雄性SD大鼠18只(平均每组6只),随机分为以下3组进行实验。(1)肝脏I/R组:按文献[3]所述采用 Pringle’s操作方法制作大鼠肝脏I/R损伤模型。戊巴比妥钠40 mg/kg ip麻醉后固定,无菌条件下使用内径0.9 mm聚乙烯管行颈静脉插管以便抽血和补液,腹部正中切开,用无创伤动脉夹夹闭供应肝左、中叶的动静脉60 min再灌流5 h制成I/R损伤模型;再灌注5 h处死动物,采血并速取肝左叶置液氮中冻存并转至-80℃冰箱储存以备检测,取0.5 g肝组织加4.5 mL生理盐水匀浆离心并保存-80℃待测,另取肝中叶组织制备肝微粒体和少量组织用甲醛缓冲液固定做免疫组化或苏木精和曙红染色进行组织病理学检查。(2)假手术对照组:只麻醉开腹,不阻断肝脏血流。(3)IP组:以短暂10 min缺血再灌注10 min作为IP处理,之后开始较长时间60 min缺血和5 h再灌注。
2.2 肝组织LTC4含量的检测 按文献[3],采用反相高效液相色谱法(reversed-phase high-performance liquid chromatography,RP-HPLC)测定各实验组肝组织中LTC4含量。
2.3 血清ALT、AST活性和肝组织GSH含量检查使用试剂盒,根据制造商的说明采用分光光度计测定血清ALT和AST的活性和肝组织中GSH含量。
2.4 组织学检查 在室温用10%甲醛固定肝脏组织,石蜡包埋,制作5 mm的切片,用苏木精伊红染色,光镜下检查肝脏组织结构损伤情况。
3 统计学处理
数据以均数 ±标准差(mean±SD)表示,应用SPSS 17.0软件分析。组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 IP对肝脏I/R期间LTC4含量的影响
与对照组相比,I/R组肝组织中LTC4含量显著增加(P<0.01),IP组未见明显变化(P>0.05);而与I/R组相比,IP组肝脏LTC4水平显著降低(P<0.05),见图1。
2 IP对大鼠肝I/R损伤期间血清ALT和AST活性以及肝组织GSH含量的影响
如表1所示,I/R和IP组血清ALT和AST值均高于对照组(P<0.05或P<0.01)。与I/R组相比,IP显著降低血清ALT和AST水平(P<0.01或P<0.05)。I/R组中肝组织GSH含量低于对照组(P<0.05),与I/R组相比,IP处理增加肝组织GSH含量(P <0.05)。
3 病理检查结果
再灌注5 h后肝脏可见明显结构损伤和局灶性坏死,IP组仅有较小结构损伤,对照组显示正常的肝组织结构,见图2。
讨 论
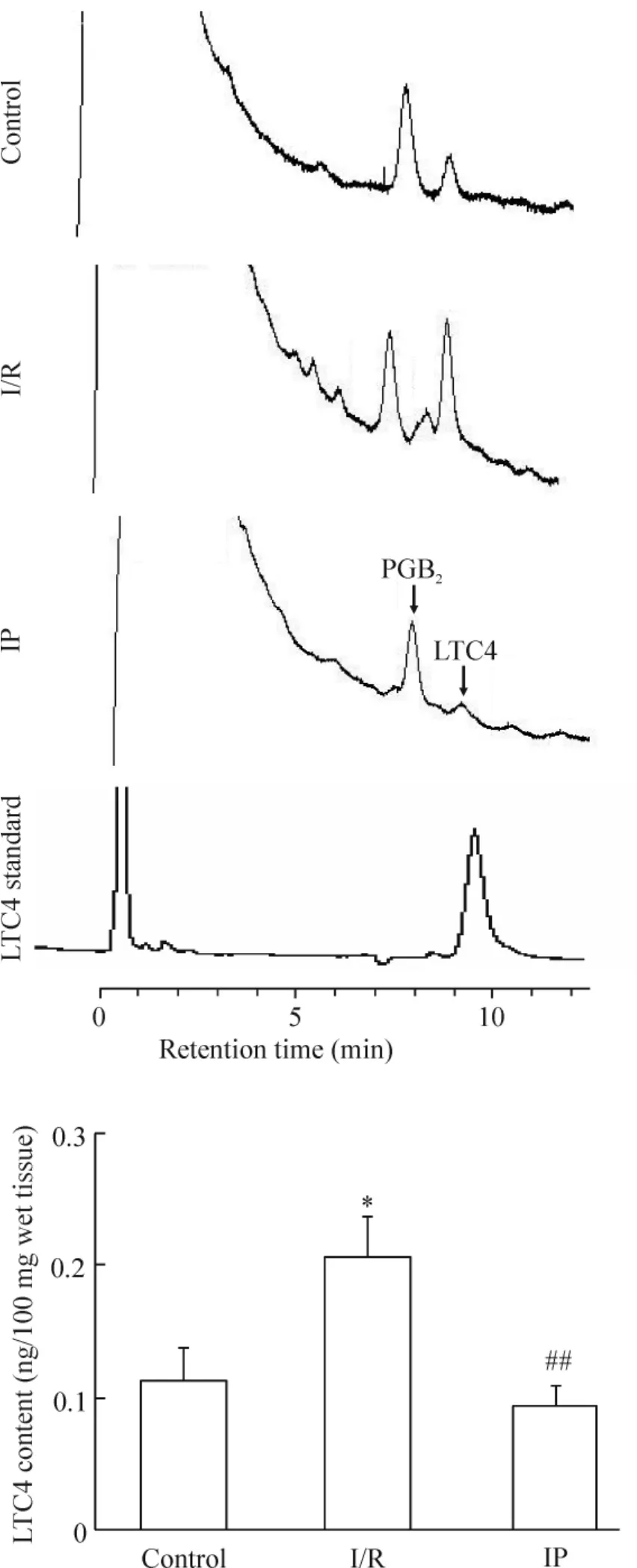
Figure 1.HPLC chromatograms demonstrating LTC4 content in rat liver tissues.Mean±SD.n=6.*P<0.05 vs control;##P<0.01 vs I/R.图1 各组大鼠肝组织LTC4含量的变化
I/R损伤被认为参与了肝切除术或移植后肝功能衰竭的发病机制,可能引发全身炎症反应,并导致多器官功能障碍综合征。大量的实验和临床研究表明,IP在防止肝I/R损伤发展方面有较好的作用。但IP减轻肝I/R损伤的确切机制仍未完全阐明。进一步了解IP保护机制,将促进其在肝移植等治疗方面的应用,加速I/R肝损伤替代治疗。
LTs是作用广泛的炎症介质,参与了多种肝功能和肝脏疾病的生理和免疫反应。不断增加的证据表明 LTs涉及肝 I/R 损伤的病理生理机制[3,11-12],尚缺少肝I/R损伤期间IP关联LTs的报道,包括IP对LTC4S蛋白表达、LTC4合成酶的活性,以及LTC4生成的影响。本实验中I/R大鼠肝组织中LTC4生成增加,与以前的报道一致[3,11],此外,我们首先发现,IP处理显著减少I/R损伤肝脏LTC4生成,可能是IP防治肝脏I/R损伤的原因之一。

表1 对照组、I/R和IP组大鼠血清ALT和AST活性以及肝组织GSH含量的变化Table 1.Changes of serum ALT and AST activity and liver GSH level in rats of control,I/R and IP groups(mean±SD.n=6)

Figure 2.Rat liver histological changes in control(A),I/R(B)and IP(C)groups after 5 h of reperfusion following 60 min of hepatic ischemia(HE staining,×200).图2 对照组、I/R和IP组大鼠肝I/R损伤早期组织形态学的变化
已知肝脏是参与系统起源的花生四烯酸产物降解和消除的一个主要器官[13],Cys-LTs和LTB4均在肝脏经ω-氧化和β-氧化降解,此降解途径在肝硬化和肝肾综合征时发生了改变[11,14]。研究表明[3,15],在病理条件下LTs生成增加,可参与对肝细胞直接损伤。本研究中,尽管与对照组相比,IP处理增加了血清ALT和AST的活性,但这些值在IP组均明显低于I/R组。同时,I/R损伤大鼠存在肝结构损伤和一些坏死,而IP减弱了I/R造成的肝损伤。此外,I/R降低而IP增加了肝组织GSH水平。这些结果显示,IP处理可以明显改善再灌注早期肝功能和结构,并抑制氧化应激反应,表明IP可能部分通过改善I/R损伤大鼠肝脏分泌排泄LTC4的功能,减少LTC4堆积,保护I/R损伤的肝脏。
总之,我们的研究结果表明,在大鼠肝缺血60 min再灌注5 h后,IP减少了肝LTC4生成,同时伴随有肝酶释放减少和肝组织结构改善,以及氧化应激反应的降低,表明IP降低LTC4生成可能涉及其在肝脏I/R期间的保护作用机制。本研究将进一步加深对IP诱导器官耐受性的理解,并推动其在肝移植治疗中的应用。
[1] 葛 缅,池信锦,刘德昭,等.大鼠自体原位肝移植模型中肠道羟自由基、丙二醛和总抗氧化能力的变化[J].中国病理生理杂志,2012,28(4):723-726.
[2] 李 伟,陆晓华,赵 雪,等.核黄素预处理减轻大鼠肝缺血再灌注损伤[J].中国病理生理杂志,2012,28(7):1314-1318.
[3] Yang SL,Huang X,Chen HF,et al.Increased leukotriene C4 synthesis accompanied enhanced leukotriene C4 synthase expression and activities of ischemia-reperfusioninjured liver in rats[J].J Surg Res,2007,140(1):36-44.
[4] Schröder O,Sjöström M,Qiu H,et al.Microsomal glutathione S-transferases:selective up-regulation of leukotriene C4 synthase during lipopolysaccharide-induced pyresis[J].Cell Mol Life Sci,2005,62(1):87-94.
[5] Yang SL,Lou YJ.Sodium nitroprusside decreased leukotriene C4 generation by inhibiting leukotriene C4 synthase expression and activity in hepatic ischemia-reperfusion injured rats[J].Biochem Pharmacol,2007,73(5):724-735.
[6] Ambros JT,Herrero-Fresneda I,Borau OG,et al.Ischemic preconditioning in solid organ transplantation:from experimental to clinics[J].Transpl Int,2007,20(3):219-229.
[7] Yan S,Jin LM,Liu YX,et al.Outcomes and mechanisms of ischemic preconditioning in liver transplantation[J].Hepatobil Pancreat Dis Int,2010,9(4):346-354.
[8] 汪根树,陈规划,陆敏强,等.缺血预处理对大鼠小体积供肝一氧化氮合酶的影响及意义[J].中国病理生理杂志,2006,22(11):2102-2104.
[9] Koneru B,Shareef A,Dikdan G,et al.The ischemic preconditioning paradox in deceased donor liver transplantation:evidence from a prospective randomized single blind clinical trial[J].Am J Transplant,2007,7(12):2788-2796.
[10] de Rougemont O,Lehmann K,Clavien PA.Preconditioning,organ preservation,and postconditioning to prevent ischemia-reperfusion injury to the liver[J].Liver Transpl,2009,15(10):1172-1182.
[11] Takamatsu Y,Shimada K,Chijiiwa K,et al.Role of leukotrienes on hepatic ischemia/reperfusion injury in rats[J].J Surg Res,2004,119(1):14-20.
[12] Yang SL,Chen LJ,Kong Y,et al.Sodium nitroprusside regulates mRNA expressions of LTC4 synthesis enzymes in hepatic ischemia/reperfusion injury rats via NF-κB signaling pathway[J].Pharmacology,2007,80(1):11-20.
[13] Quiroga J,Prieto J.Liver cytoprotection by prostaglandins[J].Pharmacol Ther,1993,58(1):67-91.
[14] Keppler D,Jedlitschky G,Leier I.Transport and metabolism of leukotrienes[J].Adv Prostaglandin Thromboxane Leukot Res,1994,22(7):83-89.
[15] Makogon NV,Korneitchuk AN,Lushnikova IV,et al.Effects of exogenous leukotrienes B4 and C4 on the viability of cultured rat hepatocytes[J].Acta Physiol Pharmacol Bulg,2000,25(3-4):87-91.

