Apelin-13对大鼠缺血心室肌细胞瞬时钠电流的影响
王 琳, 聂 晶, 滕天明, 李宏仕, 于雪芳, 马 骏△
(1天津医科大学,天津300070;2天津医科大学总医院,天津300052)
Apelin是1998年由 Tatemoto等[1]通过反向药理学方法从牛胃的分泌物中发现的含77个氨基酸序列的多肽类物质,是孤儿G蛋白偶联受体APJ的内源性配体。APJ的结构与血管紧张素Ⅱ(AngⅡ)1型受体(angiotensinⅡ type 1 receptor,AT1receptor)非常相似(54%的跨膜区域结构相同),但并不与AngⅡ结合[2]。Apelin/APJ系统广泛分布于心脏、肺脏、肾脏、中枢神经系统、脂肪组织等。近年发现apelin/APJ系统参与高血压、心衰、肥胖、糖耐量减低和2型糖尿病、HIV感染、胃溃疡等疾病的发病过程。在心血管系统,apelin通过内分泌、旁分泌和自分泌等形式发挥正性肌力作用、扩张血管、抑制心脏重构、调节血压及体液平衡等作用。Apelin基因位于人X染色体的q25~26.1,编码的前体蛋白由77个氨基酸组成,在不同的组织中被加工生成分别含12、13、17、36 个氨基酸的多肽,其中 apelin-36 和apelin-13较为常见[1]。目前研究表明apelin的正性肌力作用是通过激活磷脂酶C(phospholipase C,PLC)、蛋白激酶C(protein kinase C,PKC)和内质膜钠氢交换体(Na+/H+exchanger,NHE)、钠钙交换体(Na+/Ca2+exchanger,NCX)实现的,心室肌细胞瞬时钠电流(INa)的幅度和激活情况调节细胞内Na+浓度,进而通过NCX增加细胞内钙离子发挥正性肌力作用[3]。因此,apelin对INa的调节对其正性肌力作用至关重要。据Chamberland等[4]报道,100 nmol/L的apelin-13和apelin-17均能明显增加狗正常左室心肌细胞INa峰电流幅度,提示apelin通过增加INa影响心室肌细胞的兴奋性和传导特性。已有研究的方向主要是集中于apelin对于缺血-再灌注心肌细胞的保护作用、apelin的正性肌力作用及其在心力衰竭、高血压和动脉粥样硬化等疾病的发生发展中的可能作用,而apelin对缺血诱发的室性心律失常有无作用、对缺血心肌细胞有无正性肌力作用及其对缺血心室肌细胞电生理特性和相应离子通道蛋白表达的影响尚不明了,且相关研究报道也较少。本研究旨在探讨apelin-13对缺血大鼠心室肌细胞INa的影响,以期揭示其对缺血心室肌细胞电生理特性的作用。
材料和方法
1 材料
健康雄性Wistar大鼠,体重200~250 g,由中国医学科学院放射医学研究所实验动物中心提供。Apelin-13由ANASpec提供,Na+通道蛋白V型α亚单位(sodium channel protein,type V,alpha subunit,SCN5A)抗体购自Santa Cruz,余为市售分析提纯试剂。
2 试剂配制
2.1 台氏液 NaCl 136 mmol/L,KCl 5.4 mmol/L,MgCl21.0 mmol/L,CaCl21.8 mmol/L,NaH2PO40.33 mmol/L,HEPES 10 mmol/L,glucose 10 mmol/L,用 2 mol/L NaOH滴定pH至7.40。
2.2 无钙台氏液 即台氏液中去除CaCl2。
2.3 KB 液 Glutamic acid 70 mmol/L,taurine 15 mmol/L,KCl 30 mmol/L,KH2PO410 mmol/L,MgCl20.5 mmol/L,EGTA 0.5 mmol/L,HEPES 10 mmol/L,glucose 10 mmol/L,用 5 mol/L KOH滴定 pH至7.35。
2.4 酶解液 胶原酶Ⅱ(0.16 g/L)和小牛血清白蛋白0.16 g/L加入50 mL无钙台氏液中。
2.5 INa记录的电极内液 CsCl 20 mmol/L,CsF 110 mmol/L,NaCl 5 mmol/L,EGTA 10 mmol/L,HEPES 10 mmol/L,Mg-ATP 5 mmol/L,用 3 mol/L CsOH 滴定pH至7.20。
2.6 INa记录的电极外液 氯化胆碱100 mmol/L,NaCl 50 mmol/L,MgCl22 mmol/L,4-AP 5 mmol/L,HEPES 10 mmol/L,glucose 10 mmol/L,CsCl 20 mmol/L,CdCl20.3 mmol/L,用 5 mol/L NaOH 滴定pH至7.35。
2.7 K-H 液 NaCl 118 mmol/L,KCl 4.7 mmol/L,MgSO41.2 mmol/L,KH2PO41.2 mmol/L,NaHCO325 mmol/L,glucose 11 mmol/L,CaCl21.4 mg(1 000 mL)。
2.8 缺血K-H液 将K-H液中glucose替换为乳酸钠,不通氧,NaOH调pH至7.00。
3 大鼠缺血心室肌细胞模型的建立及动物处理
40只雄性Wistar大鼠随机分为正常对照组(N组,n=10)、正常加 apelin-13组(N+A 组,n=10)、缺血组(I组,n=10)、缺血加apelin-13组(I+A组,n=10),4组动物均采用Langendorff灌流系统酶解法分离心室肌细胞,N组和N+A组动物心室肌细胞采用正常细胞外液,N+A组细胞外液中加入apelin-13;I组和I+A组采用缺血细胞外液,I+A组细胞外液中加入apelin-13,缺血20 min,建立心肌细胞水平的缺血模型,采用Multiclamp 700B膜片钳系统,采用全细胞记录模式,记录各组INa,数据收集和分析采用Pclamp 10.1(Axon Instrument),电容补偿75%。电流-电压(I-V)曲线的制作:以各个测试电压为横坐标,对应的电流密度为纵坐标,作出电流-电压关系曲线,即I-V曲线。激活动力学曲线的制作:以电流的相对值(I/Imax)对条件脉冲电压作图,得出激活动力学曲线。按 Boltzmann方程 I/Imax=1/{1+exp[(Vm-V1/2)/k]}进行曲线拟合。
另取雄性Wistar大鼠16只分为对照组(N组,n=4)、对照加 apelin组(N+A组,n=4)、缺血组(I组,n=4)、缺血加 apelin组(I+A 组,n=4),建立Langendorff心脏离体灌流模型,N组和N+A组分别灌流正常K-H液和加apelin-13的K-H液,I组和I+A组分别灌流缺血K-H液和apelin-13加缺血K-H液,缺血20 min,经左房插入水囊连接压力监护,持续记录心电图和心腔内压力,采集左室发展压(left ventricle developed pressure,LVDP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室压力变化最大值(maximum change in left ventricular pressure over time,dp/dtmax)和最小值(minimum change in left ventricular pressure over time,dp/dtmin),按Demiryürek等[5]文献计算各组室性心律失常发生率及评分,灌注结束后留取左心室心肌标本,保持于液氮中,RT-PCR和Western blotting检测SCN5A表达水平。
4 统计学处理
数据以均数±标准差(mean±SD)表示。采用SPSS 11.5统计软件分析。多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 Apelin-13对INa的影响
Apelin-13(100 nmol/L)在N+A组和I+A组均能增加INa幅度,见图1。I-V曲线分析显示N+A组比N组INa幅度增大32%[(-86±13)pA/pF],I+A组比I组INa幅度增大18%[(-52±15)pA/pF],见图2、3;然而I-V曲线分析apelin-13并未改变最大传导速度,N、N+A、I、I+A 组分别为(3.2 ±0.2)pS/pF、(3.1 ±0.3)pS/pF、(2.9 ±0.1)pS/pF、(2.8 ±0.4)pS/pF,组间差异无统计学意义(P>0.05),提示apelin-13可能是通过改变Na+通道门控特性而非激活更多的Na+通道而增加INa峰值。各组的半激活电压(V1/2)分别为(-21.9±0.6)mV、(-28.7±0.3)mV、(-30.5±0.7)mV 和(-36.8±0.2)mV;Boltzmann曲线各组斜率分别为5.6±0.3、5.1±0.4、4.3±0.3和4.9±0.6,组间差异无统计学意义(P>0.05);V1/2值N+A组比N组改变(-5.9±0.8)mV,I+A 组V1/2比 I组改变(-7.7±1.3)mV,差异有统计学意义(P<0.05),提示apelin-13使正常和缺血组心室肌细胞Na+通道更容易开放。
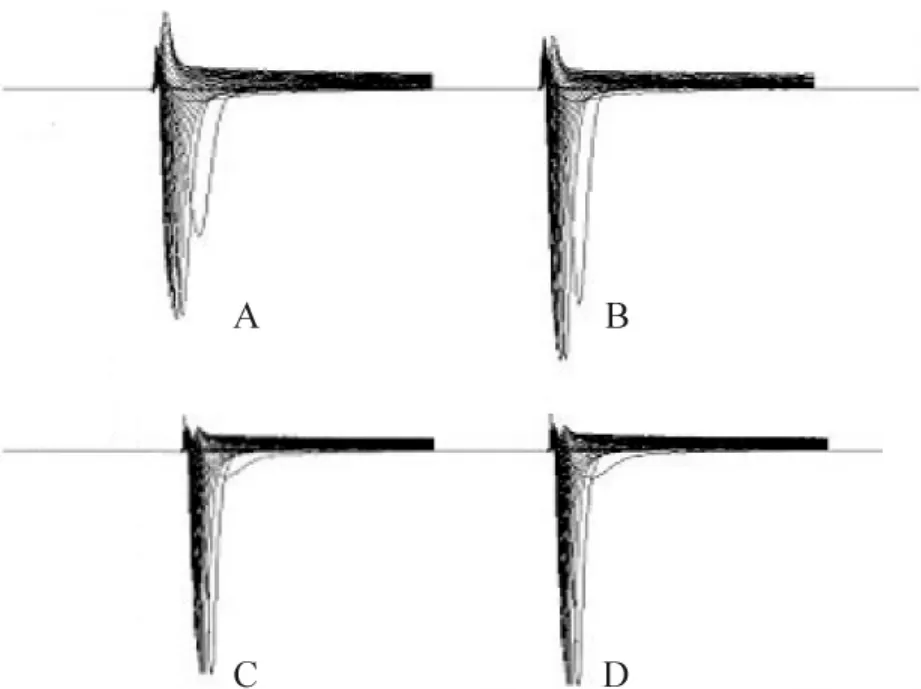
Figure 1.Effect of apelin-13 on INain normal and ischemic ventricular myocytes.A:N group;B:N+A group;C:I group;D:I+A group.Apelin-13 increased INadensity in both N+A group and I+A group.图1 Apelin-13对正常和缺血心室肌细胞INa的影响
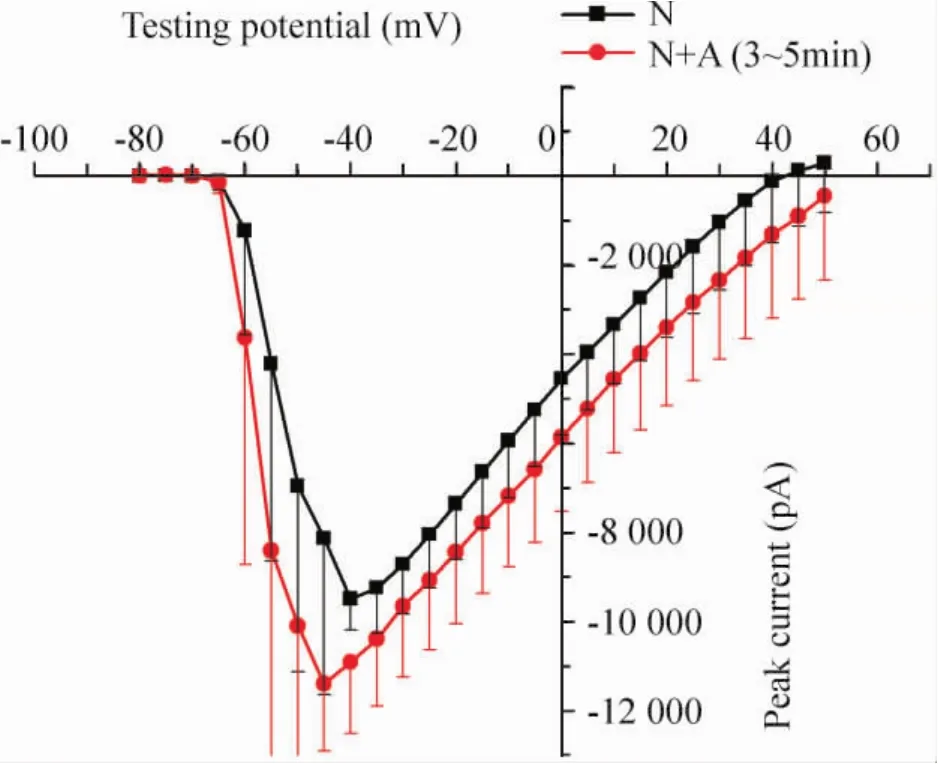
Figure 2.I-V curves of N group and N+A group.图2 正常心室肌细胞的I-V曲线
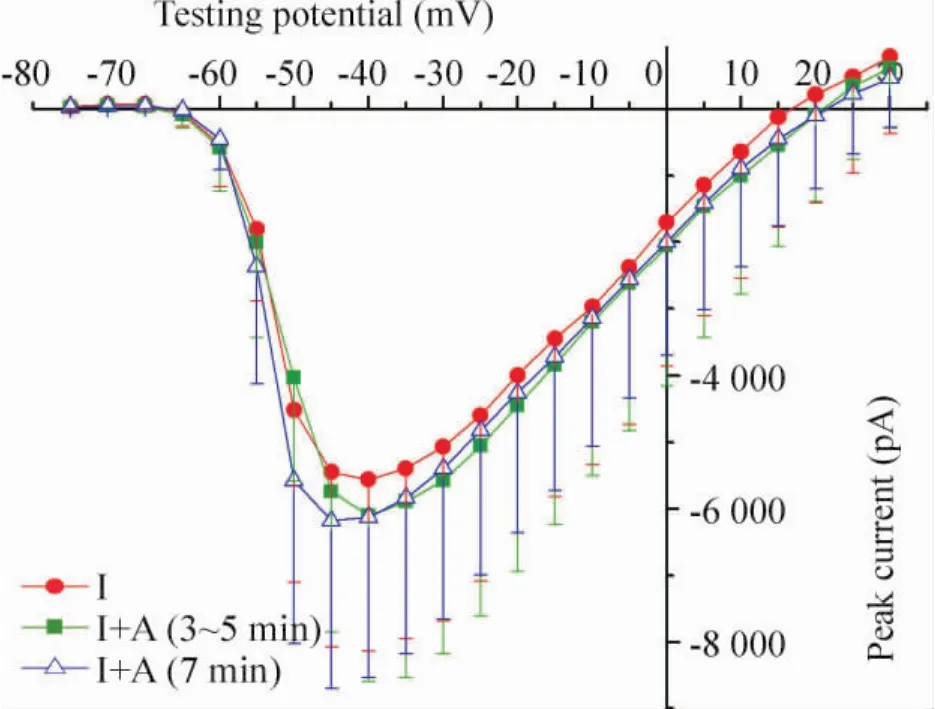
Figure 3.I-V curves of I group and I+A group.图3 缺血心室肌细胞的I-V曲线
2 Apelin-13对室性心律失常的影响
各组室性心律失常(ventricular arrhythmia,VA)开始时间、室性心动过速(ventricular tachycardia,VT)持续时间、心室颤动(ventricular fibrillation,VF)持续时间及心律失常评分(arrhythmia score,AS)情况见表1。N+A组与N组比较、I+A组与I组比较差异均无统计学意义(P>0.05)。
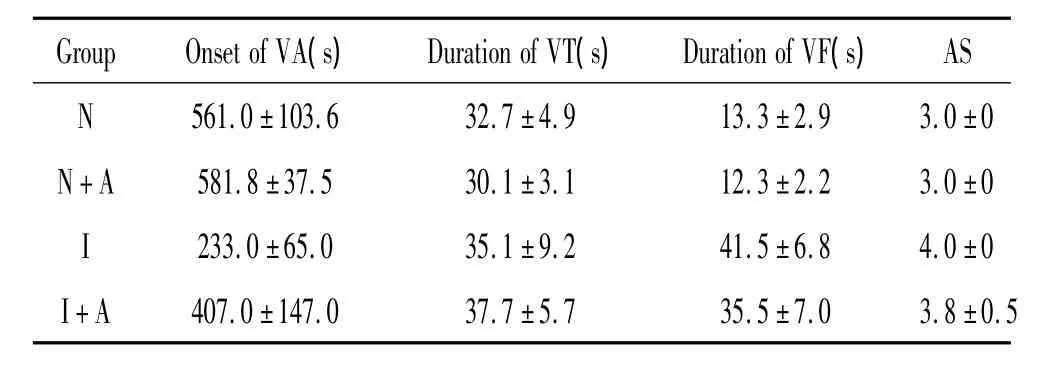
表1 各组灌流过程中室性心律失常情况Table 1.Ventricular arrhythmias during perfusion in the four groups(mean±SD.n=10)
3 Apelin-13对左室功能的影响
各组 LVEDP、LVDP、dp/dtmax和 dp/dtmin指标比较,N+A组LVEDP低于N组,LVDP、dp/dtmax和 dp/dtmin高于N组;I+A组LVEDP低于I组、LVDP高于I组,dp/dtmax、dp/dtmin高于 I组,见表 2。
4 Apelin-13对SCN5A表达的影响
SCN5A抗体特异性识别和结合大鼠心室肌细胞Na+通道蛋白,通过Western blotting检验呈现出分子质量约260 kD的蛋白条带。以β-肌动蛋白(β-actin)作为内参照,4组β-actin表达水平差异无统计学意义(n=4,P>0.05),4组SCN5A的表达灰度值分别为28.8±3.6、29.4±4.1、30.1±2.9和31.3±3.8,组间差异无统计学意义(n=4,P>0.05),见图4。这提示apelin-13不影响Na+通道蛋白的表达。
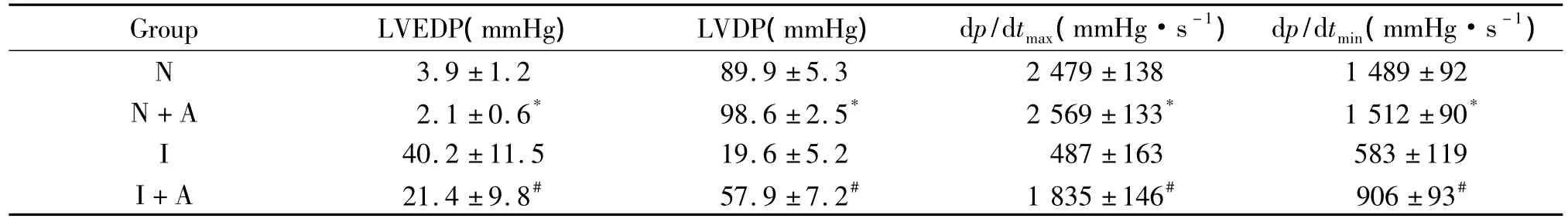
表2 各组灌流过程中心脏功能指标Table 2.The cardiac function parameters during perfusion(mean±SD.n=4)
讨 论
钠通道活性与动作电位的形成(0期)有关,是心肌细胞去极化主要的跨膜离子流,影响心肌细胞的兴奋和传导[6]。Apelin是目前发现最强的心脏正性肌力物质之一[7]。离体大鼠心脏灌注apelin(0.01~10 nmol/L)使心肌收缩力增强,诱导剂量依赖性的正性变力作用,显著增高dp/dtmax;其正性肌力是通过结合并活化其自身特异性受体而发挥作用的,并不依赖于内源性血管紧张素Ⅱ、内皮素、儿茶酚胺和NO的释放[8]。Apelin对健康大鼠和心肌梗死导致心力衰竭大鼠的心脏均有正性肌力作用,给大鼠持续静脉输入Apelin约20 min,会发现左室最大压力、dp/dtmax和每搏输出量均显著增加,但不增加心率和左室舒张末期容积[9],在结扎左前降支冠状动脉致心肌梗死后6周心力衰竭大鼠,持续静脉注射apelin也得到了同样的结果。Apelin-13是具有活性的最短氨基酸序列,能更有效地占领APJ,其发挥的细胞学效应也更强大,因此本研究中选择apelin-13观察其对大鼠缺血心肌细胞INa的影响。本研究中apelin-13对正常和缺血心室肌均有正性肌力作用,N+A和I+A组的左室收缩功能较N组和I组均有改善。
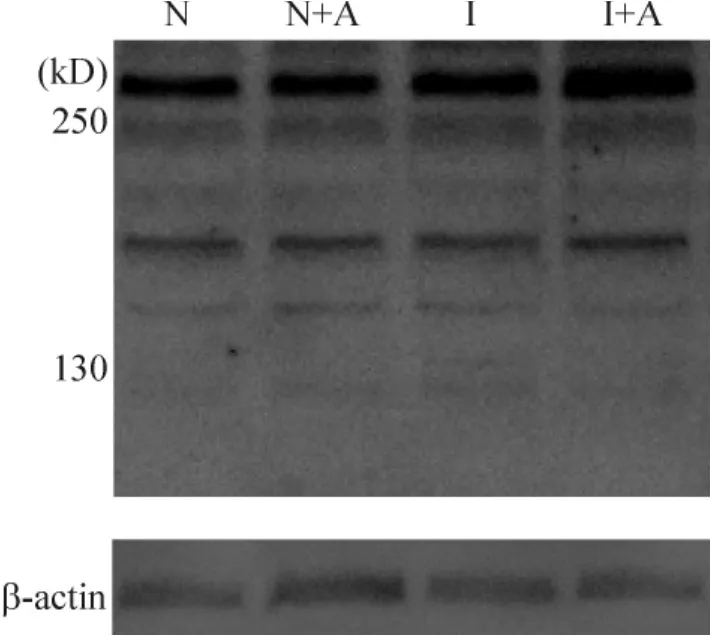
Figure 4.The effect of apelin-13 on the expression level of SCN5A detected by Western blotting.图4 Western blotting检验Apelin-13对各组SCN5A表达的影响
文献报道 apelin 对钾、钙电流(Ito、IK,sus、ICa)没有影响,其通过PLC和PKC途径增加心肌收缩力,它的正性肌力作用与NHE和NCX激活有关[10]。但是否apelin直接增加细胞内钙浓度或者提高肌原纤维对钙离子敏感性尚存争议。本研究发现apelin-13增加大鼠缺血心室肌细胞的INa幅度达18%,改变INa的半激活电压达(-7.7±1.3)mV,I-V曲线的最大传导速度并未改变。Boltzmann曲线各组斜率4组间差异无统计学意义;V1/2值N+A组和I+A组分别比N组和I组变得更负,提示apelin-13改变INa离子通道的门控特性,使正常和缺血组心室肌细胞Na+通道更容易开放。
因此,INa的增加可能与激活电压的驱动力增加以及膜通道动力学的改变有关,可能与Na+通道蛋白表达和被激活数量无关。
Apelin能提高心肌细胞自发性激动的放电频率和传导速度[3],本研究发现apelin介导的心肌细胞兴奋性增加与INa的激活有关,apelin-13使正常和缺血组心室肌细胞Na+通道更容易开放,但各组间室性心律失常发生情况无差别,提示apelin-13可能不具备抗心律失常作用。Ellinor等[11]研究发现,73例孤立性房颤患者的血浆apelin水平显著下降,这提示apelin水平降低可能参与了此类心律失常的发病机制。但其水平改变究竟是疾病发生和发展的结果,还是发病促发因素,目前尚不明确。
本研究局限性在于样本例数偏少,未研究在体大鼠缺血心脏模型应用apelin-13后心律失常、左室收缩功能情况及INa等细胞电生理特性方面的变化。
[1] Tatemoto K,Hosoya M,Habata Y,et al.Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J].Biochem Biophys Res Commun,1998,251(2):471-476.
[2] O'Dowd BF,Heiber M,Chan A,et al.A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11[J].Gene,1993,136(1-2):355-360.
[3] Farkasfalvi K,Stagg MA,Coppen SR,et al.Direct effects of apelin on cardiomyocyte contractility and electrophysiology[J].Biochem Biophys Res Commun,2007,357(4):889-895.
[4] Chamberland C,Barajas-Martinez H,Haufe V,et al.Modulation of canine cardiac sodium current by Apelin[J].J Mol Cell Cardiol,2010,48(4):694-701.
[5] Demiryürek AT,Yildiz G,Esiyok S,et al.Protective effects of poly(ADP-ribose)synthase inhibitors on digoxin-induced cardiotoxicity in guinea-pig isolated hearts[J].Pharmacol Res,2002,45(3):189-194.
[6] 巫少荣,李自成,余 健,等.大蒜素对心室肌细胞膜钠通道电流的影响[J].中国病理生理杂志,2011,27(4):658-661.
[7] 黄帧桧,张 培,杨 帆,等.葛根素对肾性高血压大鼠apelin-12、AngⅡ及NO含量与血压的影响[J].中国病理生理杂志,2011,27(12):2323-2327.
[8] Szokodi I,Tavi P,Földes G,et al.Apelin,the novel endogenous ligand of the orphan receptor APJ,regulates cardiac contractility[J].Circ Res,2002,91(5):434-440.
[9] Berry MF,Pirolli TJ,Jayasankar V,et al.Apelin has in vivo inotropic effects on normal and failing hearts[J].Circulation,2004,110(11 Suppl 1):Ⅱ187-Ⅱ193.
[10] Wang C,Du JF,Wu F,et al.Apelin decreases the SR Ca2+content but enhances the amplitude of[Ca2+]itransient and contractions during twitches in isolated rat cardiac myocytes[J].Am J Physiol Heart Circ Physiol,2008,294(6):H2540-H2546.
[11] Ellinor PT,Low AF,Macrae CA.Reduced apelin levels in lone atrial fibrillation[J].Eur Heart J,2006,27(2):222-226.

