人表皮生长因子受体显性负性突变体诱导胃癌细胞发生G0/G1期阻滞*
廖 刚, 王子卫△, 张 能, 董浦江, 汤为学
(重庆医科大学1附属第一医院胃肠外科,3附属第一医院实验研究中心,4基础医学院病理生理学教研室,重庆400016;2云南省第一人民医院普通外科,云南昆明650032)
人表皮生长因子受体(epidermal growth factor receptor,EGFR)为酪氨酸蛋白激酶型受体,由胞外区、跨膜区和胞内区三部分构成,与配体结合后,相互之间形成同源二聚体,也可与其它的酪氨酸激酶受体形成异源二聚体,导致胞内区的酪氨酸激酶区的激活,最终引起一系列相关基因活化,在肿瘤发生发展中扮演着重要角色[1-3]。缺失胞内区的EGFR为其显性负性突变体(dominant negative EGFR,DNEGFR),可以阻断EGFR信号通路。肿瘤是一类细胞周期相关疾病,胃癌也不例外。针对肿瘤细胞周期进行调控,近年来一直是肿瘤生物治疗的重要研究方向。DNEGFR是否对人胃癌细胞的周期有调控作用?以及具体分子机制是什么?目前未见相关报道。
材料和方法
1 细胞
人胃癌细胞株SGC-7901及NCI-N87购自中国科学院细胞库。pEGFP-N1质粒稳定转染的SGC-7901及NCI-N87细胞,稳定表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP);pEGFPN1-DNEGFR质粒稳定转染的SGC-7901及NCIN87细胞,稳定表达DNEGFR;均由我们前期实验筛选成功保存[4]。
2 主要试剂、耗材及仪器
PBS磷酸盐缓冲液(0.01 mol/L,pH 7.2 ~7.4)购自北京中杉金桥生物技术有限公司。无水乙醇购自重庆川东化工(集团)有限公司。PI购自Sigma-Aldrich。RPMI-1640培养基粉末、胰酶和G418购自Invitrogen。Ser9位点磷酸化糖原合成激酶3β[phosphorylated glycogen synthase kinase 3 beta at Ser9,p-GSK-3β(Ser9)]兔单克隆抗体购自 Cell Signaling Technology。GAPDH(FL-335)抗体、p21(C-19)抗体、cyclin D1(A-12)抗体、周期素依赖性蛋白激酶2(cyclin dependent kinase 2,CDK2)(H-298)抗体和p27(C-19)抗体购自Santa Cruz。BCA protein assay kit、Pierce ECL Western blotting substrate 和 stripping buffer购自 Thermo Fisher Scientific。RIPA裂解液(强)、SDS-PAGE凝胶配制试剂盒、PMSF(100 mmol/L)、彩色预染蛋白质分子量标准和DS-PAGE蛋白上样缓冲液(5×)购自江苏省碧云天生物技术研究所。PVDF膜购自Bio-Rad。
Forma 310系列直热式 CO2培养箱为Thermo Fisher Scientific产品。SW-CJ系列医用型洁净工作台为苏州安泰空气技术有限公司产品。Gel Doc XR凝胶成像系统、电泳仪和680型全自动酶标仪为Bio-Rad产品。流式细胞仪为BD Biosciences产品。
3 方法
3.1 实验分组 实验分为如下6组:(1)SGC-7901细胞空白对照组(即SGC-7901细胞未转染组,US组);(2)SGC-7901细胞pEGFP-N1质粒转染组(ES组);(3)SGC-7901细胞pEGFPN1-DNEGFR质粒转染组(DS组);(4)NCI-N87细胞空白对照组(即NCI-N87细胞未转染组,UN组);(5)NCI-N87细胞pEGFP-N1质粒转染组(EN组);(6)NCI-N87细胞pEGFPN1-DNEGFR质粒转染组(DN组)。
3.2 细胞培养 未转染细胞常规培养于含10%的胎牛血清的RPMI-1640培养液,在37℃、5%CO2及相应湿度条件的CO2孵箱中培养,定期观察细胞生长情况,在对数生长期用0.25%的胰酶消化,进行传代培养。转染的 SGC-7901细胞,采用 150 mg/L G418终浓度的完全培养基维持培养;转染的NCIN87细胞,采用250 mg/L G418终浓度的完全培养基维持培养。
3.3 细胞周期检测 细胞周期检测根据文献[5-6]操作并作一些改进。取无菌Eppendorf管,预装1 mL 70%乙醇,放入4℃冰箱预冷。用胰酶分别消化收获处于对数生长期的6组单层胃癌细胞,1 000 r/min离心5 min弃上清,用预冷PBS洗细胞3次。第3次洗细胞离心弃PBS时,不要完全吸弃PBS,待附在离心管壁的PBS回流到管底后,用微量移液器轻轻吹打使离心到管底的细胞成细胞悬液。将细胞悬液加入预冷的70%乙醇,4℃固定过夜。1 000 r/min离心5 min弃70% 乙醇,PBS洗细胞3次。加入0.5 mL PI染液重悬细胞,并放在37℃水浴中孵育30 min。设定流式细胞仪参数,进行细胞周期检测。细胞周期分布采用Modifit-3软件(Verity Software House)计算每组细胞重复实验3次。
3.4 Western blotting检测 Western blotting实验方法主要根据文献[7]并作以下改进,cyclin D1和p27抗体稀释比例为1∶100,CDK2、p21和 GAPDH抗体稀释比例为1∶200,p-GSK-3β(Ser9)抗体稀释比例为1∶1 200,使用Gel Doc XR凝胶成像系统采集图像。目的蛋白相对表达水平=目的蛋白条带灰度值/内参照蛋白条带灰度值,实验重复3次。
4 统计学处理
数据以均数±标准差(mean±SD)表示。组间差异比较采用单因素方差分析(One-way ANOVA),如果差异有统计学意义则进一步采用LSD-t检验进行两两比较,应用SPSS 17.0 for Windows软件处理,以P<0.05为差异有统计学意义。
结 果
1 细胞生长情况
各组人胃癌细胞生长状态均良好,但是生长速度有一定差异。相对于US组及ES组,DS组细胞生长速度明显要慢些。同样,相对于UN组及EN组,DN组细胞生长速度明显要慢些。
2 DNEGFR导致G0/G1期阻滞
对于SGC-7901细胞,US组及ES组G0/G1期分别为(50.03±2.01)%和(49.61±0.49)%,二者没有显著差异,DS组则上升到(70.88±0.85)%(P<0.05);US组及ES组S期分别为(43.63±1.26)%和(43.63±0.64)%,二者没有显著差异,DS组则降低到(21.58±1.40)%(P<0.05)。对于NCI-N87细胞,UN组及 EN组 G0/G1期分别为(47.90±2.52)%和(48.79±4.12)%,二者没有显著差异,DN组则上升到(69.27±4.52)%(P<0.05);UN组及EN组S期分别为(41.77±3.08)%和(42.76±3.38)%,二者没有显著差异,DN组则降低到(21.88±2.40)%(P<0.05)。另外,在DS及DN组中,流式细胞周期测定图中G0/G1期峰前出现了亚二倍体峰,表明DNEGFR-EGFP还能够诱导胃癌细胞凋亡,见图1。
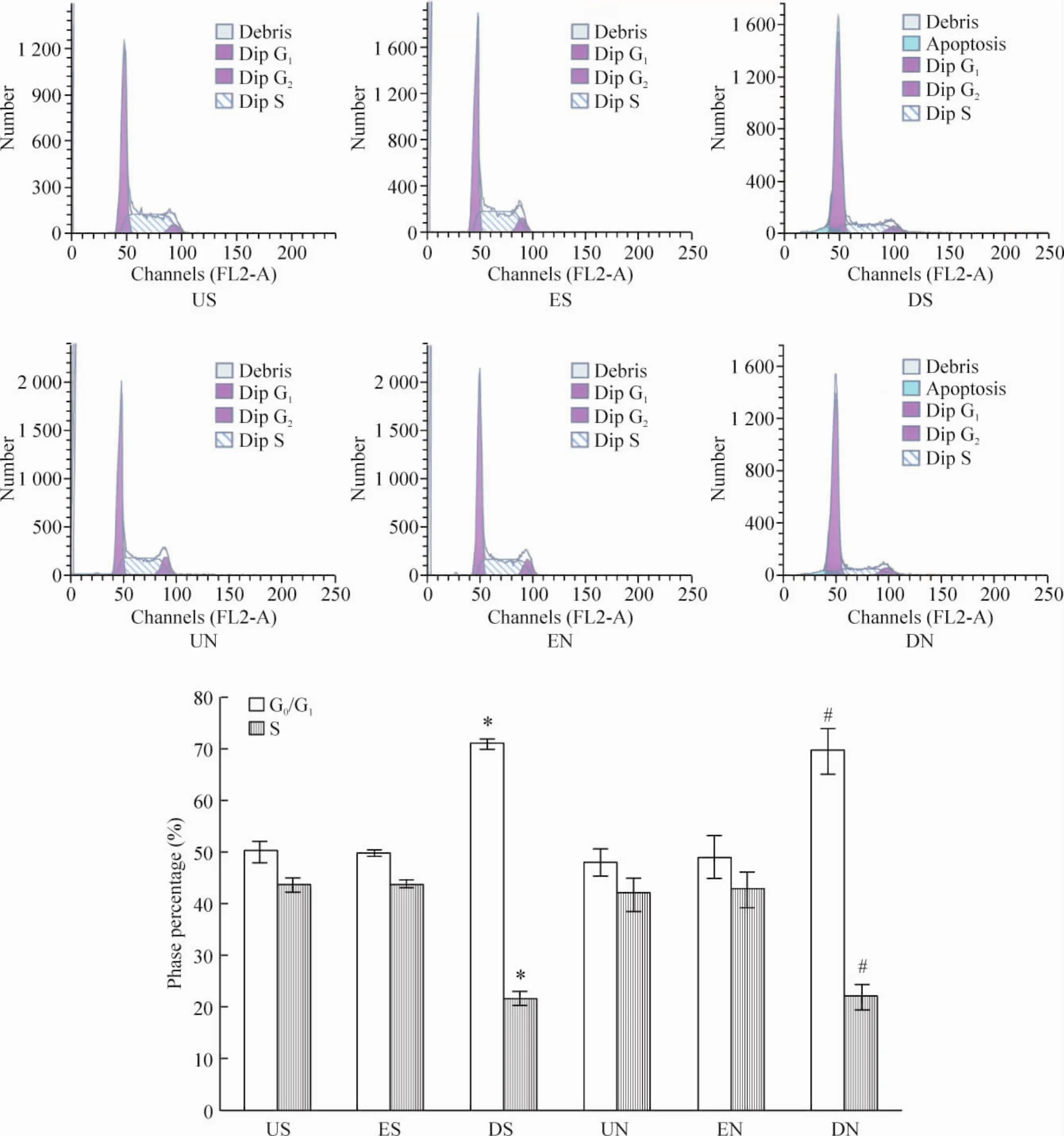
Figure 1.Cell cycle assay of gastric cancer cells.Mean ±SD.n=3.*P <0.05 vs US or ES;#P <0.05 vs UN or EN.图1 胃癌细胞周期分析
3 DNEGFR对细胞周期相关蛋白水平的调控作用
US组及ES组SGC-7901细胞活性CDK2、cyclin D1、p-GSK-3β(Ser9)、p21 和 p27 蛋白水平没有显著差异;与US组及ES组比较,DS组CDK2、cyclin D1和 p-GSK-3β(Ser9)蛋白水平降低(P <0.05),p21、p27蛋白水平则升高(P<0.05)。UN组及 EN组NCI-N87 细 胞 活 性 CDK2、cyclin D1、p-GSK-3β(Ser9)、p21和p27蛋白水平没有显著差异;与UN组及EN组比较,DN组CDK2、cyclin D1和pGSK-3β(Ser9)蛋白水平降低(P <0.05),p21、p27 蛋白水平则升高(P <0.05),见图2。
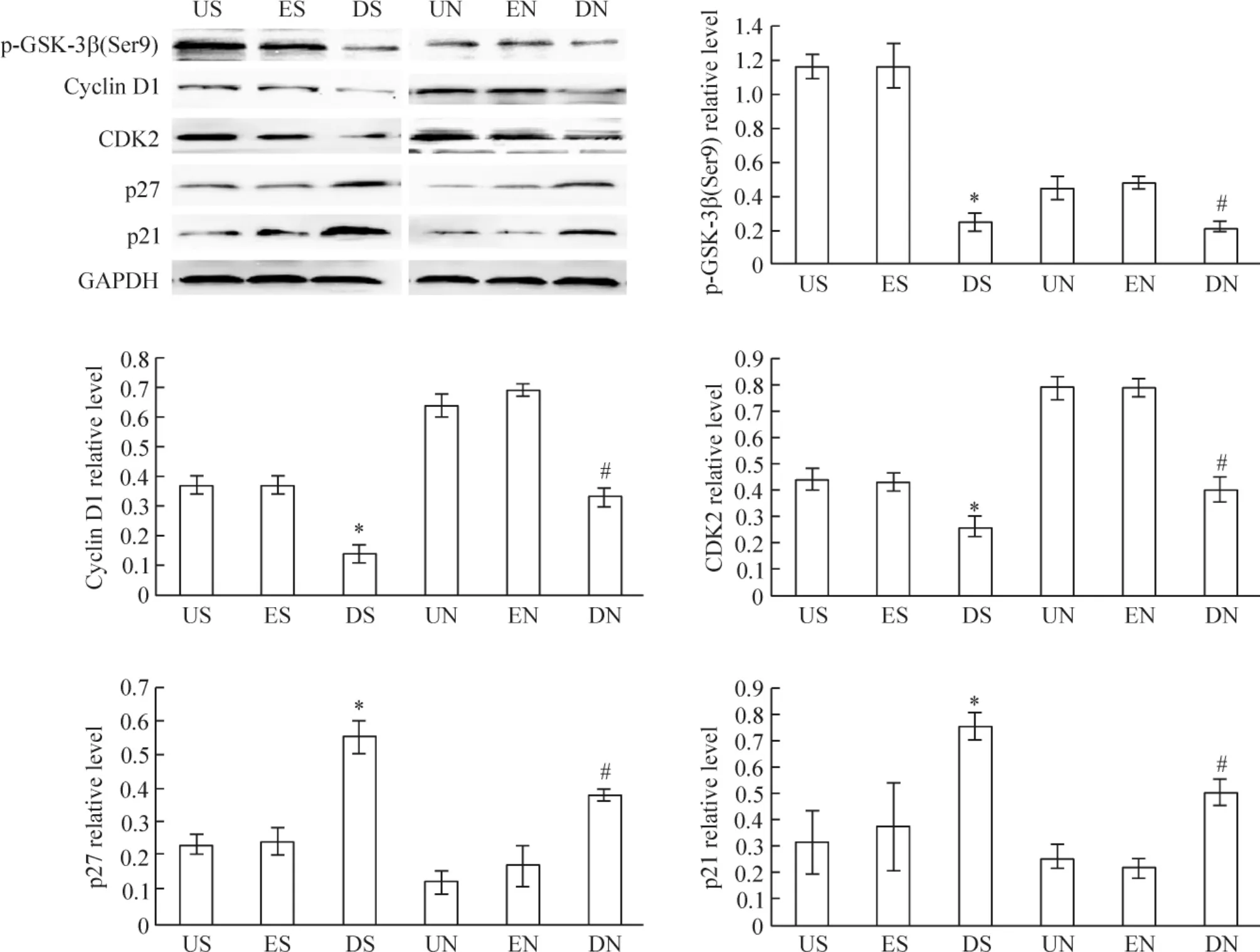
Figure 2.Expression of the proteins relative to cell cycle detected by Western blotting.Mean ±SD.n=3.*P <0.05 vs US or ES;#P<0.05 vs UN or EN.图2 Western blotting检测细胞周期相关蛋白的表达
讨 论
细胞周期(cell cycle)是指一个连续分裂的细胞从一次分裂完成开始,直到下一次分裂完成为止经历的全过程[8]。细胞周期包括4个时相:G1期、S期、G2期和M期。G1期为DNA合成前期,主要合成RNA和蛋白质,其是DNA复制所必需的,影响着S期的正常启动;S期为DNA合成期;G2期为DNA合成后期,主要进行有丝分裂中新细胞形成所必需物质的合成,是决定细胞能否顺利进入M期(有丝分裂期)的关键。在哺乳动物细胞G1期存在特定的时点,Pardee[9]命名此点为限制点(restriction point),在限制点之前如果细胞缺乏外界生长信号的持续刺激,则其会终止分裂周期进入休眠状态,称为G0期。在G0期,细胞可长期存活而不分裂增殖,当受到生长信号刺激,即可从G0期返回G1期继续生长分裂进程,而且即使在G1中晚期通过限制点后再除去外界生长信号的刺激,也不会阻止细胞进入S期。
细胞通过G1中晚期限制点后,细胞周期开始运行,一套严格的质量监控机制开始运作,它就是细胞周期的检查点(check point)机制。检查点由Weinert等[10]和 Hartwell等[11]首先发现并描述,实质上是细胞在长期进化过程中发展出的一系列存活机制,作为在基因组或纺锤体损伤,或细胞周期某一事件不能按时完成情况下的一种补救措施,在G1/S交界点存在DNA损伤检查点[12]。Cyclin D1是一重要的细胞周期调控分子[13],不仅是调控细胞通过G1期限制点(即G0/G1期转换)的关键分子之一,而且是G1/S转换的关键分子,cyclin D1-CDK4/6可使pRb处于磷酸化状态而灭活[14],释放出其扣留的大量转录因子,尤其是E2F,启动细胞周期进入S期所需蛋白的转录。另外,cyclin E-CDK2也能够使pRb处于磷酸化状态而灭活[15-17]。Cyclin D1-CDK4/6在 G1期早期即开始发挥作用导致pRb磷酸化 ,而cyclin E-CDK2直到G1晚期才开始发挥作用,cyclin D1-CDK4/6发挥作用导致pRb部分磷酸化是cyclin ECDK2发挥作用的基础[16-17]。p21和p27是重要的CDK 抑制蛋白,p21 能够抑制 CDK2 和 CDK4[18],p27则能够抑制 CDK4、CDK6 或者 CDK2[19]。
在本实验中,人胃癌细胞被pEGFPN1-DNEGFR转染后,将表达DNEGFR-EGFP融合蛋白,EGFP作用在于其便于对DNEGFR进行定位,对DNEGFR功能无影响;DNEGFR降低内源性EGFR Ser1046位点磷酸化水平,进而降低内源性EGFR功能,具有显性负调控作用[20]。我们采用pEGFPN1-DNEGFR转染人胃癌细胞,通过表达DNEGFR来阻断人胃癌细胞EGFR信号转导通路,探讨其对人胃癌细胞周期的影响及分子机制。
我们采用流式细胞术进行细胞周期检测,结果提示DS及DN组胃癌细胞G0/G1期比例均升高,而S期比例均下降,表明DNEGFR能够导致胃癌细胞G0/G1期阻滞,与采用EGFR单克隆抗体西妥昔单抗(cetuximab)在鳞状细胞癌细胞中的研究结果基本一致[21]。那么,DNEGFR能够导致胃癌细胞G0/G1期阻滞是否与CDK2、cyclin D1、p21和p27相关呢?如果有关,具体调控机制又是什么呢?
为了明确胃癌细胞G0/G1期阻滞的分子机制,我们采用Western blotting检测 CDK2、cyclin D1、p21、p27和p-GSK-3β(Ser9)蛋白水平。检测结果提示DS及DN组胃癌细胞CDK2、cyclin D1和p-GSK-3β(Ser9)蛋白水平降低,而p21和p27蛋白水平则升高。对于GSK-3β,Ser9位点磷酸化后处于其非活性状态[22]。据此,我们推论,pEGFPN1-DNEGFR 转染胃癌细胞后,表达出DNEGFR蛋白,DNEGFR与内源性EGFR竞争结合EGF,导致EGF缺乏(EGF withdrawal),通过降低Ser9位点磷酸化水平激活GSK-3β使cyclin D1蛋白水平降低,cyclin D1-CDK4/6含量减少;DNEGFR还使CDK2蛋白水平降低,cyclin E-CDK2含量减少;同时,DNEGFR上调p21、p27蛋白水平,抑制cyclin D1-CDK4/6及cyclin E-CDK2活性;以上三方面因素共同参与使pRb处于低磷酸化状态,导致大量转录因子尤其是E2F被扣留,最终使胃癌细胞发生G0/G1期阻滞。
综上所述,我们发现DNEGFR能够诱导胃癌细胞发生G0/G1期阻滞,并明确了部分分子机制,将为胃癌生物治疗研究提供新思路。然而,细胞周期的调控环节极为复杂,参与其中的蛋白非常多。是否有其它因素参与胃癌细胞的G0/G1期阻滞呢?这有待我们的进一步研究来明确。
[1] Patel R,Leung HY.Targeting the EGFR-family for therapy:biological challenges and clinical perspective [J].Curr Pharm Des,2012,18(19):2672-2679.
[2] 曲 娴,胡景新.EGFR单克隆抗体抗结肠癌作用的实验研究[J].中国病理生理杂志,2002,18(9):1130-1132.
[3] 奚少彦,吴秋良,宗永生,等.EGFR-c-Kit蛋白的表达与鼻咽癌原发瘤的进展相关[J].中国病理生理杂志,2012,28(4):643-648.
[4] 廖 刚,王子卫,张 能,等.人表皮生长因子受体显性负性突变体对胃癌细胞体外侵袭转移能力的抑制作用[J].重庆医科大学学报,2012,37(7):574-578.
[5] Ryan JJ,Danish R,Gottlieb CA,et al.Cell cycle analysis of p53-induced cell death in murine erythroleukemia cells[J].Mol Cell Biol,1993,13(1):711-719.
[6] Leng RP,Lin Y,Ma W,et al.Pirh2,a p53-induced ubiquitin-protein ligase,promotes p53 degradation [J].Cell,2003,112(6):779-791.
[7] Wang Z,Banerjee S,Kong D,et al.Down-regulation of Forkhead Box M1 transcription factor leads to the inhibition of invasion and angiogenesis of pancreatic cancer cells[J].Cancer Res,2007,67(17):8293-8300.
[8] 黄文林,朱孝峰.信号转导[M].第1版.北京:人民卫生出版社,2005:364-365.
[9] Pardee AB.A restriction point for control of normal animal cell proliferation[J].Proc Natl Acad Sci U S A,1974,71(4):1286-1290.
[10] Weinert TA,Hartwell LH.The RAD9 gene controls the cell cycle response to DNA damage in Saccharomyces cerevisiae[J].Science,1988,241(4863):317-322.
[11] Hartwell LH,Weinert TA.Checkpoints:controls that ensure the order of cell cycle events[J].Science,1989,246(4930):629-634.
[12] Sclafani RA,Holzen TM.Cell cycle regulation of DNA replication [J].Annu Rev Genet,2007,41:237-280.
[13] Stacey DW.Cyclin D1 serves as a cell cycle regulatory switch in actively proliferating cells[J].Curr Opin Cell Biol,2003,15(2):158-163.
[14] Finn RS,Dering J,Conklin D,et al.PD 0332991,a selective cyclin D kinase 4/6 inhibitor,preferentially inhibits proliferation of luminal estrogen receptor-positive human breast cancer cell lines in vitro[J].Breast Cancer Res,2009,11(5):R77.
[15] Stewart ZA,Leach SD,Pietenpol JA.p21Waf1/Cip1inhibition of cyclin E/Cdk2 activity prevents endoreduplication after mitotic spindle disruption [J].Mol Cell Biol,1999,19(1):205-215.
[16] Harbour JW,Luo RX,Dei Santi A,et al.Cdk phosphorylation triggers sequential intramolecular interactions that progressively block Rb functions as cells move through G1[J].Cell,1999,98(6):859-869.
[17] Lundberg AS,Weinberg RA.Functional inactivation of the retinoblastoma protein requires sequential modification by at least two distinct cyclin-cdk complexes[J].Mol Cell Biol,1998,18(2):753-761.
[18] Abbas T,Dutta A.p21 in cancer:intricate networks and multiple activities[J].Nat Rev Cancer,2009,9(6):400-414.
[19] Soos TJ,Kiyokawa H,Yan JS,et al.Formation of p27-CDK complexes during the human mitotic cell cycle [J].Cell Growth Differ,1996,7(2):135-146.
[20] 廖 刚,王子卫,赵 林,等.人EGFR显性负性突变体负调控内源性EGFR功能的机制分析[J].生命科学研究,2010,14(3):203-207,239.
[21] Huang SM,Bock JM,Harari PM.Epidermal growth factor receptor blockade with C225 modulates proliferation,apoptosis,and radiosensitivity in squamous cell carcinomas of the head and neck[J].Cancer Res,1999,59(8):1935-1940.
[22] Jope RS,Johnson GV.The glamour and gloom of glycogen synthase kinase-3[J].Trends Biochem Sci,2004,29(2): 95-102.

