2型登革病毒通过线粒体途径诱导EA.hy926细胞凋亡*
齐一鸣, 黄俊琪
(中山大学中山医学院免疫学研究所,教育部热带病防治研究重点实验室,广东广州510080)
登革热是是世界上最常见的蚊媒传播疾病之一,但目前仍缺乏合适的实验动物模型和特异性的治疗手段,也没有安全的疫苗可以预防其传播。对于重症型的登革出血热(dengue hemorrhagic fever,DHF)或登革休克综合征(dengue shock syndrome,DSS),血管内皮损伤导致的血浆渗漏及出血是其主要的临床特征。国内外均有研究表明,2型登革病毒(dengue virus type 2,DEM-2)可以直接或间接诱导宿主的血管内皮细胞凋亡[1-3],然而,通过何种途径诱导凋亡却观点各异。本研究主要通过对登革病毒感染前后EA.hy926细胞线粒体膜电位(mitochondrial membrane potential,Δψm)变化情况及 caspase-9 活性的观察,讨论线粒体凋亡途径是否也参与了DHF或DSS的发病机制。
材料和方法
1 材料
1.1 病毒与细胞系 DENV-2 NGC病毒株来自中山大学中山医学院微生物学教研室,由本室进行扩增定量和保存。EA.hy926细胞由人血管内皮细胞及A549肺癌上皮细胞融合而成,由中山大学中山医学院干细胞中心赠予。
1.2 主要试剂及检测仪器 培养基DMEM/F12、胎牛血清和青链霉素双抗为Gibco。噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT]为Sigma产品。检测JC-1线粒体膜电位检测试剂盒为Genmed产品,流式细胞仪FACSCalibur为BD产品,荧光显微镜Axio Observer Z1为Carl Zeiss产品,酶标仪为BioTek产品。
2 方法
2.1 细胞培养 EA.hy926细胞用含10%胎牛血清及1%青链霉素双抗的DMEM/F12培养基,置于37℃、5%CO2孵育箱中培养及传代。
2.2 登革病毒感染 取2型登革病毒液定量至(109pfu/L),加入EA.hy926细胞培养瓶中,感染复数(multiplicity of infection,MOI)为4,吸附1 h。弃上清,加入完全培养基,于37℃、5%CO2条件下维持培养,分别于24 h、36 h和48 h后弃去培养液,收集细胞。
2.3 MTT法 收集处于对数生长期的EA.hy926细胞调整细胞至5 000 cells/well,铺于96孔板中,于37℃、5%CO2温箱中培养。细胞贴壁后,对照组加含10%胎牛血清的DMEM培养液,感染组加含10%胎牛血清的DMEM培养液及DENV病毒液5 μL,每个组设6个平行孔。分别培养24 h、36 h和48 h后,每孔加入1 g/L MTT溶液50 μL,37℃孵育4 h。弃上清,加入100 μL DMSO使结晶溶解。室温下轻度振荡15 min,1 h内用酶标仪测出570 nm处的A值。以下公式计算出DENV-2对EA.hy926细胞生长的抑制率:细胞生长抑制率(%)=(未感染细胞A值-感染细胞A值)/未感染细胞A值×100%。
2.4 线粒体膜电位的检测 取对数期生长的EA.hy926细胞,0.25%胰蛋白酶消化,1 500 r/min 离心5 min,PBS洗涤2遍。流式细胞仪及荧光显微镜检测均按照试剂盒说明书进行。
2.5 Caspase-9活性检测 采用caspase-9活性蛋白酶检测试剂盒(Invitrogen)测定。裂解EA.hy926细胞提取总蛋白,定量并稀释至终浓度2 mg/L。操作步骤严格按试剂盒说明书进行。于波长405 nm处读取A值。
3 统计学处理
采用SPSS 13.0统计软件分析,计数资料用(mean±SD)表示,组间数据的比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 DENV-2感染EA.hy926细胞后对细胞活性的抑制
MTT检测发现,EA.hy926在感染DENV-2 24 h、36 h及48 h后细胞活性受到显著抑制,550 nm处的A 值分别为1.204 ±0.042、1.216 ±0.057 和1.293 ±0.087,各个时点均低于未感染组(0.730 ± 0.141、0.433±0.034 和 0.360 ±0.113),差异有统计学意义(P<0.05或 P<0.01)。随时间的延长,感染组细胞活性持续降低而未感染组几乎无差异,见图1。
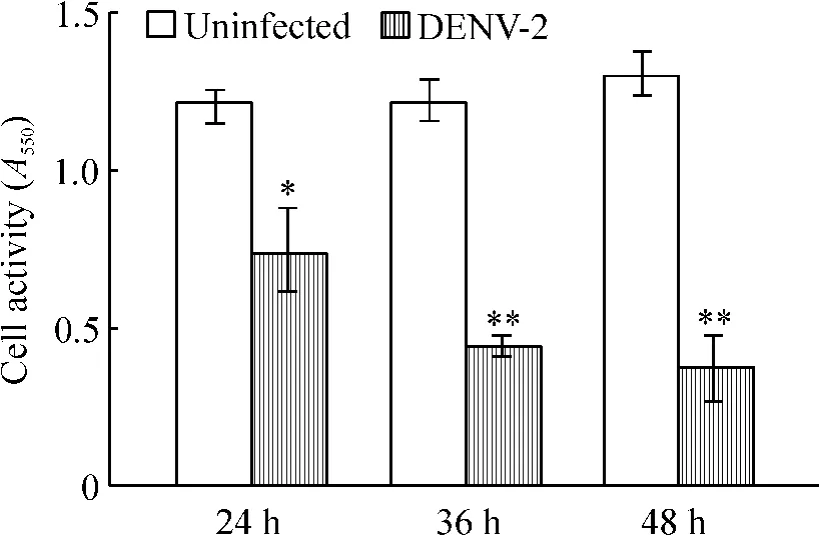
Figure 1.EA.hy926 cell growth inhibtion after DENV-2 infection for 24 h,36 h or 48 h detected by MTT assay.Mean±SD.n=6.*P < 0.05,**P < 0.01 vs uninfected.图1 DENV-2感染 EA.hy926细胞24 h、36 h、48 h后细胞活性变化
2 流式细胞仪检测线粒体膜电位的变化
JC-1可以以单体或聚合体的形式积聚于线粒体中。在线粒体发生去极化时,JC-1以单体形式占主导,发射绿色荧光(~530 nm);当电位复极至-140 mV甚至更高时,则主要以聚合物形式存在并发射红色荧光(~590 nm)。借助JC-1复合体不同形式所发射的红色/绿色荧光比值(FL2/FL1),可以表示线粒体膜电位的改变。DENV-2感染24 h、36 h及48 h后,感染组 Δψm均值分别为3.15±0.28、2.23±0.36和2.40±0.49;未感染组为4.80±0.33、3.48±0.43和3.23±0.20。感染组各时点均较未感染组低,差异有统计学意义(均P<0.01),且感染组Δψm的最低点出现在感染后36 h,见图2、3。
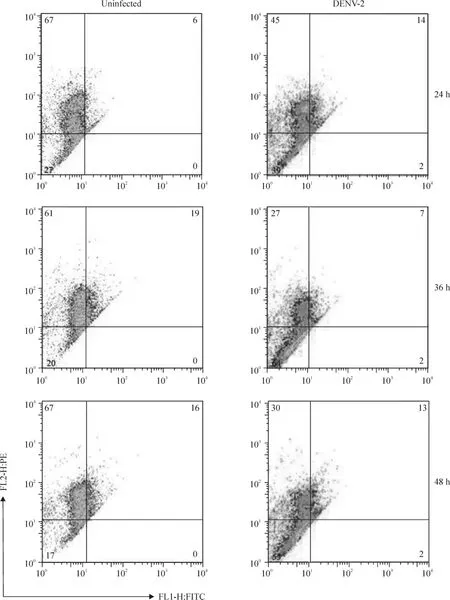
Figure 2.Mitochondrial membrane potential changes in EA.hy926 cells infected with or without DENV-2 for 24 h,36 h and 48 h detected by flow cytometry.图2 流式细胞术检测DENV-2感染24 h、36 h和48 h后EA.hy926细胞线粒体膜电位的变化
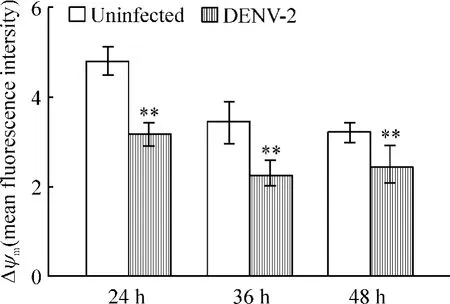
Figure 3.Mitochondrialmembrane potential changes in EA.hy926 cells infected with or without DENV-2 for 24 h,36 h and 48 h.Mean ± SD.n=6.**P <0.01 vs uninfected.图3 DENV-2感染24 h、36 h和48 h后 EA.hy926细胞线粒体膜电位的变化
3 荧光显微镜观察线粒体膜电位的变化
未感染组随着时间的增加,虽然胞浆内散在的红色颗粒逐渐减少,但是绿色荧光基本无变化;感染组绿色荧光增强,红色荧光则在36 h表达最弱。与流式细胞术检测结果一致,见图4。
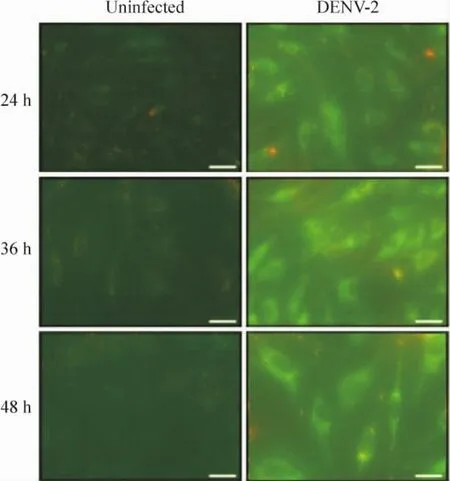
Figure 4.Mitochondrialmembrane potential changes in EA.hy926 cells infected with or without DENV-2 for 24 h,36 h and 48 h detected by fluorescence microscopy.Scale bar=20 μm.图4 荧光显微镜观察 DENV-2感染24 h、36 h、48 h后EA.hy926细胞线粒体膜电位的变化
4 感染后caspase-9活性的变化
DENV-2感染后,24 h即可出现caspase-9活性上升,且其活性随着时间的延长而逐渐增加。感染组24 h、36 h及48 h caspase-9活性的 A值分别为0.134 ±0.010、0.137 ±0.010 和 0.140 ±0.020,未感染组分别为0.038 ±0.010、0.038 ±0.010 和 0.040±0.010,2组之间的差异均有统计学意义(P<0.01),见图5。

Figure 5.Caspase-9 activity in EA.hy926 cells infected with or without DENV-2 for 24 h,36 h and 48 h.Mean ± SD.n=6.**P <0.01 vs uninfected.图5 DENV-2感染 EA.hy926细胞24 h、36 h和48 h后caspase-9活性的变化
讨 论
细胞凋亡或程序化死亡是机体抵抗微生物入侵、去除被感染细胞、限制病原扩散的重要病理生理过程[4]。我们前期的研究已经证实,DENV-2感染可以通过活化Fas/FasL及caspase级联反应诱导原代的 HUVECs发生凋亡,以 48 h 最明显[5-6]。而EA.hy926细胞来源于 HUVECs,同样具有内皮细胞的特性,我们在诱导EA.hy926细胞发生凋亡时则在感染36h后凋亡率增加最为显著[7]。本组实验结果显示,细胞生长的抑制率随着感染时间的延长而增加,48 h达峰值。外源性MTT通过检测活细胞线粒体中的琥珀酸脱氢酶的数量来间接反映活细胞的数量[8],而感染组细胞较未感组活细胞数量减少,即线粒体总琥珀酸脱氢酶的含量减少,这就提示了线粒体也可能参与了DENV-2诱导EA.hy926细胞发生凋亡的途径。线粒体是程序化死亡信号转导途径中起关键调节作用的细胞器。线粒体膜电位的破坏被认为是细胞凋亡级联反应过程中最早发生的事件之一[9]。为了进一步探究线粒体是否参与了DENV-2感染后EA.hy926细胞发生凋亡的通路,我们通过JC-1染色检测了Δψm的变化。流式细胞术和荧光显微镜的结果都显示,DENV-2作用EA.hy926细胞后,Δψm降低并在36 h最为明显,晚于MTT活性抑制高峰的48 h。但考虑到MMP变化是凋亡早期事件,应早于或同时于凋亡的发生,故两高峰产生了时间差异。线粒体膜电位降低后,引起膜通道非特异开放,细胞色素酶C从内膜脱落出来并释放到胞质中,进而与凋亡蛋白酶活化因子1(apoptotic proteinase-activating factor 1,Apaf1)结合形成复合物,激活pro-caspase-9,随之活化caspase-9。而caspase-9的激活是启动caspase级联放大反应、诱发细胞凋亡的第一步[10]。本结果显示,DENV-2感染后早期即可出现caspase-9活性的显著增高,并且维持在相对高水平。
以往文献多报道使用线粒体标记物罗丹明123(rhodamine 123,Rh123)来检测 Δψm,但是 Rh123 容易发生自身淬灭,而且产生较强的非线性反应,不易定量,仅可作为一种定性的检测手段。更重要的是,Rh123具有浓度依赖性,在浓度大于1 μmol/L时即可影响线粒体的呼吸作用及ATP酶的活性,当浓度达10 μmol/L时可引起更严重的线粒体肿胀,不仅在早期影响Δψm的改变,还使得后期的凋亡结果出现更多的假阳性[11]。而本研究采用的JC-1对染色细胞内的膜电位变化较Rh123虽敏感性稍低,但也因此它可以更为真实一致的反应线粒体的去极化,假阳性少。聚合体散发的红色荧光,可以线性反映Δψm的改变,而使用参比的方法使JC-1检测的灵敏度更高。另外,实验也证明,JC-1在浓度为 550 nmol/L时对线粒体的呼吸作用基本没有影响,当增大浓度至10 μmol/L时,细胞存活率仍可维持在95%以上[12]。本研究中,标记 EA.hy926细胞线粒体的JC-1浓度为1 μmol/L,因此,对于细胞活性和形态几乎没有不良作用。另外,在进行EA.hy926细胞感染时,我们采用了含2%血清的培养基替换了正常培养条件下含10%血清的培养基,以减少对病毒扩增、感染能力的抑制。研究发现,血清浓度可显著影响病毒的增殖能力,牛血清浓度在2%时,病毒可达到最快的增殖速度和最高的滴度;同时,该浓度也可以较持久地维持细胞的生命状态,保证感染过程的顺利进行[13]。
[1] Kanlaya R,Pattanakitsakul SN,Sinchaikul S,et al.The ubiquitin-proteasome pathway is important for dengue virus infection in primary human endothelial cells[J].J Proteome Res,2010,9(10):4960-4971.
[2] Wang Z,Shi Q,Li S,et al.Hyperthermia induces platelet apoptosis and glycoprotein Ibα ectodomain shedding[J].Platelets,2010,21(3):229-237.
[3] Vásquez Ochoa M,García Cordero J,Gutiérrez Casta~neda B,et al.A clinical isolate of dengue virus and its proteins induce apoptosis in HMEC-1 cells:a possible implication in pathogenesis[J].Arch Virol,2009,154(6):919-928.
[4] 曾 葭,陈小宇,祝爱珍,等.盐霉素增强吉非替尼诱导人肺腺癌细胞株A549凋亡的作用[J].中国病理生理杂志,2012,28(12):2147-2153.
[5] Liao H,Xu J,Huang J.FasL/Fas pathway is involved in dengue virus induced apoptosis of the vascular endothelial cells[J].J Med Virol,2010,82(8):1392-1399.
[6] Long X,Li Y,Qi Y,et al.XAF1 contributes to dengue virus-induced apoptosis in vascular endothelial cells[J].FASEB J,2012,Dec 4.[Epub ahead of print].
[7] 龙喜贵,李 颖,郑毅涛,等.CXCR4抑制剂AMD3100对2型登革热病毒诱导血管内皮细胞株Eahy926凋亡的影响[J].中国病理生理杂志,2011,27(4):632-637.
[8] Spector DL,Goldman RD,Leinwand LA.细胞实验指南[M].北京:科学出版社,2006:118-125.
[9] Mu~noz-Pinedo C.Signaling pathways that regulate life and cell death:evolution of apoptosis in the context of self-defense[J].Adv Exp Med Biol,2012,738:124-143.
[10] 刘江涛,郭 雄,吴翠艳,等.线粒体细胞色素C介导的caspase-9激活通路参与大骨节病关节软骨细胞凋亡的发生机制[J].西安交通大学学报:医学版,2011,32(5):580-584.
[11] Emaus RK,Grunwald R,Lemasters JJ.Rhodamine 123 as a probe of transmembrane potential in isolated rat-liver mitochondria:spectral and metabolic properties[J].Biochim Biophys Acta,1986,850(3):436-448.
[12] Keil VC,Funke F,Zeug A,et al.Ratiometric high-resolution imaging of JC-1 fluorescence reveals the subcellular heterogeneity of astrocytic mitochondria[J].Pflugers Arch,2011,462(5):693-708.
[13] 孙朝晖,石玉玲,冼 江,等.HSV-2 333株在Vero细胞中持续感染及增殖特性研究[J].医学临床研究,2009,26(5):753-756.

