固相萃取-UPLC-MS/MS测定食品中的黄曲霉毒素M1和B1*
肖丽恒,何学梅,李 萍,谢启明
(1.楚雄州质量技术监督综合检测中心,云南 楚雄 675000;2.楚雄师范学院化学与生命科学系,云南 楚雄 675000)
黄曲霉毒素 (aflatoxin,简称为AF)是黄曲霉和寄生曲霉中产毒菌株的代谢产物,化学结构均为二氢呋喃香豆素的衍生物,是目前为止所发现的毒性最大的真菌毒素。普遍存在于霉变的粮食及粮食制品中,食用这些被污染的食物,直接影响人们的身体健康和生命安全。为了保证人身安全,国家规定的食品中允许含量极低[1]。
黄曲霉毒素的检测分析方法有薄层色谱法 (TLC)[2]、高效液相色谱法 (HPLC)[3—6]、气相色谱法 (GC)[2]、酶联免疫法 (ELISA)、放射免疫检测法[8]、以及液相色谱串联质谱检测法[9—13],目前检测黄曲霉毒素的方法比较广泛的为免疫亲和层析净化高效液相色谱法和酶联免疫吸附法这两种方法。TLC所需仪器设备简单,干扰因素多,测定时间长,荧光强度的目测准确性比较差,主要是半定量;放射免疫法的样品前处理提取方法简便,具有灵敏度高,特异性强的特点,只能应用于初筛分析[8]。目前的国标方法为免疫亲和柱—液相色谱法,该方法灵敏度高,特异性好,但是存在免疫亲和柱价格昂贵,需低温保存,保存期短等缺点[9]。ELISA方法虽操作简单、快速、经济,但有灵敏度较低、重复性较差、试剂寿命短、需要低温保存等缺点[14]。因此,本文选择乙腈提取,固相萃取纯化作为前处理手段,UPLC-MS/MS检测法作为检测技术,建立了一种操作简单、灵敏度高、特异性好、分析速度快、适用于食品中黄曲霉毒素检测的检测方法。
1.材料与方法
1.1 仪器与设备
安捷伦高压液相色谱仪 (型号:1260),系统配制:泵 (型号:G1312C),电喷雾串联双重四级杆质谱检测器 (型号:6460)、自动进样器 (型号:G1367E)、恒温柱温箱 (型号:G1316A)、真空在线脱气机 (型号:G1322A)、化学工作站 (型号:MassHunterQQQ)、样品均质器、漩涡混合器 (或高速搅拌器)、高速离心机、氮气吹干仪、超声波清洗器、移液器、真空抽滤泵、EasyDI8超纯水机。
1.2 材料与试剂
黄曲霉毒素M1标准储备溶液 (10 μg/ml)、黄曲霉毒素B1标准储备溶液 (10 μg/ml)、乙腈(色谱纯)、甲醇 (色谱纯)、甲酸 (色谱纯)、乙酸 (色谱纯)、甲酸铵 (色谱纯)、乙酸铵 (色谱纯)、氯化钠 (分析纯)、石油醚 (分析纯)、三氯甲烷 (分析纯)。次氯酸钠溶液 (50 g/L),SPE柱(ProElut AFT 1500 mg/12 mL)、0.45μm滤膜、一次性注射器。
1.3 色谱条件
色谱柱:ZORBAX Ecipse XDB-C18柱 (柱长100 mm,内径3.0 mm,填料直径1.8 μm),流动相:甲醇+0.1%甲酸水溶液 (60∶40);进样量:5 μL;流速:0.4 mL/min,柱温:45.0℃。
1.4 质谱条件
离子化模式为电喷雾电离正离子模式 (ESI+);毛细管电压为3.0kV(ESI+);去溶剂气温度为300℃;氮气流速为10 L/min;碰撞气压力为40psi;扫描范围为50~400 m/z,光电倍增器电压增值为300 V;质谱扫描模式为MRM模式。黄曲霉毒素的质谱条件如表1。
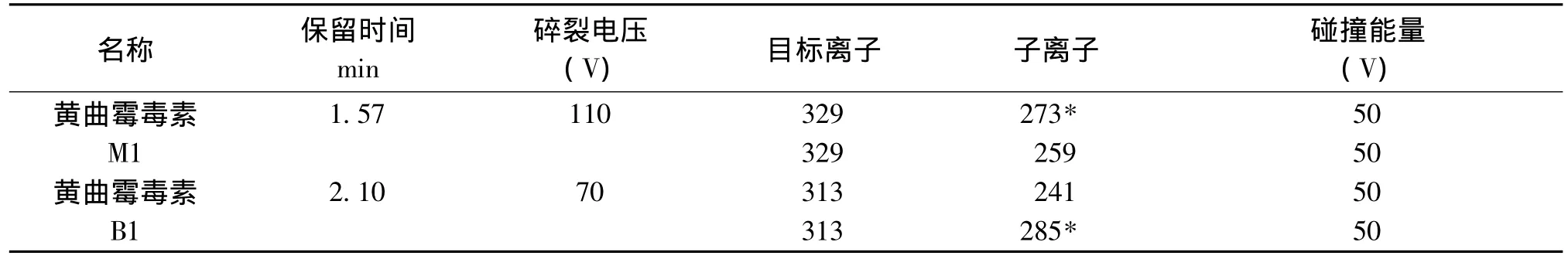
表1 黄曲霉毒素M1、B1检测的质谱条件
1.5 样品处理
1.5.1 样品提取
准确称取试样2 g于50 mL离心管中,固体样品加入5 mL水,非固体样品不用加水,静置10 min,加入20 mL乙腈,旋涡混合2 min,超声提取20 min,加入饱和的氯化钠溶液10 mL或者加入5 g氯化钠,旋涡混合1 min,4000 rpm离心10 min,取出上清液,再加10 mL乙腈重复提取一次,合并两次的上清液于试管中,在氮吹仪上45℃吹至近干,用2 mL乙腈溶解并旋涡混合1 min,等待净化。
1.5.2 样品净化
用乙腈活化SPE小柱10 min。将待净化液加入小柱,加2 mL乙腈润洗试管,洗液加入小柱一起净化处理,接收流出液。用20 mL乙腈洗脱,流速控制在1mL/min,洗脱液在45℃水浴中氮吹吹干,用精密移液器取1 mL流动相溶解,旋涡混合1 min,过0.45 μm的有机系滤膜,5 μL进样上机检测。
2.结果与分析
2.1 质谱条件的优化
为了提高检测器的灵敏度和使用性能,对质谱检测器的使用参数进行了调整和优化,条件如1.4的设定,待仪器稳定后,采用电喷雾电离正离子模式 (ESI+)MS1全扫描,扫描范围为50~400(M/Z),选出黄曲霉毒素M1和B1的母离子和优化电离电压,在对母离子进行碰撞解离并优化碰撞能量,得出的参数如表1。
2.2 流动相的选择
实验时选用甲醇和水作为流动相,出峰时间好。但是为了更好地离子化,就在水溶液中加入甲酸,使甲酸的含量为0.1%。当甲醇和0.1%甲酸水溶液的比例为60:40(体积比,V/V)时,等度洗脱,黄曲霉毒素M1出峰时间为1.555 min,黄曲霉毒素B1出峰时间为2.104 min,分离效果较好,出峰时间比较合理,标样含量为1.0 μg/L色谱图如下图1。
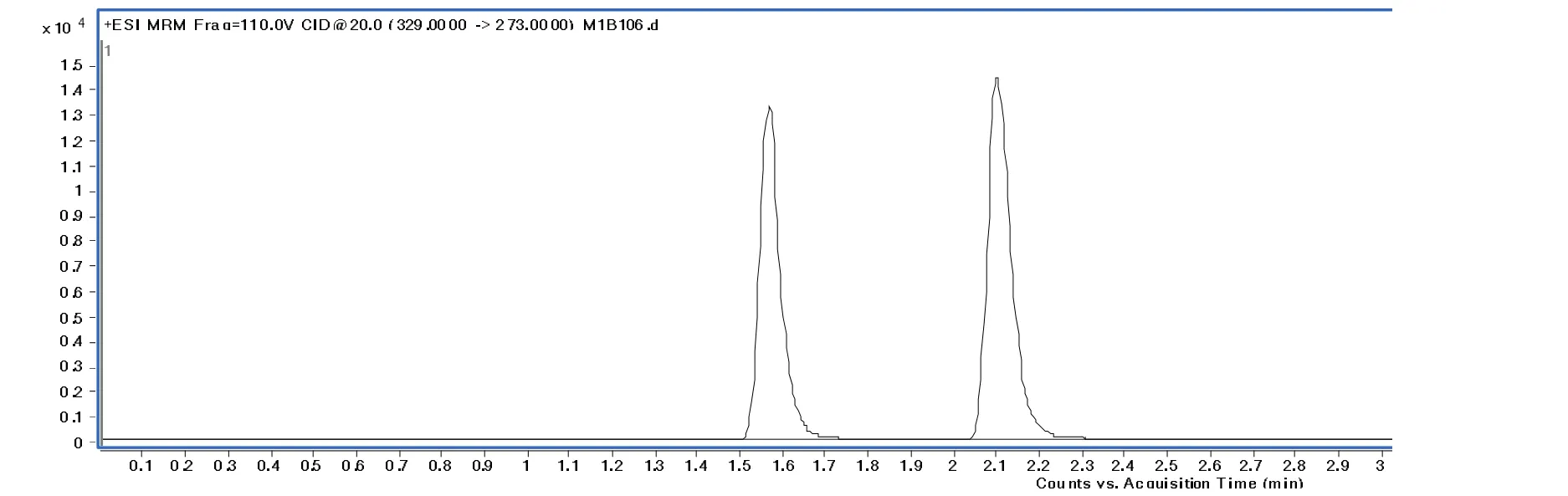
图1 黄曲霉毒素M1、B1标样色谱图
2.2 萃取方式的选择
黄曲霉毒素易溶于油、甲醇、乙腈、丙酮和氯仿等有机溶剂,但不溶于石油醚,己烷和乙醚中。利用甲醇和水作为样品提取溶剂,在使用氯仿进一步提取,操作步骤多,使得回收率的测定结果偏低。于是选择加适量的水和乙腈作为提取溶剂,在漩涡混合使其充分混合,采用超声波超声提取20 min,4000 rpm离心10 min,能够充分的提取黄曲霉毒素,加入5 g氯化钠,能很好的使乙腈和水相进行分离,上清液乙腈也有利于氮吹浓缩。
2.3 纯化方法的优化
黄曲霉毒素的净化方法目前主要使用免疫亲和柱 (IAC)进行净化,其特点是将特异性的黄曲霉毒素单克隆抗体与载体蛋白偶联并填柱而成。由于抗原抗体有一一对应的特异性吸附关系,所以免疫亲和柱 (IAC)只能特效性地、高选择性地吸附黄曲霉毒素,而不让其他杂质通过柱子,使样品得以纯化。这种吸附又可以被极性有机溶剂洗脱,进行定量检测,但是免疫亲和柱存在价格昂贵,只能使用一次,需低温保存,保存期短等缺点[9]。
另外,使用乙醚或者石油醚除脂,甲醇和水溶液提取,再用氯仿纯化,方法虽然简单,但是纯化不完全,而且质谱所用的色谱柱填料细,容易堵塞色谱柱和污染检测器。使用固相萃取柱 (SPE)进行分离纯化,其特点是它以极性、非极性及离子交换等几类基团组成填充剂,可选择性吸附样液中的脂类、蛋白类等杂质,黄曲霉毒素不被吸附而直接通过,从而达到净化目的,并且价格合适,于是选用SPE柱进行净化。
2.4 校准曲线和检出限
将黄曲霉毒素标准储备液按一定的浓度比例进行逐级稀释,并配置成质量浓度为1 μg/L、2 μg/L、5 μg/L、10 μg/L、50.0 μg/L的标准混合液,在设定好的检测条件下,以峰面积和质量浓度的关系绘制标准曲线。黄曲霉毒素M1在1μg/L~50 μg/L线性关系良好,黄曲霉毒素B1在1 μg/L~10 μg/L线性关系良好,相关系数在0.999以上,线性回归方程和检出限如表2。

表2 黄曲霉毒素混合标准曲线回归方程
2.5 样品添加回收试验和精密度
准确称取2 g固体检测样品或5 g液体样品,进行空白和加标实验,加标物的含量为5 μg/L、10 μg/L、20 μg/L,按实验方法进行提取和净化,制得加样回收率供试品溶液进行UPLC-MS/MS检测分析。并计算出回收率好和相应RSD值,结果见表3,结果表明,此方法回收率试验结果良好,满足实验方法要求。
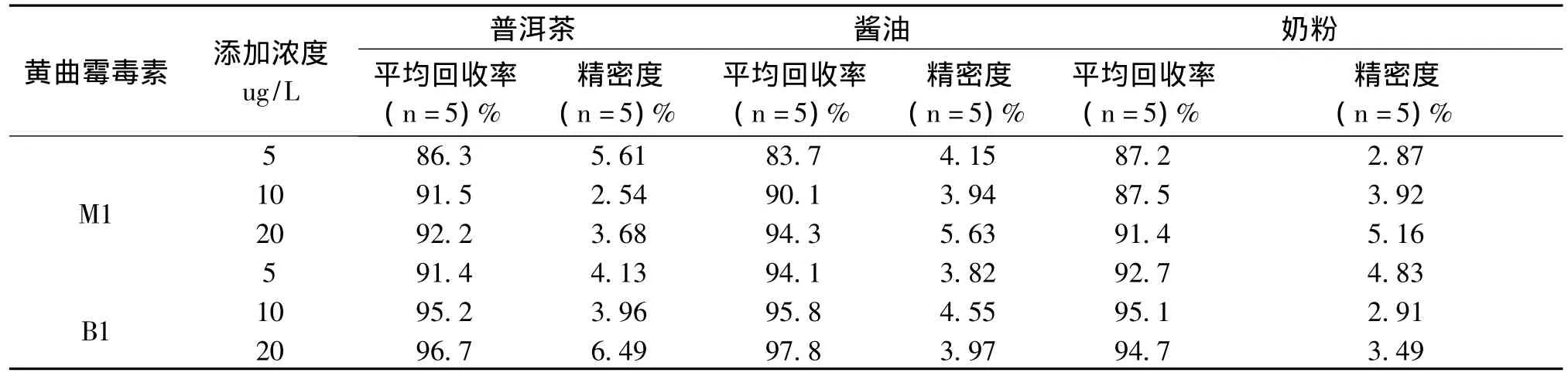
表3 样品中黄曲霉毒素添加回收率和精密度 (n=5)
3.结论
建立固相萃取与UPLC-MS/MS检测食品中黄曲霉毒素M1和黄曲霉毒素B1的方法,具有操作简单、灵敏度高、特异性好、分析速度快,满足食品中黄曲霉毒素检测的检测方法。
[1]GB2761-2011,食品安全国家标准 食品中真菌毒素限量[S].北京:中国标准出版社,2011.
[2]GB/T 5009.24-2010,食品中黄曲霉毒素Ml与B1的测定方法[S].北京:中国标准出版社,2010.
[3]郑荣,毛丹,王珂,等.HPLC法测定乳制品中的黄曲霉毒素M1[J].中国食品卫生杂志,2007,19(4):318—335.
[4]涂文升.高效液相色谱法同时检测食品中四种黄曲霉毒素[J].中华预防医学杂志,2002,36(5):343—345.
[5]李佐卿,章再婷,谢东华,等.免疫亲和柱高效液相色谱法快速测定牛奶和奶粉中黄曲霉毒素M1、B1、B2、G1、G2[J].理化检验-化学分册,2005,41:406—408.
[6]GBT23212-2008牛奶和奶粉中黄曲霉毒素B1、B2、G1、G2、M1、M2的测定液相色谱-荧光检测法[S].北京:中国标准出版社,2008.
[7]VALLE-ALGARRA FM,ANGEL M,GIMENO-ADELANTADO J V et al.Comparative assessment of solid-phase extraction clean-up procedures,GC columns and perfluoroacylation reagents for determination of type B trichothecenes in wheat by GC -ECD[J].Talanta,2005,66(1):194—201.
[8]闫磊,李卓,张燕.牛奶中黄曲霉毒素的放射免疫法检测[J].食品研究与开发,2010,31(1):135—137.
[9]GB5413.37-2010食品安全国家标准乳和乳制品中黄曲霉毒素M1的测定[S].北京:中国标准出版社,2010.
[10]杨冀州,魏蔚,祝伟霞,等.高效液相色谱-电喷雾三级四极杆质谱测定苹果、山楂、番茄制品中棒曲霉素的研究[J].食品科学,2009,30(4):162—165.
[11]廉慧锋,赵笑天,王蓉珍,等.超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9种真菌毒素[J].食品科学,2010,31(20):360—366.
[12]许勇,王少敏,郑荣,等.高效液相色谱-串联三重四极杆质谱分析法测定刀豆中黄曲霉毒素G2、G1、B2、B1[J].中国卫生检验,2011,21(1):41—43.
[13]韩深,刘萤,吕美玲,等.免疫亲和萃取 超高效液相色谱 串联质谱法分离测定中成药及中药材中的5种黄曲霉毒素[J].色谱,2011,29(7):613—617.
[14]张升,赵晓联,赵春城,等.黄曲霉毒素M1的危害、污染现状及检测方法进展[J].中国卫生检验,2004,14(3):266—269.

