血清AFU和ADA联合检测在2型糖尿病控制中的临床意义
王璐璐 逄曙光 段光兰 黄仙萍 陆 勇 姜 强 王聪聪 李 梅 李友梅
(山东大学医学院,山东 济南 250012)
2型糖尿病是最常见的慢性疾病之一,早期症状并不明显,在国外有“沉默的杀手”之称。一旦患者血糖控制不佳就会引发多种并发症(脑血管病变、肾衰竭和下肢坏疽等),成为致死致残的主要原因。因此对2型糖尿病患者的血糖控制和病情监测尤为重要。α-L-岩藻糖苷酶(AFU)和腺苷脱氨酶(ADA)的检测,过去主要侧重于研究原发性肝癌的早期诊断价值〔1,2〕。近来有文献报道AFU或ADA活性升高与2型糖尿病有关〔3~6〕。然而联合检测AFU和ADA活性在2型糖尿病患者病情控制中的作用罕有相关报道。由于AFU和ADA水平分别与表皮细胞功能紊乱和胰岛素抵抗有关,因此可以进一步研究AFU和ADA活性在2型糖尿病血糖控制和病情监测中的作用。本文收集2型糖尿病434例,对AFU、ADA与2型糖尿病病人HbA1c和FBG进行相关性分析,以探讨2型糖尿病患者联合检测AFU和ADA的临床意义。
1 对象与方法
1.1 对象与分组 选取2010年1月1日至2011年12月31日济南市中心医院内分泌科住院的2型糖尿病患者434例(男性213例,女性221例),年龄(50.3±14.2)岁。按照2010年ADA糖尿病诊断新指南作为2型糖尿病诊断标准。将2型糖尿病患者按 HbA1c水平进行如下分组:血糖控制良好组(HbA1c<7.0%)共 171例;血糖控制一般组(7.0%≤HbA1c≤9.0%),共179例;血糖控制不良组(HbA1c>9.0%),共84例。正常对照组为性别与年龄相匹配的同期健康体检人员,共94例(男性50例,女性44例),年龄(48.5±8.6)岁。所有患者行肝功能检测排除肝病病史,B超检查无肝内占位性病变,近3个月内无服用严重影响肝代谢的药物及食物,无手术、严重应激及感染病史。
1.2 方法 使用真空采血管于清晨采集空腹静脉血,及时分离血清。采用拜尔2400生化仪器测定AFU和ADA,其中AFU采用连续检测法测定,参考范围为0~40 U/L;ADA采用速率法测定,参考范围4~22 U/L。中佳公司的Gc1200仪器测定空腹血糖(FPG),参考范围3.9~6.1 mmol/L。Bio-Rad D10全自动糖化血红蛋白仪测定糖化血红蛋白,采用离子交换高效液相色谱(HPLC)的原理,参考范围为4% ~6%。
1.3 统计学处理 采用SPSS18.0软件进行统计分析。检测数据呈正态分布,计量资料用±s表示,血糖水平对 A FU、ADA的影响应用单因素方差分析,两两比较采用SNK-q检验和Dunnett-t检验。各变量间相关性采用Pearson相关分析。
2 结果
2.1 各组相关指标 见表1。2型糖尿病组和正常对照组FPG、HbA1c、AFU水平和ADA活性差异显著(P<0.05)。
表1 糖尿病各组之间和正常对照组相关指标比较(±s)
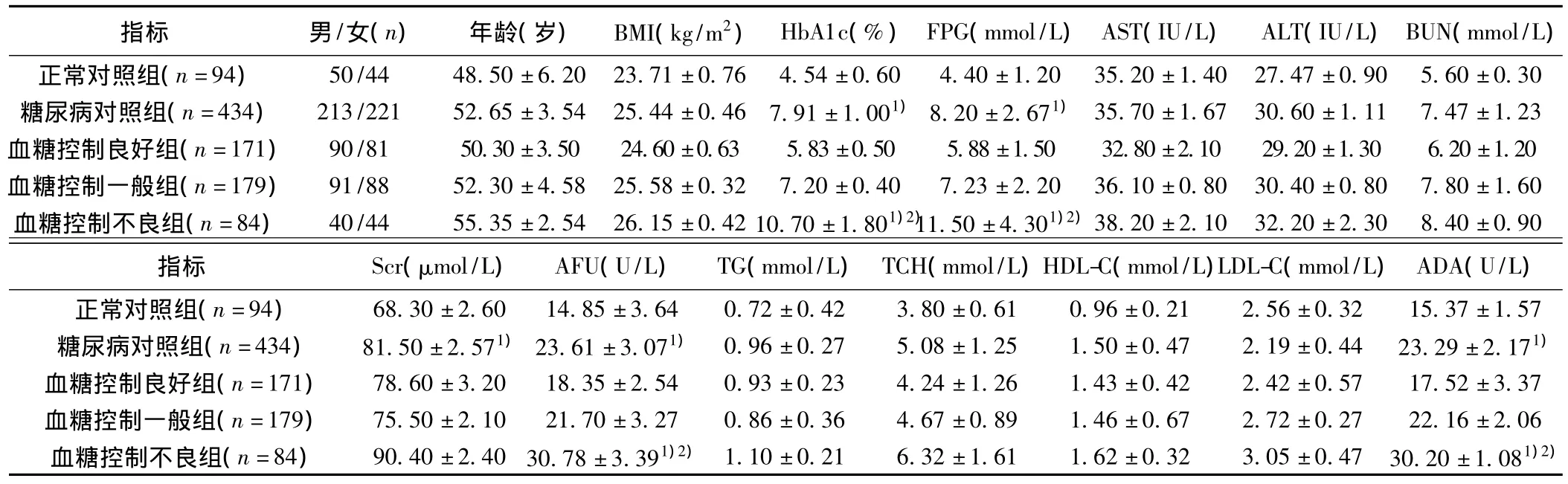
表1 糖尿病各组之间和正常对照组相关指标比较(±s)
与正常对照组比较:1)P<0.05;2)P<0.01
指标 男/女(n) 年龄(岁) BMI(kg/m2)HbA1c(%)FPG(mmol/L)AST(IU/L) ALT(IU/L)BUN(mmol/L)正常对照组(n=94) 50/44 48.50±6.20 23.71±0.76 4.54±0.60 4.40±1.20 35.20±1.40 27.47±0.90 5.60±0.30糖尿病对照组(n=434) 213/221 52.65±3.54 25.44±0.46 7.91±1.001)8.20±2.671) 35.70±1.67 30.60±1.11 7.47±1.23血糖控制良好组(n=171) 90/81 50.30±3.50 24.60±0.63 5.83±0.50 5.88±1.50 32.80±2.10 29.20±1.30 6.20±1.20血糖控制一般组(n=179) 91/88 52.30±4.58 25.58±0.32 7.20±0.40 7.23±2.20 36.10±0.80 30.40±0.80 7.80±1.60血糖控制不良组(n=84) 40/44 55.35±2.54 26.15±0.42 10.70±1.801)2)11.50±4.301)2)38.20±2.10 32.20±2.30 8.40±0.90指标 Scr(μmol/L) AFU(U/L) TG(mmol/L)TCH(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)ADA(U/L)正常对照组(n=94) 68.30±2.60 14.85±3.64 0.72±0.42 3.80±0.61 0.96±0.21 2.56±0.32 15.37±1.57糖尿病对照组(n=434) 81.50±2.571)23.61±3.071) 0.96±0.27 5.08±1.25 1.50±0.47 2.19±0.44 23.29±2.171)血糖控制良好组(n=171) 78.60±3.20 18.35±2.54 0.93±0.23 4.24±1.26 1.43±0.42 2.42±0.57 17.52±3.37血糖控制一般组(n=179) 75.50±2.10 21.70±3.27 0.86±0.36 4.67±0.89 1.46±0.67 2.72±0.27 22.16±2.06血糖控制不良组(n=84) 90.40±2.40 30.78±3.391)2) 1.10±0.21 6.32±1.61 1.62±0.32 3.05±0.47 30.20±1.081)2)
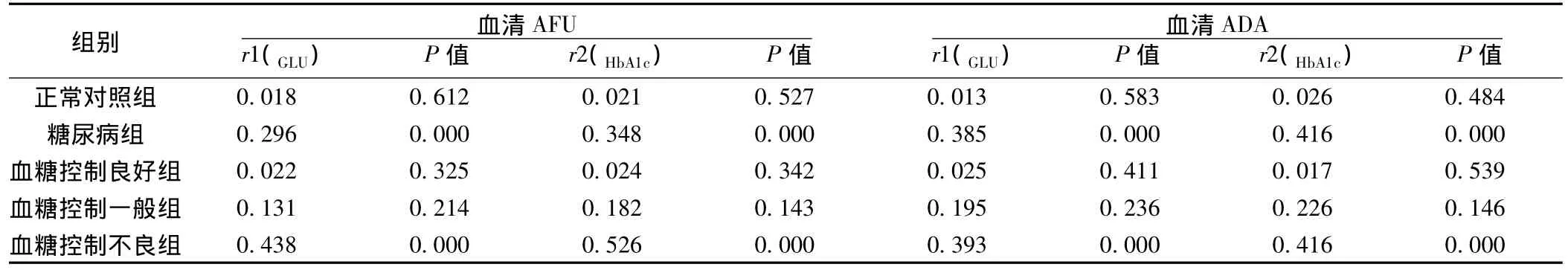
表2 血清AFU、ADA与HbA1c、GLU相关性分析

表3 血清AFU、ADA与各项指标相关性分析
2.2 糖尿病各组和正常对照组相关指标对比 见表1。2型糖尿病患者AFU和ADA活性高于正常对照组(P<0.05),尤其是血糖控制不良组,AFU、ADA活性显著高于正常对照组,差异有统计学意义(P<0.01);虽然在血糖控制一般组和血糖控制良好组AFU和ADA比较差异无统计学意义(P>0.05),但是AFU、ADA活性仍高于正常对照组。以上结果表明AFU和ADA活性与血糖控制程度密切相关,血糖控制越差,AFU和ADA活性越高。
2.3 血清AFU和ADA活性与血糖控制程度相关性分析 见表2。与正常对照组血清AFU、ADA与GLU、HbA1c水平无显著线性相关关系(P>0.05),在糖尿病组血清 AFU、ADA与GLU、HbA1c水平有显著直线相关关系(P<0.05),尤其是血糖控制不良组 AFU、ADA与 GLU、HbA1c有显著相关性(P<0.01),而血糖控制一般组与控制良好组AFU与GLU、HbA1c水平无显著直线相关关系(P>0.05)。
2.4 血清AFU、ADA活性与各项指标相关性分析 见表3。由表3可知AFU和ADA活性与其他各项指标(包括受试对象性别、年龄、等)之间的相关性分析表明,AFU和ADA活性分别与FPG、HbA1c、ALT和AST呈正相关关系,有显著的统计学差异。而且糖尿病患者血糖控制指标(FPG、HbA1c)与AFU和ADA活性显著呈正相关关系。
3 讨论
糖尿病患病率呈逐年上升趋势,目前每年有400万人因糖尿病死亡。据统计到2030年全世界大约有4.4亿糖尿病患者〔7〕。2型糖尿病占糖尿病的90%以上,是以靶组织对胰岛素敏感性降低导致胰岛素相对缺乏和胰腺β细胞破坏导致胰岛素绝对缺乏为特征的疾病。由于2型糖尿病发病具有隐匿性,许多病人发现时已处于血糖失控状态,临床上多以糖化血红蛋白作为糖尿病病情控制的指标。α-L-岩藻糖苷酶(AFU)是一种溶酶体酸性水解酶,广泛存在于人体的肝、肾、脑等组织,其生理功能是催化含有岩藻糖基的糖蛋白、糖脂和黏多糖的分解代谢,黏多糖代谢紊乱是糖尿病晚期并发症的重要病理改变〔8〕,因此参与细胞外基质降解的溶酶体酶的活性,与糖尿病病情进展关系密切。腺苷酸脱氨酶(ADA)是一种与能量代谢、机体细胞免疫活性有重要关系的核酸代谢酶。ADA作为细胞介导免疫活性的标志物,在淋巴结、脾和胸腺等淋巴系统中活性最高〔9〕。腺苷酸作为腺嘌呤核苷酸的降解产物,对调节和糖代谢有关的胰岛素活性有重要作用〔10〕。本研究发现AFU和ADA活性在糖尿病患者中明显升高,并且与糖尿病患者的血糖控制密切相关,这与国内外许多研究结果一致〔3~6〕。因此联合检测AFU和ADA可以作为糖尿病患者血糖控制和病情进展的又一重要指标。
本文结果表明2型糖尿病患者AFU和ADA活性显著升高,并且AFU和ADA活性与血糖控制程度有关。血糖控制不良组,AFU、ADA活性显著高于正常对照组;即使血糖控制一般组和血糖控制良好组AFU和ADA比较差异无统计学意义,AFU、ADA活性仍高于正常对照组。由AFU和ADA水平与糖尿病患者各项指标相关性分析表明,AFU和ADA活性分别与FPG、HbA1c、ALT和AST呈正相关。糖尿病患者血糖控制指标(FPG、HbA1c)尤其是血糖控制不良组,与AFU和ADA活性呈显著正相关。
目前糖尿病患者血清AFU升高的具体机制尚不明确,可能的原因是:(1)在糖尿病的病情进展中,由于过度氧化应激、蛋白激酶C激活和糖基化终末产物的形成等一系列病理生理改变导致血管内皮的损伤〔11,12〕。血管内皮的损伤会引起某些生长因子和细胞因子的释放,这可以引起黏多糖生物合成的改变。AFU作为溶酶体酸性水解酶,其活性改变或许与黏多糖代谢紊乱有关。(2)持续高血糖激活多元醇旁路途径,醛糖还原酶活性增加,山梨醇生成增加,在细胞内大量聚集;而AFU主要存在于细胞溶酶体中,山梨醇对溶酶体有很强的亲和力,可导致溶酶体破坏,使AFU释放入血〔3〕。因此在临床诊断治疗中,测定AFU的活性可作为糖尿病患者血糖控制的又一个良好观察指标。
ADA可以调节细胞内外腺苷酸的浓度,腺苷酸通过影响葡萄糖转运、脂质合成和丙酮酸激酶的活性刺激胰岛素活性。ADA是调节胰岛素生物活性的重要酶。Prakash等〔5〕提出2型糖尿病患者ADA活性升高是由于自身免疫的改变。本文结果表明ADA活性与血糖水平呈正相关关系。糖尿病患者持续高血糖水平可能与 DPP-Ⅳ活性升高有关〔13~15〕。DPP-Ⅳ作为ADA结合蛋白,血糖升高可以激活DPP-Ⅳ-ADA复合物,从而导致ADA活性的升高。ADA活性越高,腺苷酸促进葡萄糖吸收就会受到抑制。同时由于ADA代谢终产物是尿酸,ADA活性升高或许与糖尿病早期肾损害有关。
因此,应用和推广AFU作为2型糖尿病血糖控制和病情监测的指标,具有重要的意义。因与ADA无明显相关可互相判断病情进展,联合检测更有助于对患者病情进展程度的判断。
综上所述,血清AFU、ADA与FPG和HbA1c联合检测成为2型糖尿病病血糖制和病情监测好坏的重要指标,为临床提供了近期、纵向、全程的血糖水平信息,对观察2型糖尿病患者的发展转归有一定的指导意义,为指导临床提供更为合理的治疗方案。
1 Fawzy MM,Amin SM,Omar KM,et al.Alpha-L-fucosidase as a tumour marker of hepatocellular carcinoma〔J〕.Arab J Gastroenterol,2012;13(1):9-13.
2 徐万清,龚杨彬,肖 毅.血清ADA、TBA和AFU联合检测在肝脏疾病临床诊疗中的价值〔J〕.中国卫生检验杂志,2011;10(21):2480-4.
3 张 可.α-L-岩藻糖苷酶测定在糖尿病诊断中的应用〔J〕.检验医学与临床,2011;8(18):2258-9.
4 陈 赛,罗春华.α-L-岩藻糖苷酶在糖尿病患者病情监测中的作用〔J〕.华中医学杂志,2008;32(1):25.
5 Prakash MS,Chennaiah S,Murthy YS,et al.Altered adenosine deaminase activity in type 2 diabetes mellitus〔J〕.JIACM,2006;7(2):114-7.
6 Kurtul N,Pence S,Akarsu E,et al.Adenosine deaminase activity in the serum of type 2 diabetic patients〔J〕.Acta Medica(Hradec Kralove),2004;47(1):33-5.
7 Shaw JE,Sicree RA,Zimmet PZ.Global estimates of the prevalence of diabetes for 2010 and 2030〔J〕.Diabetes Res Clin Pract,2010;87(1):4-14.
8 Komosińska-Vassev K,Olczyk K,Koama EM.Alterations of glycosaminoglycan metabolism in the development of diabetic complications in relation to metabolic control〔J〕.Clin Chem Lab Med,2005;43(9):924-9.
9 Hashemi M,Karami TF,Gavami S,et al.Adenosine deaminase activities in the estrogen receptor positive and negative human breast cancer cell lines〔J〕.Med J Islamic Rep Iran,2005;19(1):53-6.
10 Mokhtari M,Hashemi M,Yaghmaei M,et al.Serum adenosine deaminase activity in gestational diabetes mellitus and normal pregnancy〔J〕.Arch Gynecol Obstet,2010;281(4):623-6.
11 Hartnett ME,Stratton RD,Browne RW,et al.Serum markers of oxidative stress and severity of diabetic retinopathy〔J〕.Diabetes Care,2000;23(2):234-40.
12 Rellier N,Ruggiero-LD,Lagarde M,et al.In vitro and in vivo alterations of enzymatic glycosylation in diabetes〔J〕.Life Sci,1999;64(17):1571-83.
13 Mannucci E,Pala L,Ciani S,et al.Hyperglycaemia increases dipeptidyl peptidase Ⅳ activity in diabetes mellitus〔J〕.Diabetologia,2005;48(6):1168-72.
14 Ryskjaer J,Deacon CF,Carr RD,et al.Plasmadipeptidyl peptidase-Ⅳactivity in patients with type-2 diabetes mellitus correlates positively with HbAlc levels,but is not acutely affected by food intake〔J〕.Eur J Endocrinol,2006;155(3):485-93.
15 Bopp A,De Bona KS,Bellé LP,et al.Syzygium cumini inhibits adenosine deaminase activity and reduces glucose levels in hyperglycemic patients〔J〕.Fundam Clin Pharmacol,2009;23(4):501-7.

