翘鳞肉齿菌多糖的抗氧化活性分析
郑 义 ,王卫东,孙月娥,朱园园,郭 静
1徐州工程学院食品(生物)工程学院;2江苏省食品资源开发与质量安全重点建设实验室,徐州 221000
翘鳞肉齿菌(Sarcodon aspratus),属担子菌亚门、层菌纲、非褶菌目、齿菌科,子实体似虎掌生长在地上,外表具浅黄褐色茸毛和虎皮纹路,故俗称黑虎掌菌。卯小岚[1]在《中国大型真菌》中提到翘鳞肉齿菌子实体中含有较丰富的多糖类物质。子实体还含有丰富的蛋白质、氨基酸、微量元素等营养成分。翘鳞肉齿菌多糖具有一定的药理作用,通过诱导小鼠脾细胞分泌肿瘤坏死因子-α和NO[2]、刺激小鼠淋巴细胞增殖[3],而表现出较好的抗肿瘤和免疫调节功能,此外还具有抗病毒、抑菌的作用。目前对翘鳞肉齿菌多糖抗氧化活性的研究鲜见报道。本实验以翘鳞肉齿菌子实体为研究对象,采用不同体积分数乙醇分级沉淀多糖,分析翘鳞肉齿菌多糖的抗氧化活性,以期为翘鳞肉齿菌多糖开发利用提供理论依据。
1 材料与方法
1.1 仪器与设备
TU-1810紫外-可见分光光度计,北京普析通用仪器有限责任公司;THZ-82恒温振荡器,常州国华电器有限公司;标准检验筛,浙江上虞华美仪器纱筛厂;风选中药粉碎机,山东省青州市精诚机械制造有限公司;FA2104N电子分析天平,上海精密科学仪器有限公司;SENCO R201L旋转蒸发器,上海申生科技有限公司;SIGMA 3K30高速冷冻离心机,Sigma公司。
1.2 材料与试剂
翘鳞肉齿菌购自云南丽江市云麓商贸有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma 公司;其它试剂均为国产分析纯。
1.3 翘鳞肉齿菌多糖的提取
将翘鳞肉齿菌用清水洗净,适当切块,50℃下干燥,恒重后粉碎,过60目筛,干燥保存待用。称取翘鳞肉齿菌子实体干粉200 g,加适量水(液料比30 mL/g),85℃水浴3 h,即得多糖提取液。多糖提取液进行减压抽滤、浓缩、4℃下醇析、离心、干燥后得沉淀,所得沉淀用体积分数75%乙醇洗涤两次后,冷冻干燥后得翘鳞肉齿菌粗多糖。翘鳞肉齿菌粗多糖采用Sevag法脱蛋白。然后用自来水透析48 h,蒸馏水透析24 h。透析液浓缩后冷冻干燥得翘鳞肉齿菌多糖。
1.4 翘鳞肉齿菌多糖的乙醇分级沉淀
翘鳞肉齿菌多糖加适量的水复溶,制成多糖水溶液,依次用体积分数为30%、40%、50%、60%、70%的乙醇于4℃冰箱中分级沉淀。冷冻干燥后得翘鳞肉齿菌多糖组分 SAP-1、SAP-2、SAP-3、SAP-4和SAP-5,备用。称量各组分0.5 g,用蒸馏水配制成20 g/L母液,4℃保存,备用。
1.5 抗氧化活性测定
1.5.1 DPPH自由基清除率测定
DPPH自由基清除率测定参考Wu的方法[4],将 SAP-1、SAP-2、SAP-3、SAP-4 和 SAP-5 母液用蒸馏水稀释至不同的质量浓度(0.01~0.25 g/L),制备成翘鳞肉齿菌多糖样品溶液。分别移取各样品溶液样液1.5 mL,再加入 1.5 mL 含 0.1 mmol/L DPPH的95%乙醇,混合、振荡,在室温下避光放置30 min,然后在波长517 nm处检测吸光度。以Vc作为阳性对照。
清除率计算公式如下:

式中,Ac为对照组吸光值,1.5 mL蒸馏水加1.5 mL含0.1 mmol/L DPPH的95%乙醇;Ai为样品组吸光值,1.5 mL 样品液加1.5 mL 含0.1 mmol/L DPPH的95%乙醇;Aj为空白组吸光值,1.5 mL样品液加1.5 mL 95%乙醇。
1.5.2 还原力测定
还原力测定方法采用Oyaizu[5]报道的方法。量取不同质量浓度(0.01~0.1 g/L)的样液2 mL,加入0.2 mol/L pH 6.6的磷酸缓冲液2 mL,质量分数为1%(w/w)的铁氰化钾[K3Fe(CN)6]溶液2 mL,混匀,50℃水浴下保温20 min,再加入10%(w/w)的三氯乙酸(TCA)溶液2 mL,震荡混匀后,以3000 rpm离心10 min。取离心后的上清液2 mL,加入2 mL 去离子水和0.4 mL 0.1%(w/w)的 FeCl3溶液,震荡混匀后在50℃水浴下保温10 min,当体系溶液颜色由黄色变为蓝色时,在波长700 nm下测定其吸光度值A700,样品吸光值越大则其还原能力越大。以去离子水代替样品作为空白对照,Vc作为阳性对照。
1.5.3 羟基自由基清除率测定
羟基自由基清除率测定采用邻二氮菲比色法[6]。样品溶液质量浓度为 0.01~10 g/L,以 Vc作为阳性对照。
损伤管:取0.5 mL 0.75 mmol/L 邻二氮菲的无水乙醇溶液加入1 mL 0.15 mol/L的磷酸盐缓冲液(pH 7.40)和0.5 mL去离子水,充分混匀后加入0.5 mL 0.75 mmol/L 的 FeSO4,混匀后再加入 0.5 mL 0.01%(V/V)的 H2O2,37 ℃水浴60 min 后,536 nm下测其吸光值为A损;未损伤管:以0.5 mL去离子水代替损伤管中的H2O2,重复上述操作步骤,测其吸光值为A未损;样品管:0.5 mL样品溶液代替损伤管中的去离子水,测其吸光值为A样;样品参比:取1 mL 0.15 mol/L 的磷酸盐缓冲液(pH 7.40)和0.5 mL样品溶液混合,加入1.5 mL去离子水,不需水浴,测其吸光值为 A参;空白参比:取1 mL 0.15 mol/L的磷酸盐缓冲液(pH 7.40)加入2 mL去离子水,作为空白调零A空,计算不同样品对羟基的清除率:

1.5.4 铁离子螯合能力测定
铁离子鳌合能力的测定采用 Decker[7]的方法,略有改动。在2 mL不同质量浓度(0.5~20 g/L)的样品溶液中,加入0.02 mL 5 mmol/L的FeCl2,再加0.2 mL 5 mmol/L Ferrozine,室温下静置 10 min,加入等体积的蒸馏水,摇匀,于562 nm下测量吸光度。上述反应体系中,以蒸馏水替代样品溶液作为空白对照,EDTA作为阳性对照。每个样品平行测定3次,取其平均值。铁离子鳌合能力计算公式如下:
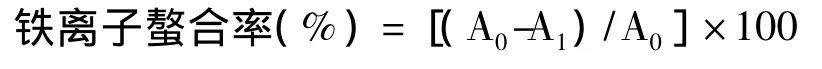
式中,A0为空白对照的吸光度;A1为样品或阳性对照的吸光度。
2 结果与分析
2.1 清除DPPH自由基的能力
DPPH法是评价抗氧化活性的常用方法,抗氧化物质可直接作用于DPPH自由基,使其颜色变浅,根据吸光度的变化可测定物质的抗氧化活性。由图1可知,在测定的质量浓度范围,翘鳞肉齿菌各个多糖组分对DPPH自由基的清除能力呈现出剂量依赖性,清除DPPH自由基的能力随着质量浓度的增大而增大。
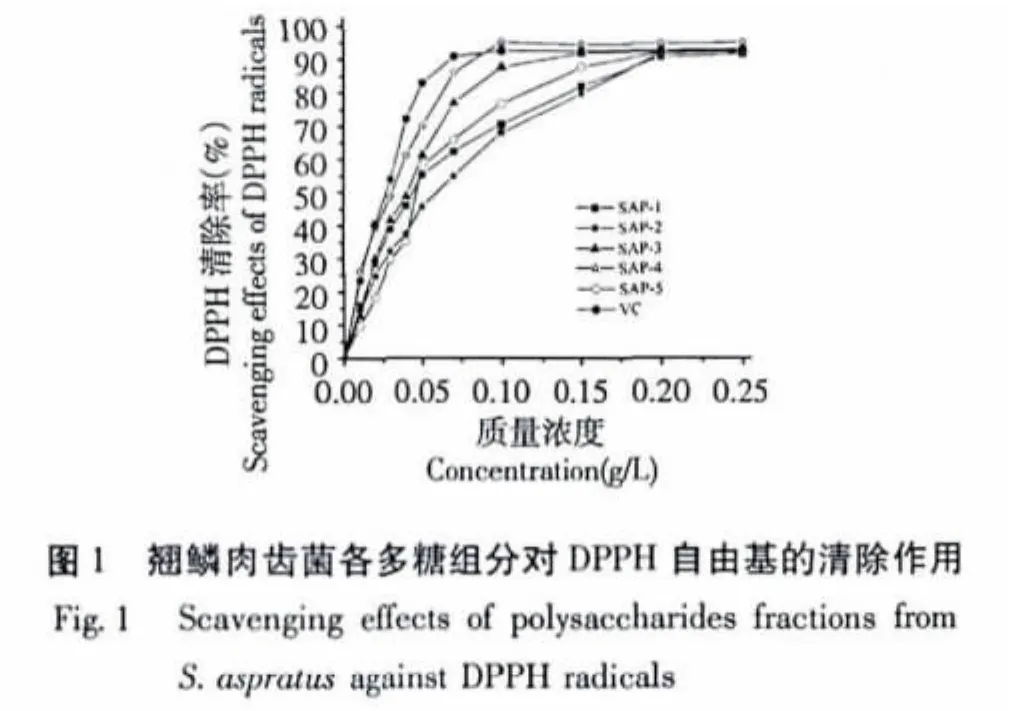
质量浓度为0.05 g/L时,翘鳞肉齿菌的5个多糖组分中,SAP-4的清除率最高,为70.02%,SAP-3次之,为61.19%,SAP-1、SAP-2和 SAP-5的清除率分别为55.24%、45.75%和 58.12%。质量浓度为0.1 g/L 时,SAP-4 的清除率为94.97%,SAP-3 的清除率为87.62%,其余组分的清除率均在80%以下。质量浓度为0.2 g/L时,5个组分的清除率均达到90%以上,SAP-4的清除率仍为最高,达94.97%。由此可见,SAP-4具有较强的清除DPPH自由基的能力,其次是SAP-3。当质量浓度低于0.1 g/L时,各个组分对DPPH自由基的清除能力均低于阳性对照Vc;而当质量浓度高于0.1 g/L时,SAP-4的清除率高于Vc。
EC50值是指清除率为50%时的样品质量浓度,EC50值可作为评价抗氧化能力的重要参数。如某种物质的EC50值低于10 g/L,则表明其具有很好的抗氧化活性[8]。采用Logit回归可分别计算出各多糖组分及Vc的EC50值(表1)。各多糖组分中,SAP-4的 EC50值最小,为 0.029 g/L,其次是 SAP-3,为0.037 g/L。由EC50值可判断5个组分对DPPH自由基均具有较强的清除能力,其强弱顺序为:SAP-4> SAP-3> SAP-5> SAP-1> SAP-2。Vc的EC50值为0.024 g/L,由此表明SAP-4清除DPPH自由基的能力与Vc基本相当。
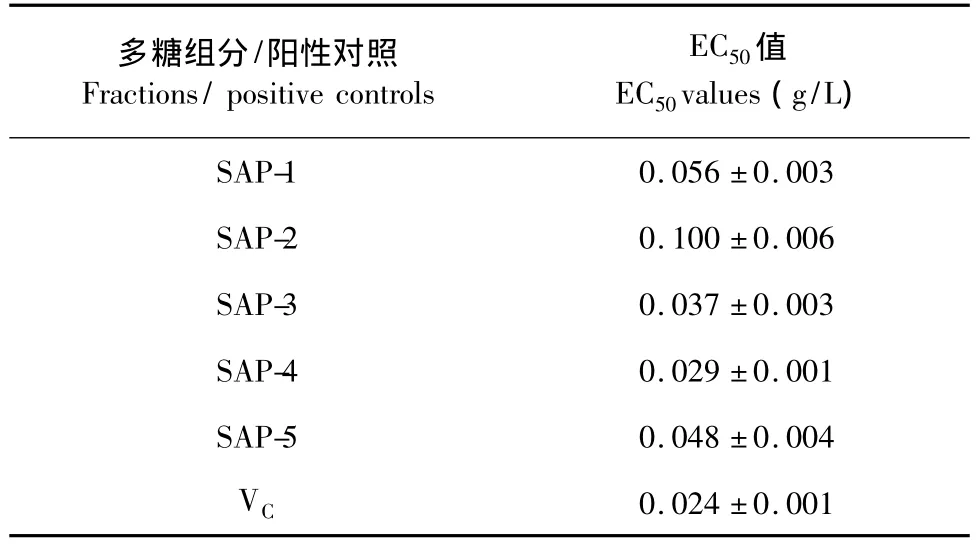
表1 翘鳞肉齿菌各多糖组分对DPPH自由基清除能力的EC50值Table 1 EC50values of polysaccharides fractions from S.aspratus on DPPH radical scavenging effects
有关真菌多糖清除DPPH自由基能力已有较多报道,刘剑利等[9]对质量浓度均为0.1 g/L的粗提液、醇沉、离子交换和凝胶过滤等四种不同纯化阶段的香菇菌丝体多糖进行DPPH自由基清除率比较,结果表明四种纯化阶段的多糖的清除率分别为9.61%、21.33%、43.58% 和 65.06%。由此可见,翘鳞肉齿菌多糖的各个组分对DPPH自由基的清除能力均显著高于香菇菌丝体多糖,说明翘鳞肉齿菌多糖具有较强的抗氧化活性。
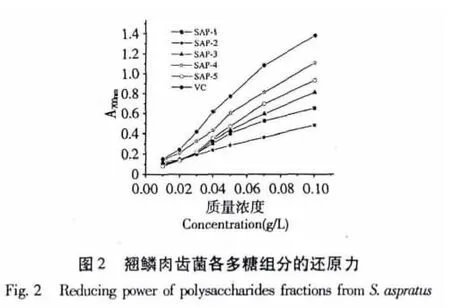
2.2 还原力
抗氧化物质的抗氧化活性与其还原力存在着直接的联系,还原力越强,抗氧化性越强。由图2可知,在0.01~0.1 g/L的质量浓度范围内,翘鳞肉齿菌各多糖组分的还原力随着浓度的增加而增加,其中SAP-4的还原力最强,当浓度为0.05 g/L时,吸光度为0.603;当浓度为0.1 g/L时,吸光度则达到了1.108。而在0.05 g/L时,阳性对照Vc的吸光度为0.772,浓度为 0.1 g/L 时,吸光度为 1.381。对于分光光度法而言,吸光度高于1.0之后测量结果的相对误差较大,故不再进一步加大多糖质量浓度。在已测量的质量浓度范围内,5个多糖组分及Vc的还原能力大小的顺序为:Vc>SAP-4>SAP-5>SAP-3>SAP-1>SAP-2。
2.3 清除羟基自由基的能力
翘鳞肉齿菌多糖对羟基自由基的清除作用如图3所示,在0.01~10 g/L的质量浓度范围内,翘鳞肉齿菌各多糖组分对羟基自由基的清除能力随质量浓度增大而增大,当质量浓度超过1 g/L后,增幅趋于平缓。测定的质量浓度范围内,各组分清除羟基自由基的能力均较低,在浓度为5 g/L时,SAP-2和SAP-4的清除率相对较高,分别为 18.92%、18.22%;浓度升高到10 g/L时,各个组分的清除率均未达到 50%,SAP-2和 SAP-4的清除率为26.63%、22.49%。
Chen等[10]通过DEAE-纤维素离子交换柱和琼脂糖凝胶CL-6B柱从香菇多糖中分离得到3个组分LEPA1、LEPB1和LEPC1,在质量浓度为4 g/L时,3个组分对羟基自由基的清除率分别为74.2%、90.1%和90.6%。由此可见,与香菇多糖相比,翘鳞肉齿菌多糖清除羟基自由基的能力较弱。

2.4 铁离子螯合能力
铁离子在生物体内能够引发脂质过氧化,并导致羟基自由基的产生,因此铁离子鳌合能力也是一种重要的评价抗氧化能力的指标。Ferrozine能够定量的与Fe2+结合形成红色配合物,当有螯合剂(如EDTA、抗氧化物质)存在时,这一过程就会被干扰,导致红色配合物的生成量减少,一定波长(700 nm)下的吸光度降低,据此可评价抗氧化物质对铁离子的鳌合能力。翘鳞肉齿菌的5个多糖组分对铁离子的螯合能力如图4所示。
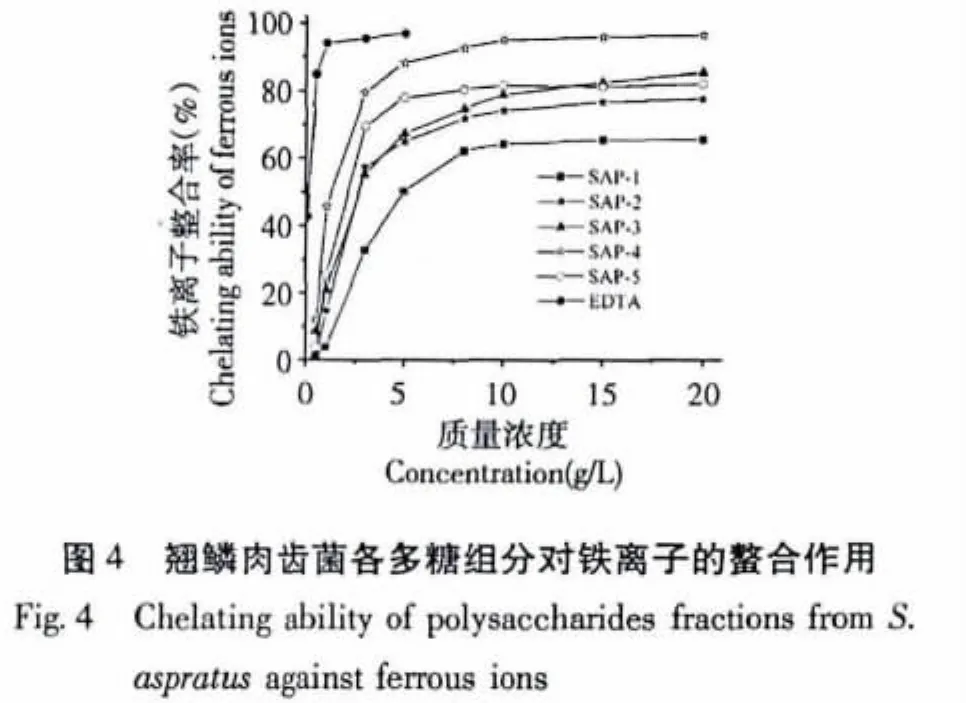
在质量浓度为0.5~20 g/L的范围内,各个组分对铁离子的螯合能力随着质量浓度的增大而增大。质量浓度为3 g/L时,SAP-4对铁离子的螯合能力最大,为69.79%,SAP-5的螯合能力与SAP-4接近,为69.67%;质量浓度为5 g/L时,SAP-4对铁离子的螯合能力仍然最大,为82.06%,其余组分均未达到80%;质量浓度为10 g/L时,铁离子螯合能力大小依次为:SAP-4(94.92%)>SAP-5(83.67%)> SAP-3(78.94%)> SAP-2(74.23%)> SAP-1(69.38%)。质量浓度为20 g/L时,SAP-4螯合率为96.43%,其余组分未达到90%,各组分对铁离子螯合能力的大小与10 g/L的顺序一致。
各多糖组分及阳性对照EDTA对铁离子螯合能力的EC50值如表2所示。根据EC50值,各组分对铁离子螯合能力大小依次为SAP-4>SAP-5>SAP-2>SAP-3>SAP-1,与上述结果基本类似。各组分的EC50值均高于 EDTA(0.281 g/L),但都低于10 g/L,表明各个组分具有较高的螯合铁离子的能力。
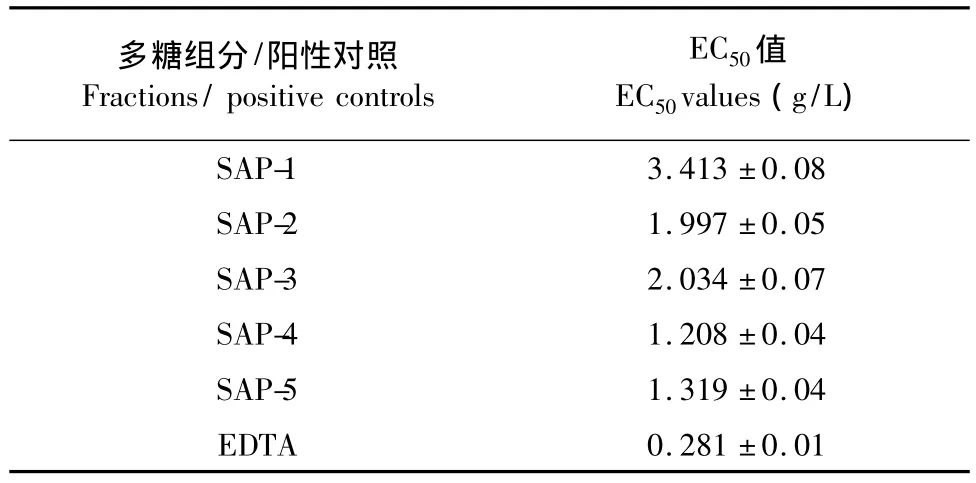
表2 翘鳞肉齿菌各多糖组分对铁离子螯合能力的EC50值Table 2 EC50values of polysaccharides fractions from S.aspratus of ferrous ions chelating ability
3 结论
乙醇分级沉淀得到的翘鳞肉齿菌多糖各个组分均表现出较好的抗氧化活性,SAP-4的抗氧化能力最强。在测定的质量浓度范围,各个组分对DPPH自由基的清除能力均随质量浓度增大而增大,SAP-4清除DPPH自由基的能力最强,EC50值为0.029 g/L,与阳性对照 Vc基本相当。在0.01~0.1 g/L的质量浓度范围内,翘鳞肉齿菌各多糖组分的还原力随着浓度的增加而增加,其中SAP-4的还原力最强,浓度为0.1 g/L时,吸光度为1.108。各组分清除羟基自由基的能力均较低,在质量浓度为10 g/L时,各个组分的清除率均未达到50%。5个多糖组分具有较高的螯合铁离子能力,SAP-4对铁离子的螯合能力最强,EC50值为 1.208 g/L。
1 Mao XL(卯小岚).The Macrofungi in China(中国大型真菌).Zhengzhou:Henan Science and Technology Press,2000:421.
2 Mizuno M,Shiomi Y,Minato K,et al.Fucogalactan isolated from Sarcodon aspratus elicits release of tumor necrosis factor-alpha and nitric oxide from murine macrophages.Int J Immunopharmacol,2000,46:113-121.
3 Han XQ,Chai XY,Jia YM,et al.Structure elucidation and immunological activity of a novel polysaccharide from the fruit bodies of an edible mushroom,Sarcodon aspratus(Berk.)S.Ito.Int J Biol Macromol,2010,47:420-424.
4 Wu HC,Chen HM,Shiau CY.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus).J Food Nutr Res,2003,36:949-957.
5 Oyaizu M.Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography.J Jpn Soc Food Sci,1988,35:771-775.
6 Yen GC,Hsieh PP.Antioxidative activity and scavenging effects on active oxygen of xylose-lysine maillard reaction products.J Sci Food Agric,1995,67:415-420.
7 Decker EA,Welch B.Role of ferritin as a lipid oxidation catalyst in muscle food.J Agr Food Chem,1990,38:674-677.
8 Lee J,Koo N,Min DB.Reactive oxygen species,aging,and antioxidative nutraceuticals.Compr Rev Food Sci F,2004,3:21-33.
9 Liu JL(刘剑利),Cao XY(曹向宇),Lu XL(芦秀丽),et al.Extraction optimization,purification and antioxidant activity of polysaccharide from Lentinus edodes mycelium.Food Sci(食品科学),2011,32(12):19-23.
10 Chen H,Ju Y,Li J,et al.Antioxidant activities of polysaccharides from Lentinus edodes and their significance for disease prevention.Int J Biol Macromol,2012,50:214-218.

