水飞蓟宾乳糖苷的合成、表征及抗氧化活性研究
汪艳丽,余燕影,曹树稳
南昌大学化学系,南昌 330031
水飞蓟宾是从水飞蓟的果实种皮中提取分离出来的一种黄酮木脂素类化合物。现代药理学研究表明,水飞蓟宾具有保肝(抗肝纤维化、保护肝细胞膜、促进肝细胞的修复再生)、抗癌及抗氧化等生物活性[1-3]。由于水飞蓟宾存在水溶性较差,作用靶点多等缺陷,使其临床应用受到一定的限制。因此对水飞蓟宾进行结构修饰,对提高其水溶性、生物利用度,增强其生物活性具有重要的意义。
有关水飞蓟宾化学修饰改善其水溶性主要有酯化、糖苷化和成盐等途径[4],本实验室前期对水飞蓟宾进行了酯化修饰,有效提高了水飞蓟宾的水溶性和抗氧化活性。糖基修饰可使母体活性先导化合物作用靶点专一化,可与前体药物发挥协同作用,有效提高药效、降低其毒副作用[5],乳糖不仅水溶性好,且有与肝实质细胞和肿瘤细胞表面受体定向结合的特性[6]。本文拟将水飞蓟宾进行乳糖修饰,以期提高其水溶性和生物活性,为水飞蓟宾临床用药提供理论依据。合成路线见图1

图1 水飞蓟宾乳糖苷的合成路线Fig.1 Synthetic routes of silybin lactosified derivatives
1 实验部分
1.1 仪器与材料
FTIR Nicolet5700傅里叶变换红外光谱仪(美国热电尼高力公司);AV-600型核磁共振仪(德国BRUKER公司);X-4显微熔点测定仪(河南豫华仪器有限公司)(温度计未校正);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);DZF-150数显小型恒温真空干燥箱(郑州长城科工贸有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);日立高效液相色谱仪(L-2500)(日立有限公司);ZQ24000/2695四极杆LC/MS联用仪(美国Waters公司)
水飞蓟宾(简称Sil,95%,辽宁盘锦格林恩生物资源开发有限公司);硅胶(200~300目,青岛海浪硅胶干燥剂厂);水溶性维生素E(Trolox,Sigma公司),其余试剂均为国产分析纯,所用水均为二次蒸馏水。
1.2 实验方法
1.2.1 全乙酰乳糖(1,2,3,6,2',3',4',6'-8-O-乙酰基-(-吡喃乳糖)的合成
制备全乙酰乳糖,收率90.19%。mp.136~138 ℃。IR(KBr),ν/cm-1:3433,1752,1620,1375,1217,1133,1046,901,605,548。1H NMR(DMSO-d6,600 MHz):5.88(d,1H,J=8.4 Hz),5.34(t,1H,J=9.0 Hz),5.23(dd,1H,J=3.6 Hz,J=1.2 Hz),5.16(dd,1H,J=10.2 Hz,J=3.6 Hz),4.86(m,2H),4.77(d,1H,J=7.8 Hz),4.28(d,1H,J=10.2 Hz),4.23(t,1H,J=6.6 Hz),4.03(m,4H),3.85(t,1H,J=9.0 Hz),2.10(s,3H,-OCCH3),2.06(s,3H,-OCCH3),2.04(s,3H,-OCCH3),2.00(s,3H,-OCCH3),1.99(s,3H,-OCCH3),1.98(d,J=1.2 Hz,6H,2 × -OCCH3),1.89(s,3H,-OCCH3)。
1.2.2 水飞蓟宾乙酰乳糖苷(简称Sil-LacAcO8)的合成
将3.8600 g(8 mmol)水飞蓟宾和8.1096 g(12 mmol)全乙酰乳糖溶于448 mL CH2Cl2-CH3CN(1∶1,v/v)。混合溶剂中,于25℃在氮气保护下搅拌,快速加入14 mL(152.5 mmol)BF3·Et2O,反应20 h后倾入冰NaHCO3饱和溶液中,用CH2Cl2萃取(150 mL×2),有机相用Na2SO4干燥,过滤除去固体,旋干溶剂。将粗产物与硅胶(200~300目)按1∶1.5拌样,硅胶柱层析,先用氯仿-甲醇(25∶2)混合溶剂进行淋洗除去未反应完的原料和杂质,再用甲苯-丙酮(20∶1)溶剂洗脱,收集最后组分洗脱液、浓缩、55℃真空干燥后得到白色粉末状目标产物I。产率为40.65%,经高效液相色谱归一法检测纯度为96.65%。
1.2.3 水飞蓟宾乳糖苷(简称Sil-Lac)的合成
将合成的目标产物I置于Et3N-MeOH-H2O(1∶8∶1)溶剂中,在35℃下反应24 h脱乙酰保护基。反应液减压浓缩后上硅胶(200~300目)柱层析,用乙酸乙酯-甲醇-水(10∶1∶0.6)溶剂洗脱,收集洗脱液,浓缩,真空干燥后得到淡黄色粉末状目标产物II。熔点为204 ~206℃,产率为23.65%,经高效液相色谱归一法检测纯度为95.42%。
1.2.4 清除DPPH自由基实验
参照文献[7]的方法,反应体系略作修改。取不同浓度(0.1、0.2、0.3、0.4、0.5 mmol/L)的待测样品甲醇溶液各0.5 mL于10 mL的比色管中,加入0.5 mL DPPH(0.6 mmol/L)甲醇溶液,用甲醇定容至5 mL,室温下避光放置30 min,于517 nm处测定混合物的吸光度,每组样品平行三次。
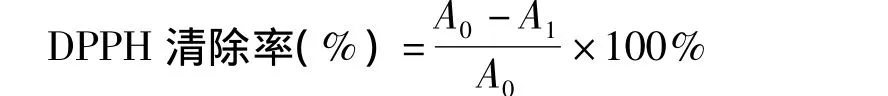
式中:A0为DPPH缓冲液的吸光值,A1为加入受试样品和DPPH混合液的吸光度。
1.2.5 还原能力测定
参照Singh等[8]的方法,反应体系略作修改。取不同浓度(0.2、0.4、0.6、0.8、1.0 mmol/L)的水飞蓟宾及水飞蓟宾乳糖修饰物溶液各2.5 mL于10 mL的比色管中,依次加入2.5 mL的磷酸缓冲液(0.2 mol/L、pH 6.6)和2.5 mL的铁氰化钾(1%)。混匀后,于50℃的水浴中保温反应20 min,准确取2.5 mL的上清液,加入2.0 mL蒸馏水以及0.5 mL的氯化铁溶液(0.1%),混合均匀后测定混合物在700 nm处的吸光度,吸光度值越大表明还原能力越强,每组样品进行三次平行实验。
1.2.6 ABTS+自由基清除能力的测定
参照文献 Re、R[9]的方法,反应体系略作修改。ABTS+储备液的配置:将7 mmol/L的ABTS水溶液与2.45 mmol/L的K2S2O8溶液混合,室温暗处放置12~16 h后方能使用。ABTS+工作液:使用前将ABTS+储备液用甲醇稀释,于734 nm处测定其吸光度值为0.70 ±0.02后便能使用。取不同浓度(0.05、0.10、0.15、0.20、0.25、0.30 mmol/L)的水飞蓟宾及其乳糖苷修饰物0.5 mL及ABTS+工作液5 mL,空白对照为甲醇,室温避光反应6 min后,于734 nm处测定吸光值。平行测定三次,结果为平均值±标准偏差。

其中A1为ABTS+加入甲醇混合液的吸光值,A2为ABTS+加入不同浓度受试样品混合液的吸光度。
1.2.7 大鼠肝微粒体脂质过氧化的测定
肝微粒体的制备[10]:Wistar大鼠,体重230 ~270 g,饥饿24 h左右,断颈处死,马上取出肝脏,用冷0.25 mol/L蔗糖(0.01 mol/L)Tris(pH 7.4)缓冲液冲洗,迅速放入冰水中,并用玻璃匀浆器研磨。4℃,10000 g,离心10 min,取上清于 4 ℃,100000 g,离心20 min,得到沉淀物即为大鼠肝微粒体。用磷酸钾缓冲液将微粒体重悬起即进行测试,或于-20℃保存。微粒体蛋白浓度用考马斯亮蓝法测定。
参照文献[11]报道方法,反应体系略作修改:分别配制浓度为 31.125、62.25、125、250、500 μmol/L的水飞蓟宾,水飞蓟宾-23乙酰乳糖苷,水飞蓟宾-23-乳糖苷和Trolox溶液。将1.0 mL线粒体悬液(蛋白含量在0.4 ~0.7 mg/mL),0.5 mL样品溶液,0.25 mL Fe2+溶液和0.25 mL维生素C依次加入10 mL比色管中,于37℃水浴中振荡孵育1 h后,加入20%TCA,随后加入2 mL 0.67%TBA,95℃的水浴,显色30 min后,3500 r/min离心10 min,取上清液,532 nm处测定其吸光值,每组实验平行三次。

式中A0为阳性组的吸光值,A1为受试样品组的吸光值。
2 结果与讨论
2.1 水飞蓟宾乙酰乳糖苷的谱学数据
MS m/z:1099 [M-H]-,IR(KBr),ν/cm-1:3467(OH),2943(CH3),1752(C=O),1641(C=O),1513(Ar-H),1435(Ar-H),1372(CH3),1231(CO-C),1165,1050(C-O-C),905,828,736,601;1H NMR(DMSO-d6,600 MHz)δ:11.88(d,1H,J=3.0 Hz,5-OH),10.86(s,1H,7-OH),9.16(s,1H,20-OH),7.09(d,1H,J=1.8 Hz,13-H),7.01(dd,1H,J=8.4 Hz,J=2.4 Hz,15-H),7.00(d,1H,J=1.8 Hz,18-H),7.17(d,1H,J=8.4 Hz,16-H),6.97(d,1H,J=8.4 Hz,22-H),6.81(d,1H,J=8.4 Hz,21-H),5.92(d,1H,J=1.8 Hz,6-H),5.86(d,1H,J=2.4 Hz,8-H),5.79(s,1H,3-OH),5.09(d,1H,J=11.4 Hz,2-H),4.91(d,1H,J=8.4 Hz,11-H),4.61(m,1H,3-H),3.99(m,1H,23-Ha),3.77(m,1H,23-Hb),3.79(s,3H,19-OMe),(糖环上氢信号)5.26(t,1H,J=9.2 Hz,4'-H),5.22(d,1H,J=2.4 Hz,4''-H'),5.16(dd,1H,J=10.2 Hz,J=3.6 Hz,2'-H),5.14(dd,1H,J=7.2 Hz,J=3.6 Hz,2''-H),4.29(d,1H,J=10.8 Hz,1'-H),4.23(t,1H,J=6.6 Hz,1''-H),4.17(m,2H,6'-Hb,6''-Hb),4.02(m,2H,6'-Ha,6''-Ha),3.75(t,1H,J=9.0 Hz,5'-H),5.87(d,J=2.4 Hz,1H),4.84(m,2H),4.75(d,1H,J=7.8 Hz),(乙酰乳糖苷上七个乙酰基)2.10(s,3H),2.07(s,3H),2.00(s,3H),1.99(s,3H),1.96(s,3H),1.91(s,3H),1.90(s,3H).
2.2 水飞蓟宾乳糖苷谱学数据:
1H NMR(DMSO-d6,600 MHz)δ:11.89(d,1H,J=1.8 Hz,5-OH),10.86(s,1H,7-OH),9.16(s,1H,20-OH),7.09(d,1H,J=1.8 Hz,13-H),7.08(d,1H,J=1.8 Hz,13-H),7.01(dd,1H,J=8.4 Hz,J=2.4 Hz,5-H),7.00(d,1H,J=1.8Hz,8-H),6.98(d,1H,J=8.4 Hz,16-H),6.97(d,1H,J=8.4 Hz,16-H),6.87(d,1H,J=8.4 Hz,22-H),6.81(d,1H,J=8.4 Hz,21-H),5.92(d,1H,J=2.4 Hz,6-H),5.87(m,1H,8-H),5.81(s,1H,3-OH),5.09(d,1H,J=11.4 Hz,2-H),4.91(d,1H,J=8.4 Hz,11-H),4.61(m,1H,3-H),4.28(m,1H,23-Ha),3.78(m,1H,23-Hb),3.79(s,3H,19-OMe),(糖环上信号)4.95(m,2H),4.09-4.18(m,2H),53-3.74(m,3H),3.17(d,2H).
13C NMR(DMSO-d6,150 MHz)δ:56.14(s,19-OMe),60.63(s,C-23),71.91(d,C-3),78.98(s,C-10),78.58 d and 78.56 d(C-11),82.98(s,C-2),96.51(s,C-6),98.73(s,C-1')100.92(s,C-4a),103.56(s ,C-1''),112.15 s and 112.08 s(C-18),116.99 d and 116.80 d(C-13),116.75 d and 116.67 d(C-21),117.31 d and 117.10 d(C-16),121.04 d and 120.97 d(C-22),121.82 d and 121.73 d(C-15),127.93 s and 127.69 s(C-17),130.54 s and 130.50 s(C-14),144.11 s and 144.08 s(C-12a),145.50(s,C-16a),147.54 s and 147.46(C-20),148.12s and 184.08 s C-19,163.75(s,C-8a),164.51(s,C-5),167.26(s,C-7),198.24(s,C-4),76.35,76.31,71.84,60.55。
2.3 样品的水溶性测定
参照文献[12]方法,测得 Sil的溶解度为18.9 mg/L,Sil-LacAcO8的溶解度为 20.1 mg/L,Sil-Lac的溶解度为280.80 mg/L,结果表明水飞蓟宾经糖苷化后,水溶性提高了14.8倍。
2.4 清除DPPH实验

图2 受试物清除DPPH活性Fig.2 DPPH scavenging activity of tested compounds
由图2可知,受试样品均具有清除DPPH自由基的能力,且呈现浓度依赖性,在所测试的浓度范围内,水飞蓟宾乳糖苷能显著的提高清除DPPH自由基的能力,这可能与引入乳糖基提供了更多的羟基而增强了其提供氢原子的能力有关。当浓度达到50 μM时,其清除率可达71.30%。结果表明,乳糖苷清除 DPPH自由基的能力有了明显提高,与Trolox的清除DPPH的能力不相上下。
2.5 还原能力实验

图3 待测物的还原能力Fig.3 Reducing power of tested compounds
由图3可知,受试物均具有还原Fe3+的能力,具有浓度依赖性。在受试浓度范围内,水飞蓟宾乳糖苷的还原能力较水飞蓟宾和水飞蓟宾乙酰乳糖苷有显著提高。当浓度达到125 μM时,其吸光值已达到1.624,约是水飞蓟宾0.267的6倍,这可能是水飞蓟宾乳糖苷引入了乳糖基含有多个羟基,显著提高了其供电子能力,从而增强了其还原能力。结果表明,乳糖苷的还原能力有了显著提高,而略低于Trolox。
2.6 清除ABTS+实验
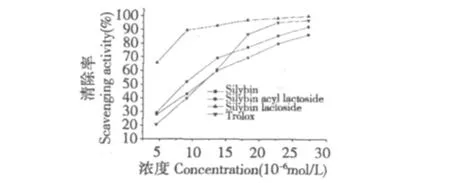
图4 受试物清除ABTS+自由基的能力Fig.4 ABTS+radicals scavenging activity of tested compounds
由图4可知,受试物清除ABTS+自由基的能力表现出良好的量效关系,随着浓度的不断增大,其清除ABTS+自由基的能力逐渐增强。水飞蓟宾乳糖苷具有最好的效果,当浓度达到9.10 μM时,水飞蓟宾乳糖苷清除ABTS+自由基的能力趋于稳定,达到90%以上,而水飞蓟宾和水飞蓟宾乙酰乳糖苷在此浓度下其清除率为30% ~50%左右,最终水飞蓟宾乳糖苷趋于100%。结果表明,经乳糖修饰后,水飞蓟宾清除ABTS+自由基的能力有了明显提高,比阳性对照物Trolox效果好。
2.7 抑制大鼠肝微粒体脂质过氧化能力的测定
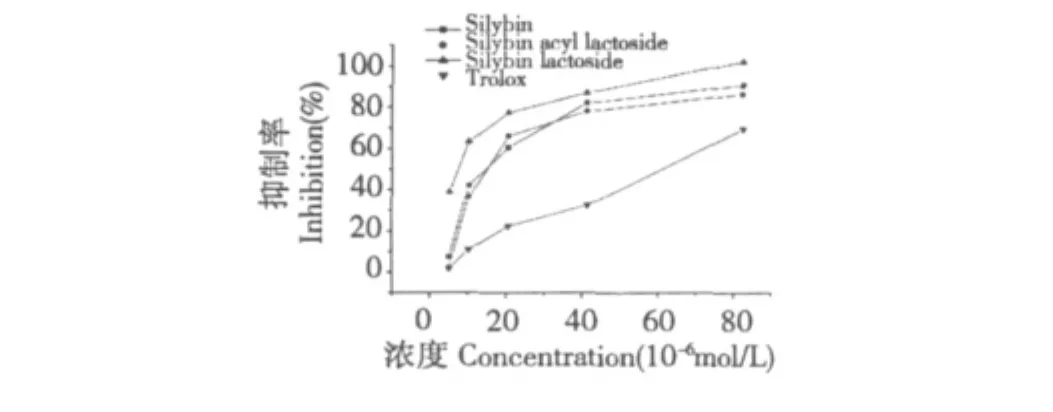
图5 受试物的抗脂质过氧化活性Fig.5 Inhibition of lipid peroxidantion by tested compounds
Fe2+/VC体系在溶液中产生的OH·和过氧化物引发后产生ROO·,能导致微粒体细胞膜和细胞蛋白质的脂质过氧化连锁反应而产生多种醛类物质,对生物体极具损伤作用,其中丙二醛(MDA)是主要的终产物,因此,MDA反映出机体细胞脂质过氧的程度,也间接反应出线粒体细胞膜受破坏的程度[11]。MDA与TBA共热产生的粉红色物质在532 nm处有吸收峰,由此可知,受试物的吸光度随MDA的含量变化而变化,吸光度越小,表示其抗氧化能力越强。由图5可知,受试物均具有较好的抑制大鼠肝微粒体脂质过氧化活性,且具有浓度依耐性,量效关系较好。在最低浓度5.19 μM时,水飞蓟宾乳糖苷就体现出较好的抑制脂质过氧化活性;当浓度在10.38~41.50 μM时。受试物的抑制脂质过氧化活性明显的提高,且在41.50 μM后趋于稳定,水飞蓟宾乳糖苷的活性最强;当达到最大浓度83.00 μM时,受试物的对脂质过氧化的抑制率均超过80%,且水飞蓟宾乳糖苷达到100%。结果表明,将水飞蓟宾修饰成乳糖苷后,其抗脂质过氧化能力得到明显提高,且明显好于trolox。这可能与引入乳糖基后提高了水飞蓟宾清除自由基能力,有效地阻止脂质过氧化连锁反应,从而达到增强其抗脂质过氧化活性。
3 结论
以天然活性物质作为先导化合物,对其进行结构修饰和改造,是新药开发的有效途径之一。水飞蓟宾经乳糖修饰后水溶性有了较大提高,抗氧化实验表明,水飞蓟宾乳糖苷较水飞蓟宾还原Fe3+能力,清除DPPH自由基能力,清除ABTS+自由基能力和抗脂质过氧化能力均得到不同程度的提高。不同的抗氧化模型虽然机理不同,但实验结果基本一致,均有较好的浓度依赖性。因此,水飞蓟宾乳糖苷有望作为天然高效的抗氧化剂应用于医药、食品以及化妆品等领域。
1 Zi XL,Agarwal A.Modulation of mitogen-activated protein kinase activation and cell cycle regulators by the potent skin cancer preventive agent silymarin.Biochem Biophys Res Commun,1999,263:528-536.
2 Singh RP,Agarwal R.Flavonoid antioxidant silymarin and skin cancer.Antioxid Redox Signal,2002,4:655-663.
3 Kang SN,Lee MH,Kim KM,et al.Induction of human promyelocytic leukemia HL-60 cell differentiation into monocytes by silibinin:involvement of protein kinase C.Biochem Pharmcaol,2001,61:1487-1495.
4 Liu W(刘伟),Yu YY(余燕影),Cao SW(曹树稳).Advances in chemical modification of silybin and its analogues.Nat Prod Res Dev(天然产物研究与开发),2012,24:124-131.
5 Fu XM(付新梅),Jiang T(江涛),Wang KQ(王奎旗),et al.Chemical modification of lead compounds by monasacchrides and their derivatives.Chin J Marine Dru(中国海洋药物),2001,81(3):54-56.
6 Steinman RM,Mellman IS,Muller WA,et al.Endocytosis and the recycling of plasma membrane.J Cell Biol,1983,96:1-27.
7 Liu W,Yu YY,Yang RZ,et al.Optimization of total flavonoid compound extraction from gynura medica leaf using response surface methodology and chemical composition analysis.Int J Mol Sci,2010,11:4750-4763.
8 Singh N,Rajini PS.Free radical scavenging activity of an aqueous extract of potato peel.Food Chem,2004,85:611-616.
9 Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay.Free Radic Biol Med,1999,12:1231-1237.
10 Chen HL(陈宏莉),Qin XJ(秦绪军),Hai CX(海春旭),et al.Effect of aloe on the peroxiditive damage model in microsome.Acta Nut Sin(营养学报),2004,26:124-126.
11 Wei QY,Chen WF,Zhou B,et al.Inhibition of lipid peroxidation and protein oxidation in rat liver mitochondria by curcumin and its analogues.Biochim Biophys Acta,2006,1760:70-77.
12 Bai TC,Yan GB,Hu J,et al.Solubility of silybin in aqueous poly(ethylene glycol)solution.Int J Pharm,2006,308:100-106.

