虎皮楠内生真菌Aspergillus sp.DCS31化学成分研究
孟欣欣,葛 锋,曾 英,赵沛基*
1昆明理工大学生命科学与技术学院,昆明 650500;2中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明 650204
长序虎皮楠(Daphniphyllum longeracemosum)为虎皮楠科(Daphniphyllaceae)虎皮楠属(Daphniphyllum)植物,在我国主要分布于云南东南部和广西,是一种生于海拔1000~1800 m密林中的常绿乔木[1,2]。虎皮楠科植物在传统中药中具有一定的药用价值,具有愈合、消炎等作用[3]。其代谢产物中含有大量的虎皮楠生物碱,该类生物碱多变的结构和复杂的多环骨架,成为化学和生物合成的热点之一。
植物内生真菌是指在某一时期生活在植物体内,但对寄主植物组织并不引起明显病害症状的真菌[4]。内生真菌长期与药用植物共同相互共生,有可能产生与宿主相同或相似生理活性的化学成分[5]。为了进一步寻找新型的天然产物及活性物质,我们对一株分离自长序虎皮楠韧皮部的内生真菌的化学成分进行研究,从内生真菌Aspergillus sp.DCS31的固体发酵培养基中分离得到五个化合物,分别为 asperpyrone D(1)、asperpyrone A(2)、flavasperone(3)、1,2-benzene dicarboxylic acid bis(2αmethyl heptyl)ester(4)、2,5-dihydroxyphenylacetic acid methyl ester(5)。化合物1~4为首次从虎皮楠内生真菌中分离得到。
1 实验部分
1.1 仪器与材料
Bruker AM-400型核磁共振仪;DRX-500型核磁共振仪;Avance III 600型核磁共振仪;Finnigan LCQ-Advantage型质谱仪;薄层层析用硅胶板和柱层析硅胶G,200~300目(青岛海洋化工厂),柱层析硅胶H(Merck公司);Sephadex LH-20葡聚糖凝胶(Amersham Pharmacia公司)。
Aspergillus sp.DCS31分离来自长序虎皮楠(Daphniphyllum longeracemosum)的树皮韧皮部。长序虎皮楠采自2009年移栽于昆明植物园的植物。
1.2 内生菌的鉴定
Aspergillus sp.DCS31的总DNA根据文献采用肌氨酸钠法提取[6]。实验中所用的ITS 4与ITS 5引物是真菌系统学研究中设计的通用引物ITS 4(5'>TCC TCC GCT TAT TGA TAT GC<3')和ITS 5(5'>GGA AGT AAA AGT CGT AAC AAG G <3')。PCR程序为95℃预变性15 min(加酶);95℃变性40 s,55 ℃退火 40 s,72 ℃ 延伸 90 s,30 个循环;72℃延伸10 min,PCR后回收到大约700 bp的核酸片段,测序后通过与GenBank数据库比对来鉴定菌株。
1.3 培养基及培养条件
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,定容至1 L,pH 自然,121 ℃灭菌20 min。
培养条件:Aspergillus sp.DCS31经PDA固体培养基发酵10 L,28℃培养14 d。
1.4 发酵产物的分离纯化
将长满菌丝的固体培养基划成小块放于锥形瓶中,用乙酸乙酯:甲醇:冰醋酸 =(80∶15∶5,V/V/V)混合溶剂提取3次,所得提取液经45℃减压浓缩得到浸膏,将浸膏悬浮于蒸馏水后加入等体积的乙酸乙酯萃取至无色,最后得到提取物37 g。粗提物经正相柱层析(200~300目),分别用石油醚:丙酮(10∶1、9∶1、8∶2、7∶3),氯仿:甲醇(20∶1、10∶1、9∶1、8∶2、7∶3)进行梯度洗脱,得到7个组分。组分2(215.5 mg)经过反复的正相柱层析得到化合物3(6.0 mg),组分4(4.0 g)经过反复的正相柱层析和Sephadex LH-20柱分离得到化合物1(26.5 mg)、2(5.2 mg)、5(8.2 mg),组分5(2.0 g)经过反复的正相柱层析和Sephadex LH-20柱分离得到化合物4(31 mg)。
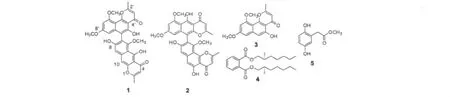
图1 化合物1~5的结构式Fig.1 Structures of compounds 1-5
2 结果与讨论
2.1 内生真菌的鉴定
Aspergillus sp.DCS31 的 5.8S rDNA 序列(Gen-Bank:JX025097)通过与GenBank数据库序列比对,Aspergillus sp.DCS31与曲霉属(Aspergillus)的同源性达99%,因此Aspergillus sp.DCS31鉴定为曲霉属真菌。
2.2 结构鉴定
化合物1 C31H24O10,黄色无定形粉末;ESI-MS m/z:557[M+H]+;1H NMR(C5D5N,600 MHz)δ:1.93(3H,s,CH3-2),2.13(3H,s,CH3-2'),3.58(3H,s,OCH3-8'),3.78(3H,s,OCH3-6),3.91(3H,s,OCH3-10'),6.05(1H,s,H-3),6.12(1H,s,H-3'),6.64(1H,d,J=2.3 Hz,H-7'),6.90(1H,d,J=2.4 Hz,H-9'),7.26(1H,s,H-10),7.61(1H,s,H-9);13C NMR(C5D5N,150 MHz)δ:185.0(s,C-4'),184.8(s,C-4),168.4(s,C-2'/2),163.8(s,C-5'),162.8(s,C-5),162.3(s,C-8'),161.9(s,C-10'),160.6(s,C-6),159.8(s,C-8),153.5(s,C-10a),151.8(s,C-10a'),141.7(s,C-9a),141.6(s,C-9a'),118.4(s,C-7/6'),111.3(s,C-5a/4a'),109.2(d,C-5a'),107.5(s,C-3),107.3(d,C-3'),106.5(s,C-9),104.5(d,C-4a),100.9(s,C-10),97.5(d,C-7'/9'),62.3(q,OCH3-6),56.1(q,OCH3-10'),55.1(q,OCH3-8'),20.2(q,CH3-2'),22.1(q,CH3-2)。以上数据与文献报道一致[7],由于化合物1与相类似化合物NMR的数据差别很小,通过2D NMR进一步确定化合物1为asperpyrone D。
化合物2 C31H24O10,黄色无定形粉末;ESI-MS m/z:557[M+H]+;1H NMR(C5D5N,600 MHz)δ:1.96(3H,s,CH3-2'),2.24(3H,s,CH3-2),3.62(3H,s,OCH3-6'),3.67(3H,s,OCH3-10),3.92(3H,s,OCH3-8'),6.06(1H,s,H-3'),6.40(1H,s,H-3),6.66(1H,d,J=2.2 Hz,H-7'),6.92(1H,d,J=2.2 Hz,H-9'),7.29(1H,s,H-6),7.60(1H,s,H-7);13C NMR(C5D5N,150 MHz)δ:187.0(s,C-4'),185.2(s,C-4),170.4(s,C-2'),169.4(s,C-2),165.8(s,C-5'),164.4(s,C-6'),163.9(s,C-8'),162.5(s,C-8),160.1(s,C-10),159.1(s,C-5),157.6(s,C-10b),153.8(s,C-10a'),143.6(s,C-6a),143.6(s,C-9a'),119.8(s,C-9),112.7(d,C-3),111.3(s,C-4a),111.3(s,C-5a'),109.8(d,C-3'),109.5(s,10a),108.5(d,C-7),108.5(s,C-10a'),107.6(d,C-6),106.7(s,C-4a'),99.4(d,C-9'),99.4(d,C-7'),63.4(q,OCH3-10),58.1(q,OCH3-8'),57.1(q,OCH3-6'),22.2(q,CH3-2'),22.0(q,CH3-2)。以上数据与文献报道一致[8]。通过2D NMR进一步确定化合物2为asperpyrone A。
化合物3 C16H14O5,黄色无定形粉末;ESI-MS m/z:287 [M+Na]+;1H NMR(CDCl3,500 MHz)δ:7.28(1H,s,OH-6),6.98(1H,s H-7),6.60(1H,d,J=3.2 Hz,H-9),6.41(1H,d,J=3.1 Hz,H-11),6.02(1H,s,H-3),4.02(3H,s,OCH3-10),3.94(3H,s,OCH3-12),2.39(3H,s,CH3-2);13C NMR(CDCl3,125 MHz)δ:184.2(s,C-4),167.4(s,C-2),162.6(s,C-10),161.5(s,C-6),160.6(s,C-12),153.3(s,C-14),141.1(s,C-8),108.4(s,C-13),107.3(d,C-7),104.3(s,C-5),101.0(d,C-3),97.8(d,C-9),97.2(d,C-11),56.1(q,OCH3-12),55.4(q,OCH3-10),20.7(q,CH3-2)。以上数据与文献报道一致[9]。
化合物4 C24H38O4,淡黄色油状;ESI-MS m/z:391[M+H]+;1H NMR(CDCl3,400 MHz)δ:7.71(2H,m,H-4,5),7.54(2H,m,H-3,6),4.26(4H,m,H-1',1″),1.70(2H,m,H-2',2″),1.25-1.45(16H,m,H-3',3″,4',4″,5',5″,6',6″),0.93(6H,d,J=7.5 Hz,CH3-2',2″),0.90(6H,t,J=6.6 Hz,H-7',7″);13C NMR(CD3Cl3,100 MHz)δ:167.63(s,C=O),132.39(s,C-1,2),130.76(d,C-3,6),128.70(d,C-4,5),68.07(t,C-1',1″),38.67(d,C-2',2″),30.29(t,C-4',4″),29.84(t,C-5',5″),23.68(t,C-6',6″),22.88(t,C-3',3″),13.91(t,C-7',7″),10.86(q,CH3-2',2″)。以上数据与文献报道一致[10]。
化合物5 C9H10O4,无色油状;ESI-MS m/z:183[M+H]+;1H NMR(CD3OD,600 MHz)δ:8.72(1H,s,OH-5),8.64(1H,s,OH-2),6.62(1H,d,8.6 Hz,H-3),6.59(1H,d,2.9 Hz,H-6),6.55(1H,dd,8.6,3.0 Hz,H-5),3.67(3H,s,OCH3-8),3.54(2H,s,H-7);13C NMR(CD3OD,150 MHz)δ:174.7(s,C-8),151.2(s,C-4),149.7(s,C-2),123.3(s,C-1),118.7(d,C-6),116.7(d,C-3),115.8(d,C-5),52.5(q,OCH3-9),36.6(t,C-7)。以上数据与文献报道一致[11]。
1 Zheng M(郑勉),Min TL(闵天禄).Flora of China(中国植物志),Beijing:Science Press,1980,45:1.
2 Yang TQ(杨廷全),Di YT(邸迎彤),He HP(何红平),et al.A new alkaloid from the fruits of daphniphyllum longeracemosum(Daphniphyllaceae).Acta Botanica Yunnanica(云南植物研究),2010,32:561-563.
3 Xu MF(许明峰),Shen LQ(沈莲清).NMR characterization of two flavonyl glycosides isolated from Daphniphyllum angustifolium Hutch.Chin J Magn Reson(波谱学杂志),2010,27:260-264.
4 Huang WY,Cai YZ,Xing J,et al.A potential antioxidant resource:Endophytic fungi from medicinal plants.Econ Bot,2007,60:14-30.
5 Li LQ(李良群),Yang YG(杨艳光),Zeng Y(曾英),et al.Chemical constituents of endophyte Talaromyces sp.T1BF from Taxus yunnanensis.Guihaia(广西植物),2011,31:699-701.
6 Sambrook J,Russell DW.Molecular cloning:A laboratory manual.3rd ed,NewYork:Cold Spring Harbor Laboratory Press,2001.
7 Zhan J,Gunaherath GM,Wijeratne EM,et al.Asperpyrone D and other metabolites of the plant-associated fungal strain Aspergillus tubingensis.Phytochemistry,2007,68:368-372.
8 Akiyama K,Teraguchi S,Hamasaki Y,et al.New dimeric naphthopyrones from Aspergillus niger.J Nat Prod,2003,66:136-139.
9 Sakurai M,Kohno J,Yamamoto K,et al.TMC-256A1 and C1,New inhibitors of IL-4 signal transduction produced by Aspergillus niger var niger TC 1629.J Antibiot,2002,55:685-692.
10 Singh N,Mahmood U,Kaul VK,et al.A new phthalic acid ester from Ajuga bracteosa.Nat Prod Res,2006,20:593-597.
11 Lebouvier N,Jullian V,Desvignes I,et al.Antiplasmodial activities of homogentisic acid derivative protein kinase inhibitors isolated from a vanuatu marine sponge Pseudoceratina sp.Mar Drugs,2009,7:640-653.

