消化道黏膜下肿物的内镜下诊断及治疗
郭 花,盛剑秋,王海红,金 鹏,赵晓军,李 娜,王 昕,李爱琴,余东亮,谢 惠,王晓伟,汤 姗
北京军区总医院消化科,北京 100700
消化道黏膜下肿物(submucosal tumor,SMT)泛指一类来自黏膜层以下的消化道病变。随着内镜水平的提高及超声内镜(endoscopic ultrasonography,EUS)检查的广泛应用,众多黏膜下肿物如胃肠道间质瘤(gastrointestinal stromal tumor,GIST)、平滑肌瘤、类癌、神经鞘瘤、脂肪瘤、异位胰腺、错构瘤、血管球瘤等逐渐被识别。本研究对消化道黏膜下肿物进行内镜及超声内镜检查,并采用ESE、胃镜与腹腔镜双镜联合或隧道法进行瘤体切除。
1 对象与方法
1.1 研究对象 我院2011年4月-2013年5月经胃、肠镜检查发现消化道黏膜下肿物,进一步行超声内镜检查,分别通过 ESE、胃镜与腹腔镜双镜联合及STER切除黏膜下肿物261例,最终经病理学及免疫组化确诊。男142例,女119例,年龄23~79岁,平均(55.6 ±11.3)岁。
1.2 EUS检查 内镜检查发现消化道黏膜下肿物后进一步行EUS检查,使用电子环扫式超声内镜(Olympus GF-UE260)或微型超声探头(Olympus EndoEcho EU-M2000,探头频率20 MHz),进一步明确病变的部位、大小、起源层次、回声强度、回声均匀度、生长方向以及与周围脏器的关系等。
1.3 内镜下治疗
1.3.1 ESE治疗:适用于瘤体直径≤3 cm、位于固有肌层或黏膜肌层的瘤体。在内镜下先标记切除范围,黏膜下注射甘油果糖-美兰使病变抬起,用IT刀或钩刀逐步挖除瘤体,最后以钛夹封闭创面。
1.3.2 胃镜与腹腔镜双镜联合:适用于瘤体直径>3 cm、位于固有肌层深层、以向腔外生长为主估计内镜下难以完整切除时。手术方法分为腹腔镜辅助胃镜手术和内镜辅助腹腔镜手术。
1.3.3 STER:适用于肿物位于食管、贲门固有肌层的瘤体。在肿物近端约3~5 cm用Dual刀作一横行切口,用IT刀、三角刀、钩刀建立黏膜下隧道,在隧道内逐步剥离肿物与周边组织后,完整切除瘤体,最后钛夹封闭隧道开口。
1.4 病理学检查 所有组织在我院病理科行苏木精-伊红(hematoxylin-eosin,HE)染色,采用SP法对相关标本进行 CD117、CD34、DOG-1、SMA、Desmin、S-100、Syn、CagA、Vimentin 免疫组化染色。
1.5 随访 对所有患者术后进行门诊及电话随访,定期复查内镜、腹腔CT、盆腔CT及胸部X线片检查。
1.6 统计学方法 所有资料采用计量资料或计数资料表示,采用SPSS 13.0进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 黏膜下肿物的分类 本研究中最常见的黏膜下肿物是GIST和平滑肌瘤,其次为脂肪瘤和类癌,神经鞘瘤、错构瘤和血管球瘤较少见(见图1)。
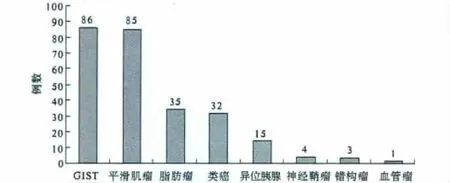
图1 黏膜下肿物的类型Fig 1 Types of submucosal tumor
2.2 黏膜下肿物的内镜表现及位置分布特点 GIST在内镜下呈球形或半球形隆起,表面光滑,部分体积较大者瘤体顶端出现充血、糜烂或溃疡,其分布以胃内最多见(74/86),食管、小肠、结直肠也可见(见图2)。平滑肌瘤内镜下表现为丘状、半球形隆起,表面光滑,最多见于食管(66/85),胃内也可见;脂肪瘤呈微黄色隆起,质地柔软,“靠垫征”阳性。类癌呈淡黄色或灰白色、丘状或半球状广基无蒂隆起,界限清楚,质地偏硬,表面黏膜光滑并可见毛细血管是其特点,以直肠最多见(27/32),胃内也可见。异位胰腺呈丘状隆起,典型者中央略凹陷,最多见于胃窦临近幽门(14/15),十二指肠也可见。神经鞘瘤为球形或卵圆形隆起,可见于胃(3/4)和直肠(1/4)。错构瘤呈丘状或梭行隆起,表面光滑、质地软,在十二指肠球前壁、胃底贲门和贲门口各见1例。血管球瘤1例见于胃内,表面光滑,质地软。
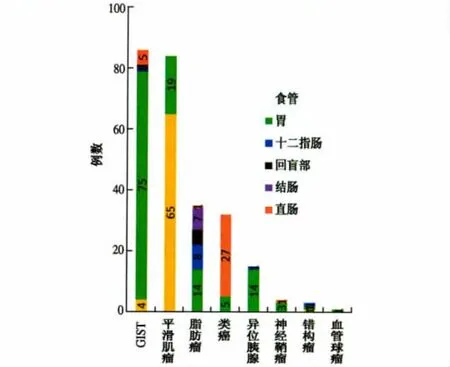
图2 各种消化道黏膜下肿物的位置分布Fig 2 The location distribution of gastrointestinal submucosal tumor
2.3 超声内镜结果 GIST在超声下多表现为低、中-低回声,部分瘤体内部还可出现片状中-高回声区,内部回声不均匀或均匀,起源于固有肌层或黏膜肌层(见表1、图3)。平滑肌瘤超声内镜下多表现为低回声、中-低回声,回声多均匀,且边界清晰,多起源于黏膜肌层,部分起源于固有肌层。脂肪瘤起源于黏膜下层,呈均匀高回声表现,后方可有衰减效应。类癌则多起源于黏膜肌层或黏膜下层,内部回声均匀,呈低回声、中-低回声。神经鞘瘤为内部不均匀的中-低回声,可起源于固有肌层或黏膜下层。异位胰腺多呈中低回声,也可以是混合回声,起源于黏膜下层,边界多不清,部分内部可见腺管结构。错构瘤可起源于黏膜层或固有肌层,呈中-低回声,其中1例见管腔样结构。血管球瘤在彩色多普勒图像中见瘤体内部血流丰富。
以病理学及免疫组化结果为金标准,261例患者中228例的EUS诊断与病理学诊断符合,总诊断符合率为 87%,EUS对脂肪瘤(100%)、血管球瘤(100%)、GIST(93%)、平滑肌瘤(87%)、异位胰腺(80%)、类癌(78%)的诊断率较高。由于临床经验不足,超声内镜对神经鞘瘤和错构瘤诊断符合率最低。
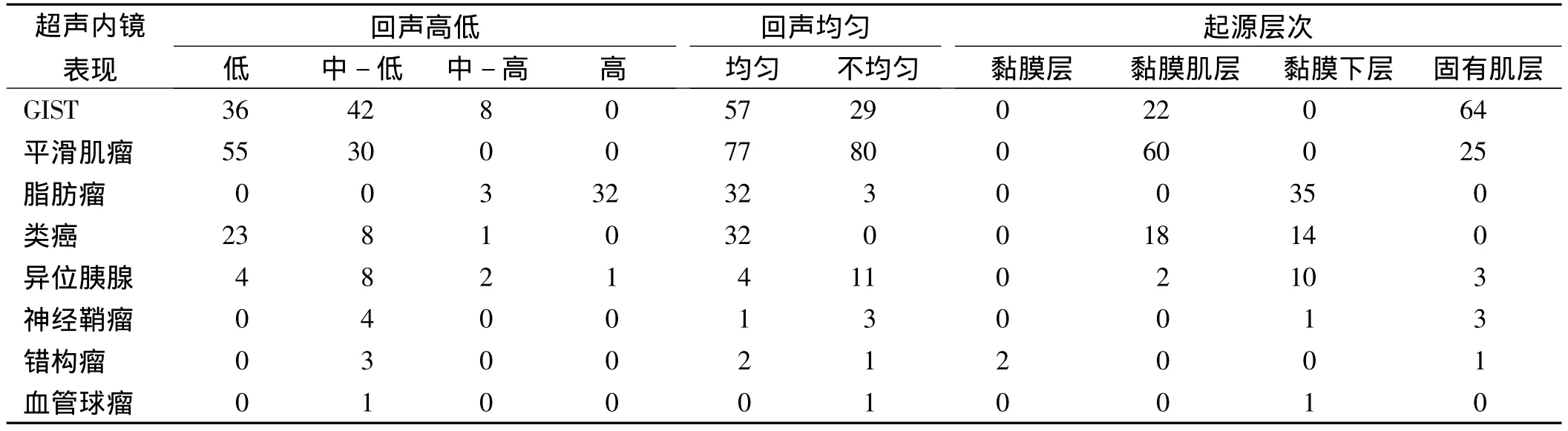
表1 黏膜下肿物的超声内镜下表现Tab 1 Features of submucosal tumor in EUS
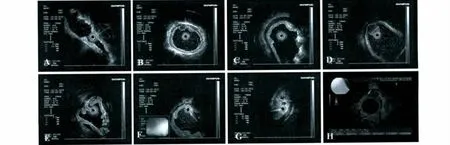
图3 各种黏膜下肿物的超声内镜图像 A:GIST;B:平滑肌瘤;C:脂肪瘤;D:类癌;E:异位胰腺;F:神经鞘瘤;G:错构瘤;H:血管球瘤Fig 3 Endoscopic ultrasound images of submucosal tumor A:Gastrointestinal stromal tumor;B:Leiomyoma;C:Lipoma;D:Carcinoid tumor;E:Heterotopic pancreas;F:Schwannoma;G:Hamartoma;H:Glomus tumor
2.4 免疫组化结果 对GIST、平滑肌瘤、类癌、神经鞘瘤及血管球瘤进行免疫组化染色,结果表明DOG-1、CD117、CD34在GIST中阳性率最高;平滑肌瘤中SMA和Desim阳性率最高;类癌中SYN及CgA阳性率最高;神经鞘瘤中S-100全部阳性;血管球瘤中Vementin和SMA阳性率最高(见表2)。
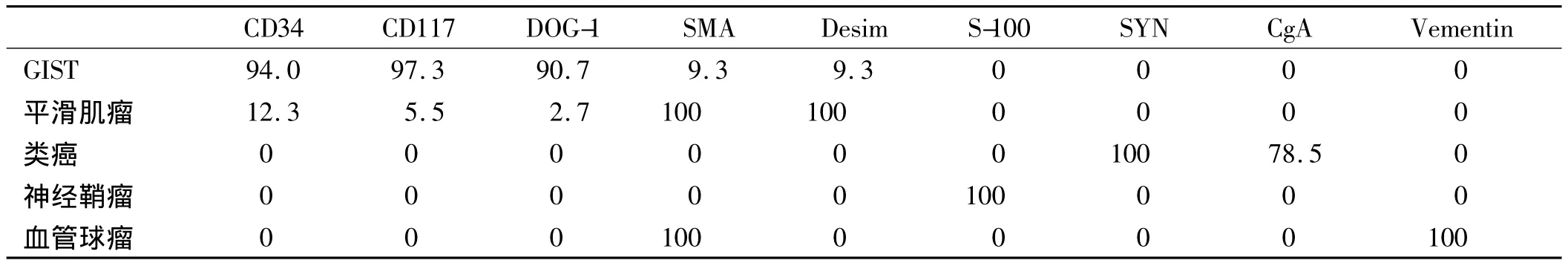
表2 各种黏膜下肿物的免疫组化指标阳性率(%)Tab 2 Immunohistochemical results of gastrointestinal submucosal tumor(%)
2.5 治疗结果 所有患者均顺利完整切除瘤体(见图4),其中ESE法切除黏膜下肿物213例,胃镜腹腔镜双镜联合法42例,隧道法6例。其中有3例GIST在ESE挖除瘤体过程中发生了胃壁微小穿孔,通过内镜下钛夹修补达到完全缝合穿孔。另有1例患者因术中操作时间过长发生术后感染,经抗感染治疗后痊愈。所有患者均无术中大出血、术后迟发性出血及死亡病例发生。根据2008版GIST术后风险分级对GIST患者进行风险评估,极低危56例,低危17例,中危8例,高危5例。
2.6 随访 术后对患者进行电话及门诊随访,患者无烧心、嗳气、腹痛等症状,营养状况及生活质量良好,仅1例胃肠道间质瘤(中危)患者因未按医嘱要求口服分子靶向药物伊马替尼发生盆腔转移,其余病例均无复发及转移。
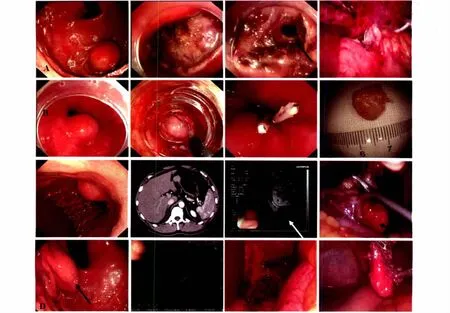
图4 部分黏膜下肿物的内镜下表现及治疗 A:胃肠道间质瘤;B:平滑肌瘤;C:神经鞘瘤;D:胃底贲门错构瘤Fig 4 The endoscopy manifestation and therapy of some submucosal tumors A:Gastrointestinal stromal tumor;B:Leiomyoma;C:Schwannoma;D:Hamartomain cardia and stomach fundus
3 讨论
超声内镜检查对肿物的定位及治疗方式的选择有重要提示作用。本研究中1例胃底近贲门GIST超声内镜显示瘤体位于黏膜肌层,向腔内及腔外生长,而在双镜联合治疗过程中腹腔镜见瘤体位于浆膜层下,此病例提示有些黏膜下肿物实际可能以向腔外生长方式为主,且与浆膜层关系密切,单纯内镜下不易剥离。工作中也遇到内镜下见胃黏膜下多发隆起性病变,超声内镜显示数个回声均匀的低回声病灶,误诊为胃内多源发GIST,实际在胃镜联合腹腔镜治疗时发现仅较大的一处病灶为胃GIST,其余隆起实际为肝囊肿及肝左叶血管瘤外压所致,所以在进行肿物切除前,一定要行相关部位CT检查了解是否为周围脏器外压所致。
ESE可切除位于固有肌层的GIST,但对于瘤体较大、起源于固有肌层深层时,ESE治疗时难度有所增加,而单独腹腔镜治疗却存在不易寻找病变、定位困难等缺点,因此将胃镜与腹腔镜双镜联合实现了两者优势互补,腹腔镜可处理术中出血和穿孔,而胃镜又对肿物能进行精确定位,两者结合可避免过多正常胃壁被切除,保留重要结构的功能,是一种有效、微创、安全的新方法。本研究采用胃镜与腹腔镜双镜联合技术对胃底贲门附近黏膜下肿物进行切除,其中最近者距贲门仅1 cm,部分瘤体直径达6 cm,术后患者贲门功能保存良好,术后随访患者无反流、烧心等症状,复查内镜无反流性食管炎,甚至食管狭窄出现。
本研究成功运用STER法对6例食管、贲门和胃内黏膜下肿物进行切除,术中无穿孔、出血发生,术后患者进食良好,无食管狭窄等并发症。由于其切除瘤体的部位黏膜层是完整的,因此大大避免了穿孔和继发感染的发生[1],即可完整切除肿物,又能保持消化道的完整性,使得切除食管固有肌层的黏膜下肿物更加安全。但仍需要注意观察肿物切除后患者有无皮下气肿发生,若条件许可,操作时采用较空气吸收、弥散快的二氧化碳气体以减轻患者术后腹胀等不适。
穿孔是内镜下治疗的主要并发症,金属夹夹闭创面是治疗穿孔最直接、最有效的方法。如果创面小,可直接在内镜下金属夹直接夹闭穿孔部位;若穿孔较大,可考虑金属夹联合尼龙绳的方法封闭穿孔,术后采取半卧位体位,结合禁食、胃肠减压、抑酸、补液等治疗一般均可好转。
GIST属于消化道间叶性肿瘤,具有非定向分化和潜在恶性的特点,分子生物学特点为原癌基因C-kit和血小板源性生长因子受体-α(PDGFR-α)基因突变,CD117或DOG-1高表达是其免疫表型特点[2-3]。术后对所有内镜下完整切除瘤体进行风险分级评估,评价极低危56例,低危17例,中危8例,高危5例,其中3例高危患者的最大瘤体直径均<1 cm,这提示虽然高危GIST多见于瘤体直径>4 cm者,但是对于直径较小的瘤体也不能排除高危GIST的可能,瘤体大小与其危险等级评估可能并不成正比,应结合核分裂象、原发部位、是否发生瘤体破裂等指标进行综合判断。本组病例中仅1例胃肠道间质瘤(中危)患者治疗后因未口服分子靶向药物伊马替尼而发生盆腔转移,遂后该患者行开腹手术切除转移灶,手术后按时口服格列卫分子靶向治疗,目前随访无再次复发及转移。这表明对于中高危GIST,即使完整切除瘤体,仍需要靶向性药物进行辅助治疗,否则有复发的可能,推荐中危患者服药1年,高位患者服药3年[4]。
本研究发现4例神经鞘瘤,其中3例胃神经鞘瘤起源于固有肌层,分别为腔外生长和腔外+腔内生长,由于缺乏特征性表现,在病理诊断前被误诊为胃GIST。在双镜联合治疗时发现3例胃神经鞘瘤在腹腔镜下可直视瘤体,分析这可能与神经鞘瘤具有向腔外生长的特征生长方式有关,此结果与Yoon等[5]认为神经鞘瘤容易出现向腔外生长、浆膜下生长的结论相一致。Kanneganti等[6]报道神经鞘瘤可出现于消化道的胃、直肠、盲肠等部位,术前也常被误诊为GIST,有学者认为神经鞘瘤与GIST在超声内镜下切面形态不同,神经鞘瘤多为饱满的圆形,而GIST多为椭圆形或梭形。神经鞘瘤大部分为良性,一般预后良好,部分患者有恶变可能。免疫组化 S-100阳性有助于明确诊断。
错构瘤是较为少见的病例,本研究发现3例错构瘤,其中1例错构瘤位于胃底贲门,呈梭形隆起,质软,超声下呈中-低密度回声,起自固有肌层,向腔内及腔外生长,似间质瘤,但切除过程中发现病灶位于浆膜外,病理学检查结果为增生的平滑肌、脂肪组织、血管和腺体,最终明确诊断错构瘤,此病例提示胃肠道错构瘤超声及内镜图像无特异性,容易被误诊。国外关于消化道错构瘤的报道也较为少见,错构瘤是胚胎发育过程中胰腺异位所致,其组织学特点为由增生的脂肪、腺体、平滑肌束构成,部分病例还可见布氏腺体增生、胆管及胰腺组织[7];有学者将错构瘤在内镜下分为有蒂的“息肉型”和无蒂的“黏膜下肿物型(SMT)”[8],可位于黏膜层和黏膜下层,因约20%错构瘤与胃腺癌共存,因此一经诊断,最好内镜下切除。
血管球瘤是血管的动静脉吻合处即血管球发生的一种血管源性良性软组织肿瘤[9],约占软组织肿瘤的2%,最好发于手指甲床下,罕见于深部软组织和内脏,其免疫组化特征为SMA、Vimentin、Actin阳性。本研究发现胃血管球瘤在内镜下见瘤体表面黏膜光滑,触之质地软,超声内镜下彩色多普勒见血流丰富对其诊断提供重要依据。
总之,各种黏膜下肿物在内镜及超声内镜下有一定特点,超声内镜对于消化道黏膜下肿物的治疗方案的选择有重要的指导意义。ESE、胃镜腹腔镜双镜联合及STER是目前黏膜下肿物微创治疗的主流发展方向,是一种安全、有效的治疗方法,具有创伤小、术后恢复快、患者易于接受等优点,值得在临床中推广应用。
[1]Xu MD,Lu W,Li QL,et al.Application and evaluation of submucosal tunneling endoscopic resection of gastric submucosal tumors originating from the muscularispropria layer[J].Zhonghua Wei Chang Wai Ke Za Zhi,2012,15(7):671-674.
[2]Rajendra R,Pollack SM,Jones RL.Management of gastrointestinal stromal tumors[J].Future Oncol,2013,9(2):193-206.
[3]Vukobrat-Bijedic Z,Husic-Selimovic A,Bijedic N,et al.Gastrointestinal stromal tumors and its frequency in our clinical samples[J].Med Arh,2012,66(6):369-371
[4]Eisenberg BL.The SSG XVIII/AIO trial:results change the current adjuvant treatment recommendations for gastrointestinal stromal tumors[J].Am J Clin Oncol,2013,36(1):89-90.
[5]Yoon HY,Kim CB,Lee YH,et al.Gastric schwannoma[J].Yonsei Med J,2008,49(6):1052-1054.
[6]Kanneganti K,Patel H,Niazi M,et al.Cecalschwannoma:a rare cause of gastrointestinal bleeding in a young woman with review of literature[J].Gastroenterol Res Pract,2011,2011:142781.
[7]Ryan A,Lafnitzegger JR,Lin DH,et al.Myoepithelialhamartoma of the duodenal wall[J].Virchows Arch,1998,432(2):191-194.
[8]Odashima M,Otaka M,Nanjo H,et al.Hamartomatous inverted polyp successfully treated by endoscopic submucosal dissection[J].Intern Med,2008,47(4):259-262.
[9]Kang G,Park HJ,Kim JY,et al.Glomus tumor of the stomach:a clinicopathologic analysis of 10 cases and review of the literature[J].Gut Liver,2012,6(1):52-57.

