吉法酯预防双氯芬酸所致小肠损伤的实验研究
方 莉,孟立娜,吕 宾,吴炜锋
1.浙江大学医学院附属邵逸夫医院感染科,浙江 杭州 310016;2.浙江中医药大学附属第一医院消化内科
非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)是目前使用最多的一大类药,短期用于退热、缓解各种疼痛,长期可用于治疗各种风湿免疫性疾病,以及对心脑血管疾病的二级预防。NSAIDs主要通过抑制环氧化酶影响花生四烯酸的代谢,使前列腺素合成减少,从而抑制发热、疼痛和炎症反应[1]。然而NSAIDs引起的不良反应不容忽视,尤以胃肠损伤为主。阐明NSAIDs相关肠道损伤的发病机制,选择一些积极有效的药物来防治NSAIDs相关肠道损伤已成为目前研究的热点。吉法酯是胃黏膜保护剂,在促进胃黏膜损伤修复、保持胃黏膜完整性过程中起重要作用。但吉法酯对肠道黏膜损伤是否具有保护作用,国内研究尚少。NF-κB是多种信号转导途径的枢纽,活化的核因子-κB(NF-κB)参与多种细胞因子、炎症介质的表达和调控[2]。近年来证实,血管紧张素Ⅱ(AngⅡ)也是一系列炎症反应的始动子,可通过降解IκB 而激活 NF-κB,参与机体炎症反应[3]。本研究通过建立NSAIDs相关大鼠小肠损伤模型,观察吉法酯对大鼠小肠损伤是否具有预防保护作用;并探讨其可能机制,为寻求新的治疗手段提供实验依据。
1 材料与方法
1.1 实验动物与主要药物试剂
1.1.1 实验动物:健康雄性,SPF级,SD大鼠24只,8~9周龄,体质量220~260 g,由中国医学科学院上海实验动物中心提供。饲养过程符合实验动物伦理学要求。
1.1.2 实验药物:双氯芬酸缓释片(北京诺华制药有限公司),国药准字H10980297;吉法酯(日本生晃荣养药品株式会社),进口药品注册证号H20040173。
1.1.3 实验试剂:TNF-α放射免疫分析药盒购自北京北方生物技术研究所;NF-κB P65亚单位一抗、DAB显色剂购自北京中杉金桥生物技术有限公司,AngⅡ一抗购自santa cruz公司,免疫组化Envision系统试剂盒购自Dako公司。
1.2 实验方法
1.2.1 动物模型制备:按照随机数字表法将24只SD大鼠随机等分为3组:空白对照组:10 ml·kg-1·d-1生理盐水灌胃 1 次;实验对照组:7.8 ml·kg-1·d-1双氯芬酸溶液灌胃1次;吉法酯保护组:31.25 ml·kg-1·d-1吉法酯溶液造模前1天灌胃1次作为预防保护处理,造模之日起予相应剂量吉法酯灌胃1 h后再予造模剂量双氯芬酸溶液灌胃1次。造模时间为5 d,造模期间大鼠正常饮食饮水。末次给药24 h后,以3%戊巴比妥钠0.15 ml/100 mg腹腔注射麻醉处死大鼠,打开腹腔,迅速抽取下腔静脉血5 ml,室温静置30 min后,3000 r/10 min离心 10 min,取上清液,置入-20℃冰箱保存。剖开全段小肠,用放大镜观察大体损伤情况;距回盲部40 cm近侧端取空肠1 cm,置4%甲醛液中固定,另留取1 cm小肠置入液氮中保存以备后续研究。
1.2.2 小肠黏膜损伤评分:大体评分按下列标准:无损伤计0分;局部充血、水肿但未出现溃疡计1分;有溃疡,但无明显炎症计2分;有溃疡,仅有1处出现炎症计3分;有多处溃疡和炎症,溃疡<1 cm计4分;有多处溃疡和炎症:至少有1处溃疡>1 cm计5分。组织学评分按Chiu氏法分级:肠黏膜绒毛正常为0分;绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血为1分;上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张为2分;固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落为3分;上皮细胞层变性、坏死、脱落,部分绒毛脱落;固有层裸露,毛细血管扩张、充血为4分;绒毛脱落,固有层崩解,出血或溃疡形成为5分。光镜下每个样本随机计数20个视野,每个视野按标准单独评分,20个视野的平均数为最后的病理评分。
1.2.3 血清TNF-α检测:按照北京北方生物技术研究所提供的放免分析药盒说明书进行,由浙江省中医院放免实验室协助完成。
1.2.4 小肠黏膜 NF-κB、AngⅡ表达:采用免疫组化Envision二步法进行(按试剂盒说明书)。一抗、二抗均按1∶100稀释,PBS取代一抗作为空白对照。NF-κB阳性表达以细胞质和细胞核呈棕色颗粒状染色为标准,着色明显高于背景或背景不着色而细胞着色者为阳性细胞。AngⅡ以胞浆或胞膜上有棕色颗粒为阳性细胞。参照Mattern等方法判定结果。每张切片按阳性细胞染色强度和阳性细胞百分数分级。阳性染色深度:未见染色为0分,轻度染色为1分(染成浅黄色),中度染色为2分(染成棕黄色),深度染色为3分(染成棕褐色);阳性细胞数记分:0% ~1%为0分,2% ~25%为1分,26% ~50%为2分,51% ~75%为3分,76% ~100%为4分。阳性染色深度与阳性细胞百分数之和分4级:0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~7分为强阳性(+++)。
2 结果
2.1 大鼠NSAIDs相关小肠损伤模型建立 造模第4天实验对照组大鼠死亡2只,尸检可见小肠肠管扩张明显,部分肠管出血坏死。造模第5天实验对照组大鼠死亡3只,尸检可见恶臭浑浊腹水,肠管穿孔坏死。其余各组大鼠均存活。解剖发现:空白对照组大鼠无明显肉眼可见损伤;实验对照组大鼠有不同程度肠粘连,肠管扩张或肠腔狭窄以及沿肠管纵轴分布的圆形或类圆形多发溃疡,严重者可见肠管出血坏死。病理可见:实验对照组小肠黏膜组织形态结构改变,绒毛中心分离坏死、脱落,固有层崩解,出血伴溃疡形成,黏膜下大量中性粒细胞浸润(见图1)。

图1 实验对照组大鼠肠黏膜损伤表现:腹腔脓性渗出,红斑、糜烂、多发溃疡Fig 1 Performance of intestinal mucosa in model control group:purulent exudation,erythema,erosion,multiple ulcers
吉法酯保护组大鼠小肠黏膜可见局部充血水肿,部分出现肠壁散发溃疡及肠壁增厚。镜下多为轻中度炎性改变,以及肉芽组织形成。与空白对照组比较,实验对照组大鼠小肠大体损伤及组织学评分均显著升高(P均<0.01)。吉法酯预防保护后,其大体及组织学损伤程度均明显减轻(P均<0.05,见表1)。
表1 各组大鼠肠黏膜大体损伤及组织学评分比较 ()Tab 1 Comparison of morphological and pathological scores in three groups()
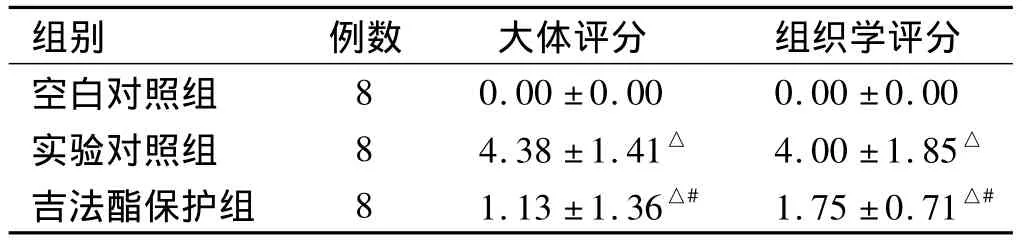
表1 各组大鼠肠黏膜大体损伤及组织学评分比较 ()Tab 1 Comparison of morphological and pathological scores in three groups()
注:与空白对照组比较,△P<0.05;与实验对照组比较,#P<0.05;死亡大鼠按各评分标准最高级别统计。
2.2 血清TNF-α水平定量检测 实验对照组血清TNF-α(22.20 ±5.42)表达明显高于空白对照组(6.19±2.76),差异具有统计学意义(P <0.01);吉法酯保护组血清TNF-α(13.03±6.30)较实验对照组明显降低,差异有统计学意义(P<0.05)。
2.3 小肠黏膜NF-κB、AngⅡ表达半定量测定 NF-κB阳性表达以小肠上皮胞核或胞浆染色为主,AngⅡ表达以小肠上皮细胞及血管内皮细胞胞浆为主(见图2、3)。实验对照组 NF-κB、AngⅡ阳性细胞数明显高于空白对照组(P均<0.05);吉法酯保护组NF-κB阳性细胞表达则较实验对照组明显下降,差异有统计学意义(P<0.05),小肠上皮AngⅡ表达亦较实验对照组下降明显,差异有统计学意义(P<0.05,见表2)。
表2 各组大鼠肠黏膜NF-κB及AngⅡ表达 ()Tab 2 Comparison of the expression of NF-κB and AngⅡin three groups()

表2 各组大鼠肠黏膜NF-κB及AngⅡ表达 ()Tab 2 Comparison of the expression of NF-κB and AngⅡin three groups()
注:与空白组对照比较,△P<0.05;与实验对照组比较,#P<0.05。
3 讨论
NSAIDs所致胃肠道损伤一直是人们关注的焦点。既往研究多集中在胃黏膜,近年来随着胶囊内镜、双气囊小肠镜等检查手段的普及,发现NSAIDs引起的小肠损伤并不少见[4-6]。Graham 等[7]对慢性 NSAIDs服用者行胶囊内镜检查发现有71%的患者发生了小肠损伤,其中包括下消化道炎症、糜烂、溃疡、出血,甚至出现透明膈和肠梗阻。本研究显示,7.8 mg·kg-1·d-1双氯芬酸造模5 d,造模组大鼠死亡率明显增加,小肠黏膜发生严重损害,包括充血水肿、多发溃疡、肠管出血坏死,甚至穿孔、隔膜形成等。实验中我们发现部分大鼠胃黏膜及结肠黏膜亦可见少许糜烂及散发溃疡。提示NSAIDs所致小肠损伤发生率及严重程度远高于胃黏膜。目前仍缺乏有效的NSAIDs小肠损伤防治手段。
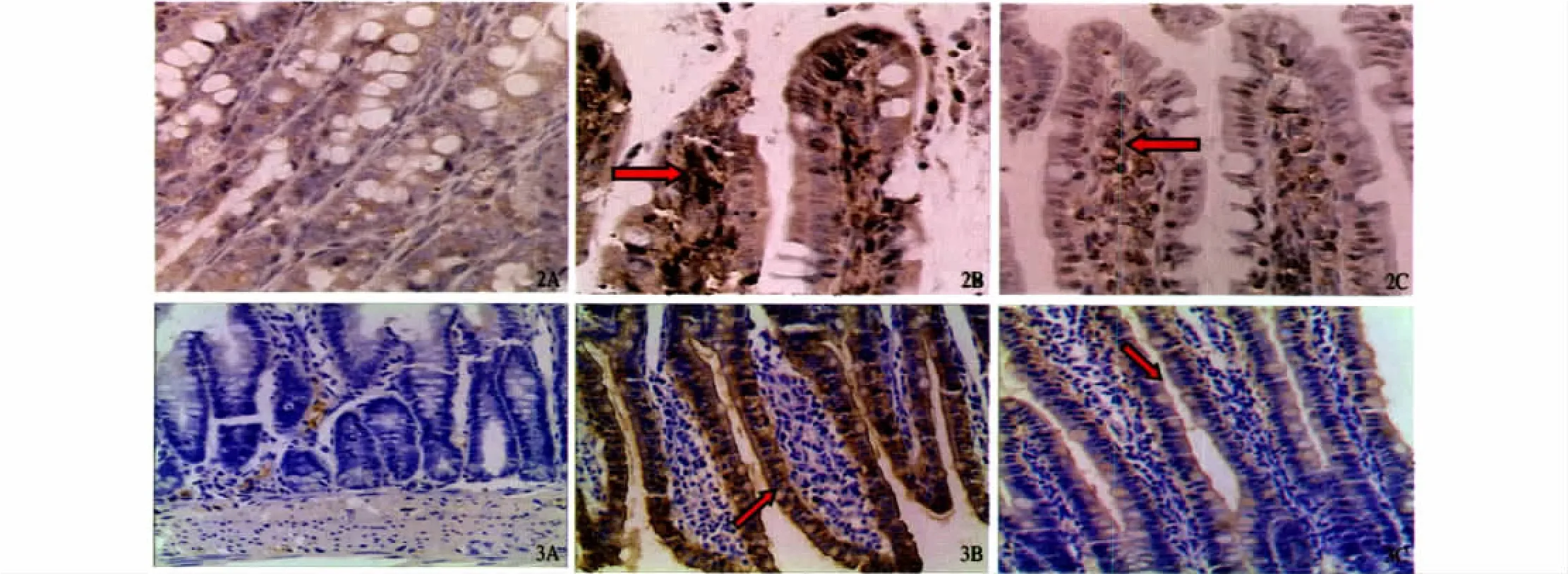
图2 各组大鼠小肠黏膜NF-κB表达(SP法,400×)A:空白对照组;B:实验对照组;C:吉法酯保护组;图3 各组大鼠小肠黏膜AngⅡ表达(SP法,200×)A:空白对照组;B:实验对照组;C:吉法酯保护组Fig 2 Expression of NF-κB in intestinal mucosa in three groups(SP 400 × )A:Blank control group;B:Model control group;C:Wycakon group;Fig 3 Expression of AngⅡin intestinal mucosa in three groups(SP 200×)A:Blank control group;B:Model control group;C:Wycakon group
肠道损伤可以刺激机体产生大量炎症因子,通过炎症介质释放入血,引起全身炎症反应及代谢障碍。NF-κB是一种多向性、多效性的核转入调控因子。是多条信号转导途径的交汇点,参与体内多种病理生理过程。当机体受到多种刺激,如缺血缺氧、炎症因子(TNF-α等)、氧自由基、蛋白激酶C、病毒或细菌及其代谢产物等作用时,可激活NF-κB信号通路,促发炎症因子级联效应。AngⅡ是已知最强的缩血管活性物质之一,在RAS系统中起关键性作用。它可作用于血管平滑肌,使全身微动脉收缩,血供减少,引起组织缺血、缺氧,还可刺激肾上腺皮质球状带细胞合成和释放醛固酮,维持机体水电解质平衡。近年来发现AngⅡ也是一系列炎症反应的始动子。AngⅡ可促进IκB降解、NF-κB p65核转移而诱导NF-κB活化并促进促炎症因子与黏附分子表达,从而导致其下游一系列炎症因子、细胞因子的释放。
本研究发现,使用吉法酯可显著减轻大鼠小肠黏膜损伤程度。且吉法酯干预组大鼠小肠上皮AngⅡ、NF-κB表达明显低于实验对照组;血清TNF-α水平亦较较实验对照组下降,提示吉法酯可抑制促炎因子AngⅡ、NF-κB的表达,减少炎症因子 TNF-α的释放,从而减轻肠道炎症反应。这可能是吉法酯参与NSAIDs相关小肠损伤预防保护作用的机制之一。
[1]Baigent C,Patron C.Selective cyclooxygenase 2 inhibitors,aspirin and cardiovasculard disease:a reappraisal[J].Arthritis Rheum,2003,48(1):12-20.
[2]Rakonczay Z Jr,Hegyi P,Takács T,et al.The role of NF-kappa B activation in the pathogenesis of acute pancreatitis[J].Gut,2008,57(2):259-267.
[3]Phillips MI,Kagiyama S.Angiotension Ⅱ as a pro-inflammatory mediator[J].Curr Opin Investing Drugs,2002,3(4):569-577.
[4]Thiefin G,Beaugerie L.Toxic effects of nonsteroidal anti-inflammatory drugs on the small bowel,colon,and rectum [J].Joint Bone Spine,2005,72(4):286-294.
[5]Adebayo D, Bjarnason I. Is non-steroidal anti-inflammaory drug(NSAID)enteropathy clinically more important than NSAID gastropathy?[J].Postgrad Med J,2006,82(965):186-191.
[6]Hawkey CJ.NSAIDs,coxibs,and the intestine [J].J Cardiovasc Pharmacol,2006,47 Suppl 1:S72-S75.
[7]Graham DY,Opekun AR,Willingham FF,et al.Visible small intestinal mucosal injury in chronic NSAID users[J].Clin Gastroenterol Hepatol,2005,3(1):55-59.

