油菜菌核病菌拮抗海洋细菌GM-1菌株的种类鉴定及抑菌作用研究
葛平华, 马桂珍, 付泓润, 暴增海, 王淑芳, 刘兆普
(1.南京农业大学资源与环境科学学院,江苏海洋生物重点实验室,南京 210095;2.淮海工学院海洋学院,连云港 222005)
油菜菌核病(rape sclertiniose)是由子囊菌亚门真菌核盘菌[Sclerotinia sclerotiorum (Lib.)de Ba-ry]引起的世界性病害,是油菜生产中的重要病害之一,一般年份发病率高达10%~30%,严重的年份达80%以上[1-3],因此油菜菌核病的防治一直受到重视。目前油菜菌核病的防治主要依靠化学防治,但化学防治导致环境污染以及菌株抗药性形成等问题,限制了化学农药的使用。而生物防治可弥补化学防治的不足,日益受到人们的重视,多种有益微生物用于油菜菌核病的防治,取得了显著的防治效果[4-6]。郭春燕等筛选得到一株海洋细菌Bacillus velezensis DM09,在离体试验中该菌发酵液对油菜菌核病的防效达92.51%[7]。李国庆、姜道宏等深入研究了盾壳霉对油菜菌核病的防治作用,研究表明盾壳霉分生孢子能够在油菜花瓣上定殖[8],并且盾壳霉可直接与复合肥混合使用,对油菜菌核病有明显的抑制作用[9]。本试验从连云港海域海水中筛选得到1株对油菜菌核病菌拮抗作用较强的海洋细菌GM-1菌株,对该菌株进行了种类鉴定和抗菌作用研究,现将结果报道如下。
1 材料和方法
1.1 供试菌株
油菜菌核病菌(S.sclerotiorum)由本研究室保存并提供;GM-1菌株由本实验室从连云港海域海水中分离获得。
1.2 盆栽用土与供试种子
取油菜田土,灭菌备用。供试油菜种子由种子公司购买。
1.3 培养基
油菜菌核病菌培养和抑菌试验用PDA培养基:马铃薯200g,葡萄糖20g,琼脂17g,蒸馏水1000mL;海洋细菌GM-1菌株培养用2216E培养基:蛋白胨5g、酵母粉1g、琼脂15~20g、陈海水1000mL。油菜菌核病菌固体菌种培养基:麦麸与等量的PD培养液(马铃薯200g,葡萄糖20g,蒸馏水1000mL)混匀。
1.4 GM-1菌株的种类鉴定
1.4.1 GM-1菌株形态特征观察
将菌株GM-1接种于LB培养基平板上,28℃恒温培养24h,观察记录菌落形态,并进行革兰氏染色、芽胞染色、鞭毛染色。
1.4.2 生理生化试验
生理生化试验参考文献[10]的方法,主要测定吲哚试验、M.R.试验、V.P.试验、硫化氢试验、石蕊牛奶试验、接触酶试验、糖醇发酵试验、半固体琼脂穿刺试验、好氧性和明胶液化等生理生化指标。
1.4.3 16SrDNA序列的扩增分析
GM-1菌株基因组DNA的提取参考Kingston等[11]的方法。
采用细菌16SrDNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-GGTTACCTTGTTACGACTT-3′)[12]。PCR 扩 增条件为94℃预变性4min;94℃变性50s,53℃退火50s,72℃延伸1min30s,35个循环;72℃延伸10min。采用1.0%琼脂糖对PCR扩增产物进行电泳检测。将PCR扩增产物送上海生工生物工程技术服务公司测序。经测序获得GM-1菌株16SrDNA序列提交NCBI数据库,应用BLAST程序与数据库中已有的细菌16SrDNA序列进行相似性比较,采用MEGA5软件包 Neighbour-joining(bootstrap1000)法进行序列同源性分析,构建系统发育树。
1.4.4 gyrB基因序列的扩增分析
采 用 通 用 引 物 UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGGNGGNAARTTYGA-3′)和 UP-2 (5′-AGCAGGCTACGGATGTGCGAGCCRTCNACRTCNGCKTCNGTCAT -3′)[13]进行gyrB基因序列扩增,扩增条件为95℃预变性5min,94℃1min,60℃退火1min,72℃延伸2min,35个循环,72℃10min[14]。扩增产物送上海生工生物工程技术服务公司测序。应用BLAST程序与数据库中已有的细菌gyrB序列进行相似性比较,采用MEGA5软件包 Neighbour-joining(bootstrap1000)法进行序列同源性分析,构建系统发育树。
1.5 GM-1菌株对油菜菌核病菌的抑制作用
1.5.1 GM-1菌株对油菜菌核病菌菌核萌发的影响
选取大小基本一致的菌核,用0.1%升汞溶液(W/V)浸泡菌核1min、75%乙醇溶液(V/V)浸泡菌核3~4min进行表面消毒,无菌水浸洗3~4次,用无菌滤纸吸干表面水分。将表面消毒的菌核在GM-1菌株菌液和无菌发酵液中浸泡24h,摆放在PDA平板上,每平板5粒菌核,共20个平板。28℃恒温培养,定期观察菌核萌发情况,计算菌核萌发的抑制率。以无菌水处理为对照。
1.5.2 GM-1菌株及无菌发酵液对油菜菌核病菌菌丝生长的抑制作用
GM-1菌株对油菜菌核病菌菌丝生长的抑制作用采用平板对峙法[15]。在PDA培养基平板中央接种直径为8mm油菜菌核病菌菌苔,在菌苔周围距离培养皿边缘1.5cm处划线接种GM-1菌株,于28℃倒置恒温培养,重复3次。5d后观察油菜菌核病菌菌落生长状态,测量菌落直径,计算抑菌带宽度;挑取抑菌圈交界处的菌丝,于显微镜下观察菌丝细胞形态,以正常菌丝为对照。
菌株GM-1无菌发酵液对油菜菌核病菌菌丝生长的抑制作用采用牛津杯法[16]。将油菜菌核病菌菌苔(8mm)接种在PDA平板中央,菌苔周围对称放置牛津杯,牛津杯中加入无菌发酵液200μL,重复3次。28℃恒温培养5d,观察菌落生长状态,测定抑菌带宽度,并挑取抑菌圈交界处菌丝,于显微镜下观察菌丝细胞形态,以正常菌丝为对照。
1.6 GM-1菌株促生及防治油菜菌核病的盆栽试验
1.6.1 种子催芽试验
将饱满的油菜种子在GM-1菌株发酵液中浸泡4h,取出后摆放于铺有湿润滤纸的培养皿内,每皿30粒,重复3次,以无菌水和培养液分别为对照CK1和CK2,28℃恒温培养72h,检查油菜种子的发芽数,计算发芽率,测量发芽种子的根长。
1.6.2 盆栽防病试验
采用灌根法[17]。将油菜菌核病菌的固体培养物按照每盆15g接入到装有无菌土的花盆中,室温放置4d。用GM-1菌株发酵液(100mL/盆)浸湿土壤后每盆播种10粒油菜种子,以无菌水浸湿土壤为对照CK1、培养液浸湿土壤为对照CK2,每处理10盆。播种15d后记录各处理发病株数、测量株高及苗株干重。并按以下公式计算发病率和防治效果:

2 结果与分析
2.1 海洋细菌GM-1菌株的种类鉴定
2.1.1 海洋细菌GM-1菌株的形态特征
GM-1菌株在LB固体培养基上培养24h,菌落呈圆形、隆起、乳黄色、不透明、边缘不整齐、表面湿润不光滑、生长后期菌落颜色变深。细胞呈杆状,G+,单个排列也有链状排列(图1a),有芽胞、中生(图1b),极生单鞭毛(图1c),无荚膜(图1d)。

图1 细菌GM-1细胞形态(10×100)Fig.1 Cell morphology of the strain GM-1(10×100)
2.1.2 海洋细菌GM-1菌株的生理生化试验结果
菌株GM-1可利用蔗糖、葡萄糖、半乳糖、木糖醇等糖醇进行发酵,不能利用木糖、阿拉伯糖、肌醇;并且吲哚试验、M.R.试验、V.P.试验、接触酶试验、丙二酸盐呈阳性,42℃可生长,好氧且具有运动性;在大分子试验中,菌株GM-1的石蕊牛奶试验、明胶液化试验和淀粉水解试验均显阳性,结果见表1。
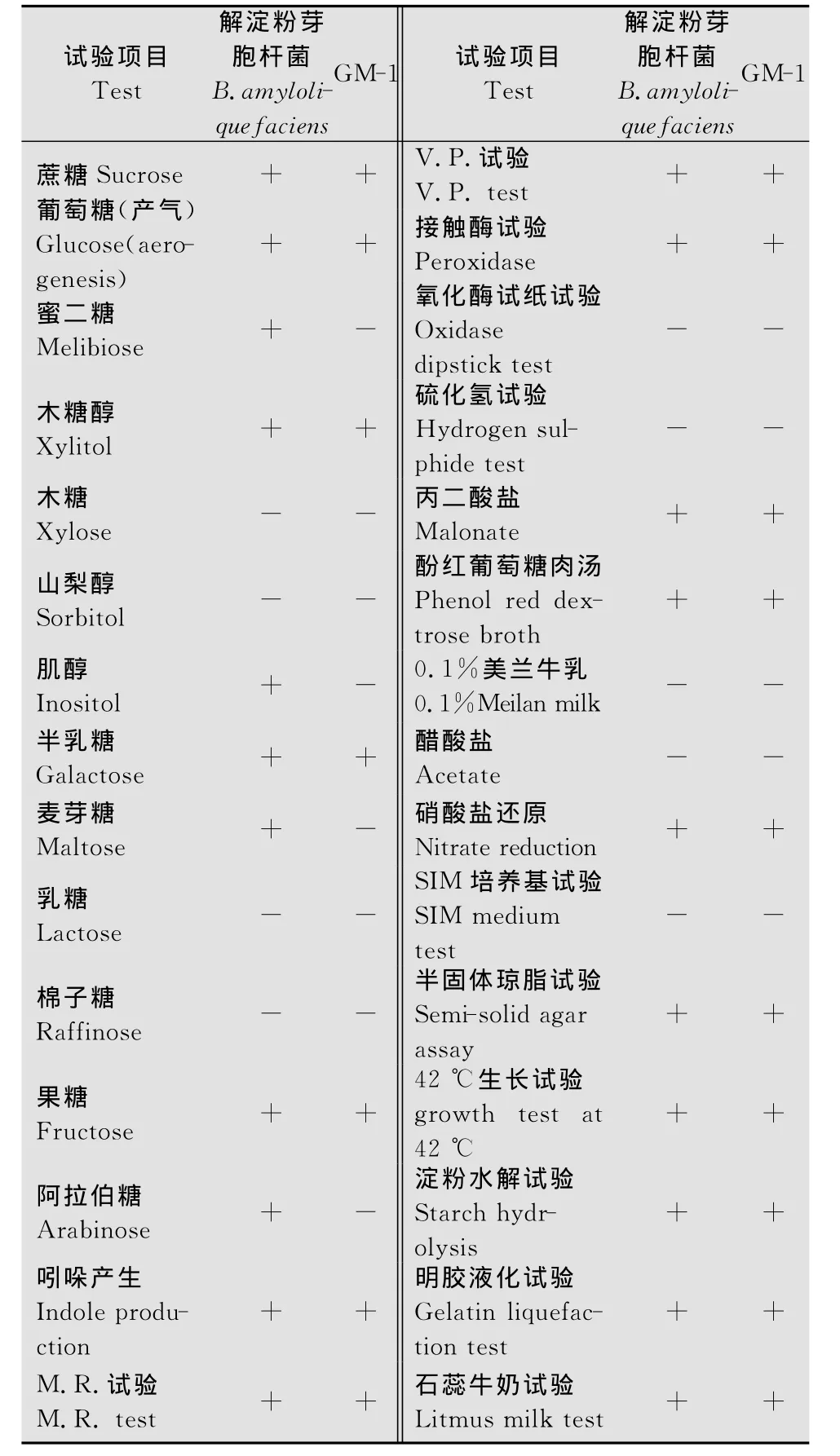
表1 细菌GM-1菌株的生理生化试验结果Table 1 Physiological and biochemical test results of the antagonistic strain GM-1
通过细菌形态学观察和一系列的生理生化试验,参照《伯杰细菌鉴定手册》[18]发现 GM-1菌株符合芽胞杆菌的特性,属于芽胞杆菌属(Bacillus)。
2.1.3 GM-1菌株16SrDNA序列分析
GM-1菌株16SrDNA序列PCR扩增产物测序得到大小为1455bp的片段。将该序列在GenBank中进行比对,结果显示,GM-1菌株与枯草芽胞杆菌(Bacillus subtilis)和解淀粉芽胞杆菌(B.amyloliquefaciens)的相似性均达98%以上。选取GenBank中相似性较高的模式菌株序列,采用MEGA5软件构建系统发育树,GM-1菌株与芽胞杆菌属中B.amyloliquefaciens在同一分支,菌株GM-1可能属于芽胞杆菌属的B.amyloliquefaciens,结果见图2。在现代微生物分类学上,16SrDNA序列已广泛地应用于研究细菌的系统发育关系。然而,在芽胞杆菌属枯草芽胞杆菌组中,不同菌株的16SrDNA序列相似性都超过了97%。因此,单纯依据16SrDNA序列并不能将菌株GM-1准确鉴定到种的水平。
2.1.4 GM-1菌株gyrB基因序列分析
gyrB基因是编码DNA促旋酶B亚基的基因。作为一种新的分子标记,该基因序列有比16SrDNA高得多的碱基替换频率,并且在细菌中普遍存在其近乎呈单拷贝形式,目前在细菌种级水平的鉴定方面具有较强的可行性[19-20]。
GM-1菌株gyrB基因序列PCR扩增产物经测序得到大小为1213bp的片段。BLAST结果表明,GM-1菌株与B.amyloliquefacien的相似度最高,为99%。采用MEGA5软件构建的系统发育树,GM-1菌株和B.amyloliquefaciens位于同一分支上,这一结果与基于16SrDNA序列分析的结果一致,结果见图3。结合形态学、生理学和分子证据,菌株GM-1应该属于B.amyloliquefaciens。

图2 GM-1菌株16SrDNA序列系统发育树Fig.2 Phylogenetic tree based on 16SrDNA sequence of GM-1

图3 GM-1菌株gyrB序列系统发育树Fig.3 Phylogenetic tree based on gyrBsequence of GM-1
2.2 GM-1菌株和发酵液对油菜菌核病菌的抑制作用
2.2.1 GM-1菌株和发酵液对油菜菌核病菌菌核萌发的抑制作用
表2、图4显示,原发酵液和无菌发酵液对油菜菌核病菌菌核的萌发有明显的抑制作用,培养1d抑制率都达到100%,3d抑制率分别为100%和90%,5d抑制率分别为100%和4%。结果表明,菌液对菌核的萌发具有很强的抑制作用,而无菌发酵液随着时间的延长抑制作用逐渐减弱。
2.2.2 GM-1菌株对油菜菌核病菌菌丝的抑制作用
GM-1菌株和无菌发酵液对油菜菌核病菌菌丝的生长具有明显的抑制作用,培养7d的抑菌带宽度分别达到30mm和16mm,见图5。
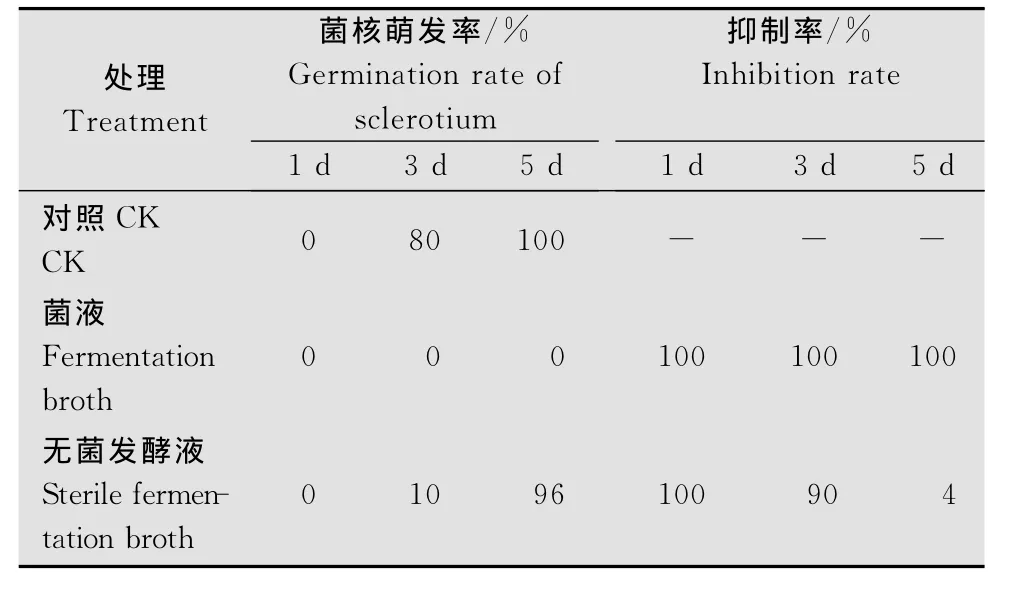
表2 GM-1菌株和发酵液对油菜菌核病菌菌核萌发的抑制作用Table 2 Inhibitory effects of the strain GM-1and sterile fermentation broth on sclerotia germination of S.sclerotiorum

图4 GM-1菌株对油菜菌核病菌菌核萌发的抑制作用Fig.4 Inhibitory effect of the strain GM-1on sclerotia germination of S.sclerotiorum
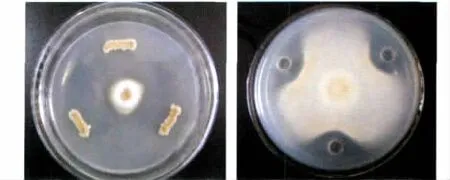
图5 GM-1菌株和无菌发酵液对油菜菌核病菌菌丝生长的抑制作用Fig.5 Inhibitory effects of the strain GM-1and sterile fermentation broth on mycelium growth of S.sclerotiorum
图6显示GM-1菌株和无菌发酵液对菌丝结构有明显的破坏作用,导致菌丝细胞壁变厚、膨大,细胞空洞、原生质分布不均匀。
2.3 GM-1菌株促生及防治油菜菌核病的盆栽试验
2.3.1 种子催芽试验
经GM-1菌株发酵液处理后油菜种子发芽率为98.9%,高于无菌水和培养液对照处理的93.3%和91.1%,且差异均达到显著水平(表3)。

图6 菌株GM-1对油菜菌核病菌菌丝细胞的抑制作用显微观察结果(10×20)Fig.6 Inhibitory effects of the strain GM-1on mycelium growth of S.sclerotiorum (10×20)

表3 GM-1菌株发酵液对油菜种子萌发的影响1)Table 3 Effects of the sterile fermentation broth of the strain GM-1on germination of rape seeds
处理后的油菜种子发芽后的平均根长为14.01mm,显著高于对照。试验中观察到,处理的种子根部比对照明显粗壮,且根尖无黄化现象,说明GM-1菌株对油菜种子的萌发生长有一定的促生作用。
2.3.2 盆栽防病试验
采用灌根法进行盆栽试验结果表明,GM-1菌株对油菜植株生长表现出明显的促生作用。经该菌发酵液处理后油菜幼苗株高为6.44cm,显著高于无菌水和培养液处理的对照;处理的发病率明显低于对照,发酵液的防病效果达到68.0%(表4)。

表4 盆栽防病试验结果Table 4 The control effects of the strain GM-1 on S.sclerotiorumby pot tests
试验中无菌水处理的CK1的发病率为52.6%,明显低于用培养液处理的CK2,导致这一结果的原因可能是由于培养液利于油菜菌核病菌的生长和侵染,因而CK2的发病率较高。
3 结论与讨论
通过形态特征观察、生理生化试验及16SrDNA序列、gyrB基因序列分析,将GM-1菌株鉴定为芽胞杆菌属的解淀粉芽胞杆菌(B.amyloliquefaciens)。
近年来Biolog、16SrDNA的序列分析等方法已广泛应用于细菌的鉴定[21],对多数细菌的鉴定发挥着重要作用,但对于相近种类难以进行准确鉴定,如解淀粉芽胞杆菌与死谷芽胞杆菌[22]以及枯草芽胞杆菌[23-24]等。
gyrB基因的分子进化速率大于16SrDNA基因,因而更适合细菌近缘种的准确区分和鉴定,Wang[25]等对8个枯草芽胞杆菌组的个体进行聚类分析时发现,当使用16SrDNA作为靶标分子时,只能将其分为两个亚群,亚群内16SrDNA的相似度多在98%以上,而gyrB基因序列在亚群中的相似度为75.2%~99.2%,表明gyrB基因可应用于细菌近缘种之间的鉴别[26]。La等在比较4种不同种属的芽胞杆菌时,同样发现基于gyrB基因的系统发育树比基于16SrDNA的系统发育树更能有效地将他们分开[27]。
抑菌作用测定结果表明:GM-1菌株和无菌发酵液对油菜菌核病菌菌丝细胞结构有明显的破坏作用,细胞壁变厚、膨大,细胞内原生质分布不均匀,明显抑制菌丝生长,培养7d的抑菌带宽度分别达到30mm和16mm,并对菌核的萌发具有明显的抑制作用,菌液的抑制明显高于无菌发酵液,其5d的抑制率达100%,无菌发酵液3d的抑制率为90%,但到5d时抑制率仅为4%。这可能是由于GM-1菌株的代谢产物可以推迟菌核的萌发时间,而不能导致菌核的死亡。
室内盆栽试验表明,GM-1菌株发酵液对油菜种子萌发和生长具有一定的促进作用,对油菜菌核病具有较好的防治效果,表现出良好的生防前景。
有关海洋解淀粉芽胞杆菌对油菜菌核病的抑制作用研究尚未见报道,本研究结果为解淀粉芽胞杆菌用于油菜菌核病的生物防治提供了理论依据,今后将开展GM-1菌株抗菌作用机制、发酵条件优化以及抗菌作用的田间试验研究。
[1] 高雪,唐凯健,王利华,等.我国油菜菌核病综合治理研究进展[J].中国植保导刊,2009,29(6):15-18.
[2] 周乐聪.油菜菌核病流行与防治的研究概况[J].中国油料,1994(4):101-108.
[3] 马桂珍,李世东,张拥华,等.核盘菌重寄生菌链孢粘帚霉HL-1-1菌株的生物学特性研究[J].植物病理学报,2004,34(4):307-313.
[4] 郑露,丁颜敏,姜道宏,等.生防菌盾壳霉ZS-1菌株对油菜菌核病的田间防治效果[J].植物保护学报,2012,39(2):191-192.
[5] Khachatourians G G.Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria[J].Canadian Medical Association Journal,1998,159(9):1129-1136.
[6] 李国庆,杨龙,姜道宏,等.重寄生菌盾壳霉及其防治核盘菌菌核病的研究进展[J].湖北植保,2009(S1):54-58.
[7] 郭春艳.海洋细菌Bacillus velezensis DM09在油菜中的定殖及对油菜菌核病的防治研究[D].武汉:华中农业大学,2010.
[8] Li G Q,Huang H C,MiaoH J,et al.Biological control of selerotinia disease of rapeseed by aerial applications of the mycoparasite Coniothyrium minitans[J].European Journal of Plant Pathology,2006,114:345-355.
[9] 杨龙,李国庆,姜道宏.盾壳霉与复合肥的相容性及其菌肥混用防治核盘菌的研究[C]∥中国植物病理学会2008年学术年会论文集.广州,2008.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-390.
[11]Kinston R E,Chen C A,Okayama H.Transfection of DNA into eukaryotic cells in Current Protocols in Molecular Biology[M].New York:John Wiley and Sons,Inc,1993:911-913.
[12]Gauthier E,Deziel E,Villemur R,et al.Initial characterization of new bacteria degrading high-molecular weight polycyclic aromatic hydrocarbons isolated from a 2-year enrichment in a two liquid-phase culture system[J].Journal of Applied Microbiology,2003,94(2):301-311.
[13]Yamamoto S,Harayama S.PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putide strains[J].Applied and Environmental Microbiology,1995,61(3):1104-1109.
[14]刘学明.枯草芽孢杆菌TR21的发酵和海洋细菌DM09抗真菌活性物质研究[D].武汉:华中农业大学,2010.
[15]暴增海,马桂珍,杨文兰,等.生防细菌BMY-1对几种植物病原真菌的抑制作用[J].中国植保导刊,2005,25(11):5-7.
[16]赵德立,曾林子,李晖,等.多粘芽孢杆菌JW-725抗菌活性物质及其发酵条件的初步研究[J].植物保护,2006,32(1):47-50.
[17]潘金菊.黄瓜菌核病拮抗细菌的分离、鉴定及抑菌活性初步研究[D].泰安:山东农业大学,2007.
[18]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第8版.北京:科学出版社,1984.
[19]喻国辉,牛春艳,陈元凤,等.利用16SrDNA结合gyrA和gyrB基因对生防芽胞杆菌R31的快速鉴定[J].中国生物防治,2010,26(2):160-166.
[20]Hou X L,Chen Z.gyrBgene,a new target identifying and classifying bacteria[J].Foreign Medical Sciences Epidemiology Lemology,2005,32(1):38-41.
[21]Lane D J.16S/23SrRNA sequencing[M]∥Stackebrandt E,Goodfellow M,eds.Nucleic acid techniques in bacteria systematics.UK:John Wiley &Sons,1991:115-175.
[22]Roberts M S,Nakamura L K,Cohan F M.Bacillus vallismortis sp.nov.,a close relative of Bacillus subtilis,isolated from soil in Death Valley,California[J].International Journal of Systematic Bacteriology,1996,46:470-475.
[23]Goto K,Omura T,Hara Y,et al.Application of the partial 16SrDNA sequence as an index for rapid identification of species in the genus Bacillus[J].The Journal of General Applied Microbiology,2000,46:1-8.
[24]Oleg N R,Christina D,Johan M,et al.Taxonomic characterization and plant colonizing abilities of some bacteria related to Bacillus amyloliquefaciens and Bacillus subtilis[J].FEMS Microbiology Ecology,2004,48:249-259.
[25]Wang L T,Lee F L,Tai C J,et al.Comparison of gyrB gene sequences,16SrRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J].International Journal of Systematic and Evolutionary Microbiology,2007,57:1846-1850.
[26]李献梅,王小芬,杨洪岩,等.促旋酶(gyrase)B亚单位基因gyrB在鉴别细菌近缘种中的应用[J].微生物学报,2008,48(5):701-706.
[27]La Duc M T,Satom I M,Agata N,et al.gyrB As a Phylogenetic Discriminator for Members of the Bacillus anthracis-cereus-thuringiensis Group[J].Journal Microbiological Methods,2004,56(3):383-394.

