BDNF对哮喘小鼠C7~T5节段脊髓后角p-CREB、CREB表达的上调作用
张宝辉 方秀斌 刘晓湘 (中国医科大学神经生物学教研室,辽宁 沈阳 110001)
现代的观点认为,支气管哮喘是一种慢性炎症疾病,而随着分子生物学、遗传学、免疫学、细胞生物学和病理学等技术的深入发展,证实了呼吸道广泛存在神经肽网,神经异常机制也越来越受到重视,认为炎症可影响神经和神经肽调控机制,而神经机制又反过来影响炎症机制。由于支气管哮喘的发病机制极其复杂,其病理机制至今尚未完全阐明。脑源性神经营养因子(BDNF)是继神经生长因子(NGF)后发现的第2个神经营养因子,研究发现,在人的气道平滑肌内,BDNF能上调Ca2+含量,认为BDNF很可能通过调节Ca2+含量来调节气道平滑肌收缩,参与哮喘等气道疾病〔1〕。另有研究证实,BDNF水平在过敏性哮喘未治疗组比健康对照组、吸入糖皮质激素治疗组明显升高,有效的治疗可降低血液循环中的BDNF水平,表明BDNF参与过敏性哮喘〔2〕。但BDNF能否通过调节p-CREB、CREB分子的表达参与哮喘仍未见文献报道。本实验旨在检测BDNF被阻断后,小鼠C7~T5节段脊髓后角内p-CREB、CREB的表达变化。
1 材料与方法
1.1 实验动物分组及模型制备 雌性BALB/c小鼠30只,由首都医科大学实验动物中心提供。按随机数字表法分组,每组10只。(1)哮喘组第1天每只小鼠腹腔注射20 μg OVA(Sigma公司)和2 mg氢氧化铝混合于0.5 ml PBS中;第8、15天每只小鼠腹腔注射10 μg OVA和1 mg氢氧化铝混合于0.5 ml PBS中;第16天开始将小鼠置于封闭容器中,给予4%OVA(PBS配成)雾化吸入激发哮喘发作,每天1次,每次25 min,连续7 d。(2)ANTI-BDNF组,第19天开始雾化吸入前3 h鼻腔给BDNF抗体,其余均与哮喘组相同。(3)正常对照组,以PBS代替OVA注射和雾化吸入,其余均与哮喘组相同。各组最后一次激发后24 h处死。
1.2 AniRes2005肺功能仪测气道反应性 用0.4%的戊巴比妥钠腹腔麻醉小鼠(80 mg/kg),疼痛反射消失后固定在小鼠体描箱内操作台上,气管插管,呼吸比 15∶10,呼吸频率90次/min,游离颈外静脉,行静脉穿刺,固定针柄,封闭体描箱。乙酰甲胆碱(mAch)用磷酸缓冲液(0.1 mol/L pH7.4)配成0.025、0.05、0.075、0.1 mg/kg,经颈外静脉各注射 0.1 ml,记录波形和数据。
1.3 免疫荧光 动物用0.4%的戊巴比妥钠腹腔麻醉(40 mg/kg体重),用4%多聚甲醛灌流固定,将组织块固定24 h,移入30%蔗糖缓冲液中至标本下沉,OCT包埋,恒冷箱切片机连续切片(片厚8 μm)。冷风干燥后,室温下血清封闭20 min,甩干;滴加一抗 p-CREB、CREB(购自 Santa Cruz公司)工作浓度为1∶150,4℃孵育过夜;PBS充分洗涤,滴加工作浓度为1∶100 FITC标记的二抗(购自Sant Crutz公司),孵育40 min;PBS充分洗涤,甘油封片。用OlympusBX51型荧光显微镜进行观察,绿色荧光为阳性表达。
1.4 统计学处理 采用SPSS13.0统计软件对数据进行统计分析,结果用±s表示,组间比较采用t检验。
2 结果
2.1 哮喘模型制作结果 正常对照组雾化吸入生理盐水后无明显哮喘反应;哮喘组动物在雾化吸入卵蛋白3次后,大部分哮喘发作,表现为呼吸频率加深加快,肋间隙凹陷,刺激性呛咳;ANTI-BDNF组动物,前3次雾化吸入卵蛋白后,大部分哮喘发作,应用BDNF抗体阻断后,诱喘反应不明显。
2.2 AniRes2005肺功能仪测气道阻力 哮喘组小鼠对mAch的浓度反应曲线明显上移,其呼气阻力和吸气阻力显著高于正常对照组(P<0.01),证明哮喘小鼠对mAch的气道反应性显著高于正常小鼠,证明哮喘模型建立成功;anti-BDNF组对mAch的浓度反应曲线明显低于哮喘组(P<0.01),提示在经鼻腔滴加BDNF抗体后,哮喘小鼠的气道高反应降低(图1)。
2.3 免疫荧光结果 CREB的检测结果:从图2上可以看出,哮喘组小鼠的C7~T5节段脊髓后角的CREB蛋白表达量显著高于于正常对照组小鼠的表达,显微图像分析表明,哮喘组CREB阳性反应产物MOD值明显高于对照组(P<0.01);相比于哮喘组,anti-BDNF组小鼠在经鼻滴加BDNF抗体后,C7~T5节段脊髓后角的CREB表达量明显低于哮喘组的表达量,显微图像分析表明,anti-BDNF组CREB阳性反应产物MOD值明显低于哮喘组(P<0.01)。
p-CREB的检测结果:从图3可以看出,哮喘组小鼠的C7-T5节段脊髓后角的p-CREB蛋白表达量显著高于于正常对照组小鼠的表达;显微图像分析表明,哮喘组p-CREB阳性反应产物MOD值明显高于对照组(P<0.01);相比于哮喘组,anti-BDNF组小鼠在经鼻滴加BDNF抗体后,C7~T5节段脊髓后角p-CREB的表达量明显低于哮喘组的表达量;显微图像分析表明,anti-BDNF组p-CREB阳性反应产物MOD值明显低于哮喘组(P<0.01)。见表1。
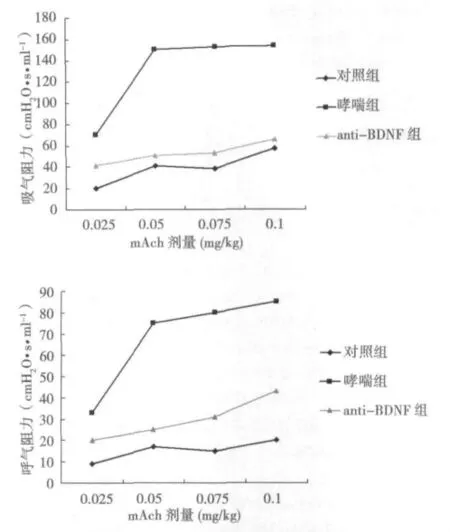
图1 Ani Res2005肺功能仪检测气道阻力
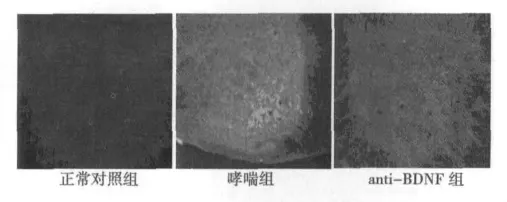
图2 免疫荧光方法检测各组小鼠CREB的表达(×200)
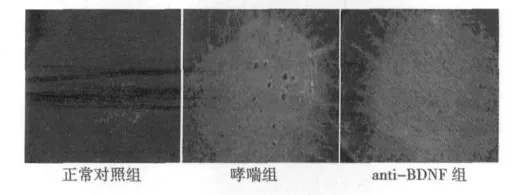
图3 免疫荧光方法检测各组小鼠p-CREB的表达(×200)
表1 各上鼠CREB、p-CREB的光密度值(±s)

表1 各上鼠CREB、p-CREB的光密度值(±s)
与哮喘组比较:1)P<0.01
CREB p-CREB正常对照组 17.43±2.361) 16.41±1.961)组别哮喘组 35.46±3.25 32.38±3.19 anti-BDNF组 29.16±3.081) 26.15±2.681)
3 讨论
支气管哮喘是由多种细胞和细胞组分参与的反复发作的可逆性气流受限和气道高反应性为特征的气道慢性非特异性炎症性疾病,我国哮喘发病率为1%,其中儿童达3%。近年来支气管哮喘与细胞信号传导的研究一直受到国内外学者的普遍关注。越来越多的研究发现哮喘发生不仅仅与免疫炎症相关,同时神经系统也参与了哮喘的发病。但对于他们之间的相互作用及其机制尚不完全清楚。
BDNF是继NGF后发现的第2个神经营养因子,二者同属于NGF家族。研究发现,在过敏性疾病中,气道上皮细胞高表达NGF和BDNF,而这些神经营养因子的表达可以延长组织嗜酸性粒细胞的存活,从而加重哮喘等过敏性疾病的发病过程。而在过敏性哮喘患者血浆、血清、血小板中BDNF水平比对照组明显升高,并与气道阻塞、气道高反应性有关,糖皮质激素可通过活化的免疫细胞抑制BDNF产生〔3〕。同时有研究发现,BDNF可影响慢性气道阻塞和局部神经元高反应性,在应用沙美特罗(β2促效剂,扩张支气管)治疗哮喘时,血清和血小板的BDNF浓度被显著上调〔4〕。综上可知,BDNF在哮喘发病机制中发挥重要作用。但是BDNF是通过哪些信号通路参与哮喘发病,在哮喘发病机制中具体发挥何种作用尚需进一步研究。
cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)是在研究生长抑素(somaostatin)基因的表达与调节时发现的,生长抑素基因的表达受cAMP信号的调控,对该基因5'端上游区域的研究发现,8个碱基对的回文序列5'-TGACGTCA-3',决定cAMP诱导的转录反应发生,这一元件被称为cAMP反应元件(cAMP-response element,CRE)。继而在寻找识别CRE模体的蛋白因子的过程中发现了43kD的CREB,CREB作为细胞内的第三信使,定位于细胞核内。在神经系统中,很多细胞外刺激物能够激活CREB及其家族成员,有赖于CREB转录的基因表达参予了从疾病发生到转变的复杂而多样的过程。在生长因子和其他刺激物调控的广泛的系列过程如:神经元细胞的增殖、生长、存活,神经元生长过程中的突出连接等中起着重要作用,而且在大脑学习与记忆、神经元保护、某些疾病的发病中也起着非常重要的作用〔5~7〕。但BDNF能否通过调节p-CREB、CREB分子的表达参与哮喘仍未见文献报道。
从免疫荧光结果可以看出,哮喘组小鼠的C7-T5节段脊髓后角的CREB、p-CREB蛋白表达量显著高于于正常对照组,相比于哮喘组,anti-BDNF组小鼠在经鼻滴加BDNF抗体后,C7-T5节段脊髓后角的CREB、p-CREB的表达量明显降低,而在应用AniRes2005肺功能仪对各组小鼠进行气道阻力测定时也发现,anti-BDNF组对mAch的浓度反应曲线明显低于哮喘组,提示在经鼻腔滴加BDNF抗体后,哮喘小鼠的气道高反应降低,这结果提示BDNF很可能是通过上调CREB的表达来参与哮喘发病机制。
1 Prakash YS,Michael A,Christina M,et al.Brain-derived neurotrophic factor in TNF-α Modulation of Ca2+in human airway smooth muscle〔J〕.Am J Respir Cell Mol Biol,2009;41(5):603-11.
2 Hahn C,Islamian AP,Renz H,et al.Airway epithelial cells produce neurotrophins and promote the survival of eosinophi is during allergic airway inflammation〔J〕.J Allergy Clin Immunol,2006;117(4):787-94.
3 Lommatzsch M,ScMoetcke K,Klotz J,et al.Brain-deriveded neurotrophic factor in platelets and airflow limitation in asthma〔J〕.Am J Respir Crit Care Med,2005;171(2):115-20.
4 Lommatzsch M,Lindner Y,Edner A,et al.Adverse effects of salmeterol in asthma:a neuronal perspective〔J〕.Thorax,2009;64(9):763-9.
5 Lonze BE,Ginty1 DD.Function and regulation of CREB family transcription factors in the nervous system〔J〕.Neuron,2002;35(4):605-23.
6 Hara T,Hamada J,Yano S,et al.CREB is required for acquisition of ischemic tolerance in gerbil hippocampal CA1 region〔J〕.J Neurochem,2003;86(4):805-14.
7 Impey S,Chen D,Lan JQ,et al.CREB2mediated Bcl22 p rotein expression after ischemic preconditioning〔J〕.J Cereb Blood Flow Metab,2005;25(2):234-46.

