抗凝全血中miRNA130a的表达与维吾尔族人群肥胖的关系
朱曼丽 焦 谊 龙 梅 毛新民 马晓丽 古扎丽努尔·艾尔肯 武 云 王 烨 李琳琳
(新疆医科大学基础医学院药理教研室,新疆 乌鲁木齐 830011)
随着高脂肪、低碳水化合物饮食日益增多,体力活动强度和劳动强度的普遍下降,我国人群超重和肥胖率呈明显增加趋势〔1〕。在新疆地区由于特殊的地理环境和少数民族独特的生活方式使得维吾尔族人群肥胖的流行状况和特征存在与其他民族不同之处,研究显示维吾尔族男女人群超重的患病率分别是61.33%和60.77%,较其他民族偏高,同时还显示维吾尔族是超重、腹型肥胖的高发人群〔2〕。陶义存等〔3〕的研究也提示,维吾尔族腹型肥胖是诱发脂代谢紊乱、2型糖尿病的危险因素。最近的研究发现微小RNA(microRNA,miRNA)在调节脂肪细胞分化、脂肪代谢通路上起着重要的作用〔4〕,参与肥胖〔5~8〕、胰岛素抵抗〔5〕、糖尿病〔6〕、炎症〔7〕的发生与发展。因此本研究采用芯片初筛及实时荧光定量PCR方法验证,初步探讨miRNA与维吾尔族肥胖症的关系,旨为维吾尔族抗凝全血中miRNA的表达变化与肥胖的相关性研究提供理论依据。
1 材料与方法
1.1 主要试剂、仪器 TRIzol REAGENT BD(MRC),异丙醇,氯仿(SIGMA),miRNeasy mini KitmiScriptⅡ RT Kit、miScript SYBR®Green PCR kit、miScript Primer Assays、10 × miScript Universal Primer(德国Qiagen公司)。低温高速离心机,涡旋混合器,实时荧光定量PCR热循环仪购自ABI公司。
1.2 标本采集 维吾尔族非肥胖与肥胖抗凝全血样本各5例,用于微列阵芯片实验,后续收集维吾尔族抗凝血样本,非肥胖组∶肥胖组(16例∶12例)用于实时荧光PCR验证。样本采自新疆医科大学第一附属医院内分泌VIP二病区。样本均为受调查者早晨空腹的新鲜抗凝血样。该方案已通过新疆医科大学第一附属医院伦理委员会的审查,同时征得研究个体的同意并填写了知情同意书。肥胖分型根据国际和亚太地区推荐对肥胖诊断的标准〔9〕,BMI>25 kg/m2为肥胖,同时排除高血压、高血脂、糖尿病以及糖耐量异常者。
1.3 方法
1.3.1 临床指标的测定 受试者脱鞋、免冠,测量身高、体重、腰围、臀围,并计算BMI。测量两次收缩压与舒张压,并取平均值;采集肘静脉血5 ml,分别测空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等生化指标,胰岛素抵抗指数(IR)用最小稳态模型方法判定,公式为:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5。
1.3.2 微列阵芯片杂交 按照说明书TRI REAGENT BD的方法提取总RNA,测其质量浓度及完整性。分离RNA,采用miRCURYTM Hy3TM/Hy5TM Power标记试剂盒进行miRNA标记。采用miRCURYTM LNA microRNA芯片对Hy3TM标记样品进行杂交,后采用Axon GenePix 4000B微阵列芯片扫描仪扫描,最后进行数据统计。
1.3.3 抗凝血中提取总RNA及逆转录 用TRI REAGENT BD的方法提取总RNA样品;在冰上准备反转录的体系根据miScriptⅡ RT Kit试剂盒说明书进行逆转录,在37℃孵育60 min,95℃孵育5 min条件下合成单链cDNA。
1.3.4 实时荧光定量PCR 取逆转录产物cDNA模板2 μl,配制PCR总反应体系20 μl。参照miScript SYBR®Green PCR kit说明书试剂盒说明操作,进行实时荧光定量PCR扩增。反应条件:预变性 95℃ 15 min,变性94℃ 15 s,退火 55℃ 30 s,延伸70℃ 35 s,40个循环。每个样本重复2次。
2 结果
2.1 芯片检测结果 采用的miRCURY LNATM microRNA Array含有miRBase 16.0公布的人源、小鼠、大鼠、及病毒miRNA。杂交后miRNA芯片经扫描、软件分析及标准化处理,同时也经过3种生物信息学靶基因软件预测,结果显示在维吾尔族肥胖组与非肥胖组比较,foldchange值为0.246倍,miRNA130a在维吾尔族肥胖组中显著低表达,表达量差异有统计学意义〔(0.28±0.13)vs(1.14±0.32),P <0.05〕。
2.2 维吾尔族肥胖与非肥胖组间体检及生化指标的比较 肥胖组身高、体重、体重指数、腰围和腹围、收缩压均大于非肥胖组,并且差异有统计学意义(P﹤0.05)。其余指标在两组间比较差异无统计学意义。结果也说明维吾尔族肥胖人群具有腹型肥胖的特征,其中FPG和HDL-C的数据需要正态变换。见表1、表2。
表1 维吾尔族肥胖与非肥胖组间体检指标的比较(±s)
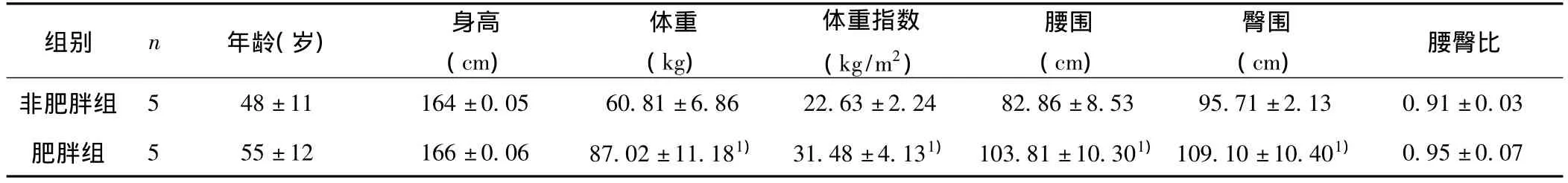
表1 维吾尔族肥胖与非肥胖组间体检指标的比较(±s)
与非肥胖组比较:1)P﹤0.05
腰臀比非肥胖组 5 48±11 164±0.05 60.81±6.86 22.63±2.24 82.86组别 n 年龄(岁) 身高(cm)体重(kg)体重指数(kg/m2)腰围(cm)臀围(cm)±8.53 95.71±2.13 0.91±0.03肥胖组 5 55±12 166±0.06 87.02±11.181) 31.48±4.131) 103.81±10.301)109.10±10.401)0.95±0.07
表2 维吾尔族肥胖与非肥胖组间生化指标的比较(±s)
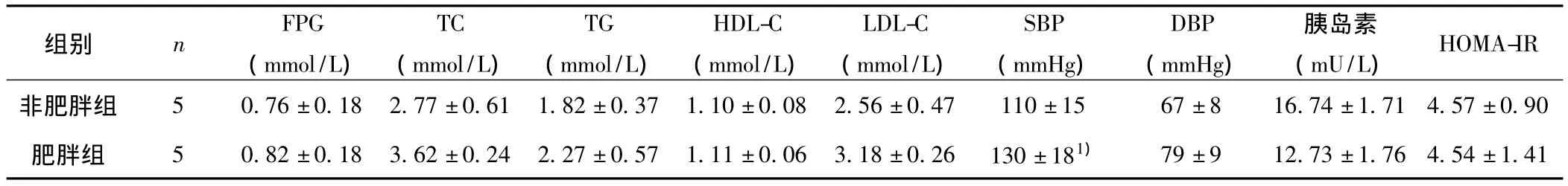
表2 维吾尔族肥胖与非肥胖组间生化指标的比较(±s)
与非肥胖组比较:1)P﹤0.05;FPG、HDL-C经过正态性变换
HOMA-IR非肥胖组 5 0.76±0.18 2.77±0.61 1.82±0.37 1.10±0.08 2.组别 n FPG(mmol/L)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)SBP(mmHg)DBP(mmHg)胰岛素(mU/L)56±0.47 110±15 67±8 16.74±1.71 4.57±0.90肥胖组 5 0.82±0.18 3.62±0.24 2.27±0.57 1.11±0.06 3.18±0.26 130±181)79±9 12.73±1.76 4.54±1.41
2.3 RT-PCR检测miRNA130a在维吾尔族肥胖和非肥胖组抗凝全血中表达 本实验中实时荧光定量采用相对定量中法的比较Ct法进行定量。目的基因的量(RQ)=2-△△Ct(以校正后的2-△△Ct比较样本间的基因表达差异)。实时荧光定量PCR分析结果显示:miRNA130a在维吾尔族肥胖与非肥胖组外周抗凝全血组间的表达量表达变化有统计学意义〔(4.12±1.06)vs(1.27±0.27),P<0.05〕。在维吾尔族肥胖组的miRNA130a的表达量下降,这一结果与芯片的结果有一致性。另外,miRNA130的扩增曲线和熔解曲线都说明了实时荧光定量PCR产物的特异性较好。
2.4 miRNA130a与维吾尔族肥胖组和非肥胖组中临床指标的相关分析 在维吾尔族肥胖与非肥胖组这个研究对象总体中,miRNA130a的表达量与 FPG呈负相关(r=-0.389,P<0.05),与TC呈负相关(r= -0.409,P<0.05),与 HDL-C呈正相关(r=0.368,P<0.05),而与身高、体重、腰围、臀围、腰臀比、收缩压、舒张压、TG、LDL-C、HOMA-IR无相关。提示随着miRNA130a的表达量增加,空腹血糖和总胆固醇的水平会逐渐下降,HDL-C的水平会逐渐上升。
3 讨论
肥胖是指体内脂肪堆积过多和(或)分布异常、以体重增加为主要特征的代谢异常〔10〕。它的发生是机体能量代谢失调的结果,其确切的发病机制未全明了,目前认为与遗传因素、中枢神经系统异常、内分泌功能紊乱、代谢因素和营养因素不平衡等有关。肥胖会带来一系列生理功能的改变,可以诱发与心血管疾病相关的多种代谢功能异常,会增加T2DM、冠心病、充血性心力衰竭、高血压、脂质异常血症及某些癌症(如卵巢癌、胸腺癌和结肠癌)等的发病率和死亡〔11〕。因此,肥胖已经严重影响人类的健康,而脂肪细胞的分化直接影响着这些疾病的发生发展过程。在细胞生物学方面肥胖主要表现为脂肪细胞在数量上的异常增加和体积上的异常增大,因此成脂分化一直是肥胖研究的重要方向〔12〕。
miRNA对多种生理病理过程具有重要的调控作用,诸如细胞的增殖与凋亡,细胞的分化,生物体的生长发育,肿瘤的形成等〔13〕。miRNA是一大类内源性非编码小RNA,通过与靶基因3'-UTR的配对,促进mRNA的降解或抑制mRNA的翻译从而抑制其靶基因的表达〔14〕。其占人类已预测基因的3%以上,调控约30%的蛋白编码基因〔15〕。自 2003年 Xu等〔16〕首次在果蝇中发现miRNA14对调控脂肪代谢具有重要调节作用以来,研究者对这一新的调节方式产生了浓厚的兴趣。Esau等〔17〕的研究识别了对脂肪细胞分化有促进作用的miRNA143。Poy等〔18〕在胰腺内分泌的细胞中克隆并识别了进化保守的胰岛-特异miRNA375。2007年,He等〔19〕研究表明糖尿病鼠中 miRNA29过度表达导致3T3-L1前体脂肪细胞胰岛素抵抗。这些都表明miRNA在脂肪细胞的分化发面起了举足轻重的作用。因此,miRNA在脂肪生成的调节及肥胖的研究中成为热点〔12〕。
本研究结果发现在维吾尔族肥胖组抗凝全血中miRNA130a的表达量也降低,这一结果与芯片结果有一致性。同时有研究表明,miRNA130调节脂肪细胞生成,miRNA130a、b在成脂细胞中比在前脂肪细胞中的表达量低〔4〕。此研究与本实验结果都提示miRNA130a可能参与了脂肪成脂分化过程,进一步也提示miRNA130a的表达量下降可能与BMI≥25的维吾尔族肥胖相关。
文献报道由于单纯体重不能充分反映体内脂肪的含量,体重指数这一指标考虑了体重和身高个因素,可反映全身性超重和肥胖症,腰围是反映脂肪总量和脂肪分布结构的综合指标,可代替腰臀比预测中央性脂肪含量〔10〕。本实验结果说明miRNA130a与血糖、血脂有相关性,也提示若在维吾尔肥胖组miRNA130a表达水平升高,那么空腹血糖、总胆固醇以及HDL-C水平也许可能会有改善。
目前研究表明差异表达的miRNAs在参与调节脂肪组织代谢通路上有其特定的靶基因与功能〔20〕。Esau等〔17〕利用生物信息学预测 miRNA143的靶标是ERK5,通过实验也表明miRNA143可能通过靶基因 ERK5参与脂肪细胞分化。Wilfred等〔21〕发现了miRNA相似物miRNA103/107,它们能够对代谢途径进行调控miRNA,生物信息学预测 miRNA103/107是通过影响细胞内乙酰-COA来调控脂类代谢。本研究发现有:PPARγ,TNF,CD69,SOXZ1等多个靶基因,这些靶基因分别涉及脂肪分化,免疫调节,硫代谢、信号转导等多种功能,后续我们也将继续进行功能研究,验证这些靶基因对维吾尔族肥胖可能的调节作用。
目前虽已经明确miRNA130a在脂肪细胞分化发面起了举足轻重的作用,但是miRNA130a是通过何种方式引起脂肪细胞分化及肥胖改变的,目前还不十分清楚,这也有待进一步研究。目前,用实验方法和计算机生物信息学手段明确了在维吾尔族肥胖人群miRNA130a及其靶标,这也为揭示它的功能奠定了基础。因此,在此基础之上探明miRNA130a对脂肪细胞分化的具体调节作用以及作用机制将是对研究维吾尔族肥胖调控的相关理论提供新的理论依据,这研究必将成为防治与脂肪细胞分化及肥胖有关的代谢性疾病提供新的治疗方向。
1 武阳丰,马冠生,胡永华,等.中国居民的超重和肥胖流行现状〔J〕.中华预防医学杂志,2005;39(5):316-20.
2 周 玲,李南方,洪 静,等.新疆维汉哈三民族人群肥胖的流行病学调查研究〔J〕.中国预防医学杂志,2011;12(2):139-42.
3 陶义存,李琳琳,王 松,等.维哈两民族肥胖与部分脂肪细胞因子的关系研究〔J〕.新疆医学,2008;38(5):19-22.
4 Eun Kyung Lee,Mi Jeong Lee,Kotb Abdelmohsen,et al.miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor expression〔J〕.Mol Cell Biol,2011;31(4):626-38.
5 Foley NH,O'Neill LA.miR-107:a Toll-like receptor-regulated miRNA dysregulated in obesity and typeⅡdiabetes〔J〕.J Leuk Biol,2012;92(3):521-7.
6 Ono K.MicroRNA links obesity and impaired glucose metabolism〔J〕.Cell Res,2011;21(6):864-6.
7 Hulsmans M,De Keyzer D,Holvoet P.MicroRNAs regulating oxidative stress and inflammation in relation to obesity and atherosclerosis〔J〕.FASEB J,2011;25(8):2515-27.
8 McGregor RA,Choi MS.microRNAs in the regulation of adipogenesis and obesity〔J〕.Curr Mol Med,2011;11(4):304-16.
9 董砚虎,孙黎明,李 利.肥胖的新定义及亚太地区肥胖诊断的重新评估与探讨〔J〕.辽宁实用糖尿病杂志,2001;9(2):3-6.
10 傅祖植.肥胖症的诊断和治疗进展〔J〕.新医学,2003;34(9):580-2.
11 Arner P.Obesity-a genetic disease of adipose tissue〔J〕.Br J Nutr,2000;83(Suppl)1:S9-16.
12 Gregoire FM,Smas CM,Sul HS,et al.Understanding adipocyte differentiation〔J〕.Physiol Rev,1998;78(3):783-809.
13 Tsuchiya S,Okuno Y,Tsujimoto G.MicroRNA:biogenetic and functional mechanisms and involvements in cell differentiation and cancer〔J〕.J Pharmacol,2006;101(4):267-70.
14 Stefani G,Slack FJ.Small non-coding RNAs in animal development〔J〕.Nat Rev Mol Cell Biol,2008;9(3):219-30.
15 Labib M.The investigation and management of obesity〔J〕.J Clin Pathol,2003;56(1):17-25.
16 Xu P,Vernooy SY,Guo M,et al.The Drosophila microRNA Mir-14 suppresses cell death and is required for normal fat metabolism〔J〕.Curr Biol,2003;13(9):790-5.
17 Esau C,Kang X,Peralta E,et al.MicroRNA-143 regulates adipocyte dif-ferentiation〔J〕.J Biol Chem,2004;279(50):52361-5.
18 Poy MN,Ellasson L,Krutzfeldt J,et al.A pancreatic islet-specific microRNA regulates insulin secretion〔J〕.Nature,2004;432(7014):226-30.
19 He A,Zhu L,Gupta N,et al.Overexpression of micro ribonucleic acid miR-29,highly up-regulated in diabetic rats,leads to insulin resistance in 3T3-L1 adipocytes〔J〕.Mol Endocrinol,2007;21(11):2785-94.
20 Lim LP,Lau NC,Garrett-Engele P,et al.Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs〔J〕.Nature,2005;433(7027):769-73.
21 Wilfred BR,Wang WX,Nelson PT.Energizing miRNA research:miR-103/107 regulates human metabolic pathways〔J〕.Mol Genet Metab,2007;91(3):209-17.

