cDNA-AFLP技术在番茄及其黄化曲叶病毒互作中的应用
袁 伟,万红建,刘云飞,俞 锞,杨悦俭
(1.浙江省农业科学院 蔬菜研究所,浙江 杭州 310021;2.南京农业大学 园艺学院,江苏 南京 210095)
基因表达是遗传信息表现为生物性状的过程,是按时间和空间顺序进行的,这种表达的方式称为基因的差异表达[1]。研究基因差异表达的方法很多,如抑制消减杂交,电子克隆技术,基因芯片和cDNA-AFLP技术等[2]。其中 cDNA-AFLP技术由于其重复性高,假阳性低,操作方便快捷,可反映基因间表达量的差异等优势被广泛应用在植物生物胁迫和非生物胁迫等多个领域。目前许多研究者将该技术用于基因的差异表达分析,尤其在抗病相关基因方面取得了较好的研究成果[3-5]。
番茄 (Solanum lycopersicumMill.)属于茄科番茄属,是世界性的蔬菜作物之一。近年来,随着番茄栽培面积的增加,番茄黄化曲叶病毒病(TYLCD)已经成为番茄生产中最严重的病害之一。据初步统计,至少有40个国家的番茄正遭受此类病害的毁灭[6]。该病害首先在中国南方大面积爆发,自南向北发展,给我国的番茄产业带来了毁灭性的灾害[7-11]。该病害由番茄黄化曲叶病毒(TYLCV)引起,一旦发病,会造成番茄大幅度减产甚至绝收[12]。
目前,越来越多抗TYLCV的野生番茄被筛选出来,通过野生番茄与栽培番茄杂交可以将抗病基因转入到栽培番茄,从而缓解病害的发展。随着分子标记技术的快速发展,研究者已经鉴定了5种不同抗 TYLCV的基因,分别为Ty-1,Ty-2,Ty-3,Ty-4和Ty-5[13-17],其中Ty-2抗病基因被广泛应用于育种实践之中。为了揭示番茄抗TYLCV的机理,本文初步分析cDNA-AFLP技术在番茄 (含有Ty-2抗病基因)与TYLCV互作过程中的应用,筛选差异表达片段,为今后克隆与Ty-2基因相关基因奠定基础。
1 材料与方法
1.1 材料
Banerjee等[18]从多毛番茄 B1063中选育得到抗TYLCV的材料-H24(含有Ty-2抗病基因),本文使用经H24转育后获得的抗病材料07-027进行实验研究,番茄植株生长于人工控制的气候室内(白天25℃,夜间18℃)。
1.2 TYLCV的接种
当番茄材料长到4片真叶时,进行TYLCV的接种,将带有TYLCV的农杆菌摇至D值为0.6~1.0,接种部位为番茄茎段的韧皮部,接种量保持一致,每株300 μL菌液。
1.3 总RNA的提取及双链cDNA的合成
分别于接种后0,7,14,21,28,35 d取样,采用混合取样法摘取番茄幼嫩叶片,用锡箔纸包好于液氮中保存并放于-80℃超低温冰箱冷冻保存。
RNA的提取及cDNA的获得。RNA的提取采用Trizol法,cDNA的合成采用TaKaRa公司cDNA Synthesis kit合成双链cDNA试剂盒,随后调整6个样品的cDNA浓度,使其一致。
1.4 cDNA-AFLP技术
cDNA-AFLP体系及程序参照 Vos等[19]的方法。分别用EcoRI,MseI酶切双链 cDNA,37℃下4~6 h后与相应接头连接,16℃过夜;连接后产物用预扩增引物扩增,将稀释20倍的预扩增产物作为模板进行选择性扩增,以筛选抗黄化曲叶病毒病相关基因差异表达片段。接头、预扩增及选择性扩增的引物见表1,其中选择性扩增引物互相配对共64对。使用Bio-labs公司的SEQENCE-GT型电泳仪和测序电泳装置,采用6%聚丙烯酰胺凝胶进行电泳 (PAGE)分析。
为减少假阳性对试验结果的干扰,本试验对每个引物组合均作2次PCR扩增,只统计在2次扩增中都能稳定出现的条带。

表1 接头,预扩增及选择性扩增引物
2 结果与分析
2.1 RNA和cDNA质量检测
本试验使用 Trizol法提取的幼叶总RNA具有较高的纯度和浓度。1.2%琼脂糖电泳检测时可以看到亮而清晰的28S,18S和5S三条带 (图1),且28S带亮度略强于18S带。经紫外分光光度计检测,D260/D280值为 1.8~2.0,D260/D230值 >2.0,表明RNA纯度较好,基本无降解,蛋白质和酚类的污染少,效果比较理想,可以用于下一步实验。
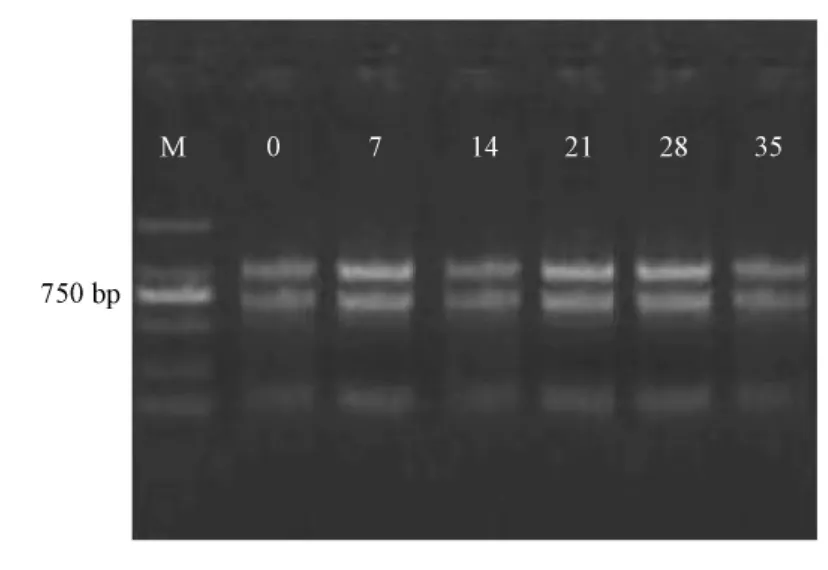
图1 RNA的琼脂糖凝胶电泳检测结果
RNA经纯化后,使用cDNA合成试剂盒合成双链cDNA,通过扩增其内参基因来进行检测。本文选用的内参基因为GAPDH(gi:380036164),上游引物 F:GGCTGCAATCAAGGAGGAA,下游引物R:AAATCAATCACACGGGAACTG,目的片段大小为220 bp左右,通过PCR扩增后,用1.2%的琼脂糖电泳进行检测 (图2),检测结果表明,条带单一且清晰,双链cDNA具有较好的质量及较高的浓度。

图2 cDNA的GAPDH扩增结果
2.2 酶切、连接和预扩产物的检测
选择有6个碱基识别位点限制性内切酶EcoRI和MseI,对合成的双链cDNA进行酶切,经1.2%的琼脂糖凝胶电泳检测 (图3),均看到 100~2 000 bp的弥散条带,表明酶切充分,其中100~750 bp条带很亮,表明片段大多分布在这一区域内。

图3 酶切产物的琼脂糖电泳检测结果
酶切产物经连接之后,使用预扩增产物进行与扩增,对于预扩增的产物用1.2%的琼脂糖凝胶电泳检测 (图 4)。结果表明,条带100~1 500 bp,条带弥散稳定,产物清晰,可用于下一步的选择性扩增。
2.3 cDNA-AFLP的差异表达分析
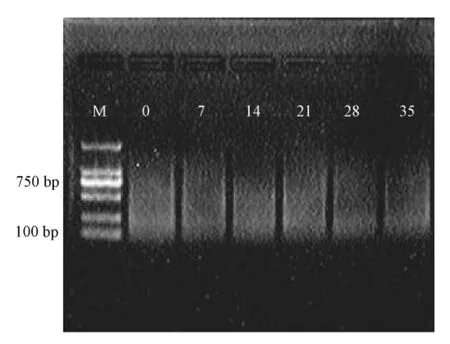
图4 预扩增产物的琼脂糖电泳检测结果
基因的表达差异在cDNA-AFLP的转录谱上主要表现为2个方面:量的差异 (条带的深或浅)和质的差异 (条带有或无)。本研究共选用64对引物进行选择性扩增,分析抗TYLCV的番茄材料在不同时段中基因的差异表达。结果表明,共扩增出2 149条转录片段,其中差异条带287条,上调156条,下调131条。图5为部分cDNA-AFLP的转录图谱,引物对分别为E-ACG/M-CTG, E-ACG/M-CCT, E-AGG/M-CAT,E-ACG/M-ACT。
从量的差异方面来看,图5中A,B对应的图表示有量的变化,箭头所指的部分表明该转录片段随着时间的变化,表达量亦发生了改变,A中箭头所指的转录片段在接种后的14,21,28 d表达量升高,整体呈现先升高后下降的趋势;从质的差异方面来看,图5中 C,D对应的图表示有质的变化,箭头所指的部分表明该转录片段随着时间的变化,间歇性地表达,C中箭头所指的转录片段在接种后的7,21,35 d没有表达。
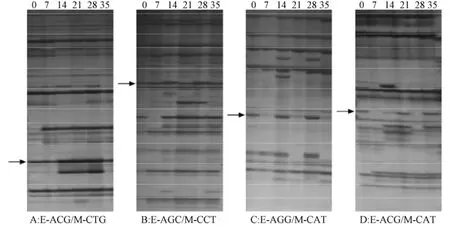
图5 部分选择性扩增引物在6个不同时段的扩增谱带
3 小结和讨论
试验中 RNA的提取采用Trizol法。在提取过程中,首先要防止RNA的降解,因为在周围的空气及一切实验器材上都避免不了RNA酶的存在;其次要减少DNA、蛋白质及酚类物质的污染,提高RNA的纯度。从结果看,试验中提取的RNA质量及纯度均较高,适合用于下一步的研究。检测合成的双链 cDNA,采用番茄最常用的内参基因GAPDH。从电泳图中可以看出条带大小,亮度均十分一致,表明双链cDNA的浓度一致,减少了检测样本之间的差异。酶切和预扩增产物的检测可以清晰的看到弥散均匀的条带,表明双酶切可以使酶切更充分,而预扩增可以使与预扩增引物配对的片段都预先扩增出来,防止其它过多的条带影响选择性扩增的结果,并为下一步的选择性扩增提供了高质量的模板。
通过选择性扩增共获得287个转录差异片段,表明存在很多的与抗TYLCV相关的候选基因可能与抗病防御机制的功能蛋白相关。转录片段的差异表现从两个不同的方面体现:首先是表达量的差异。某些基因的转录水平在各时间段表现出表达量的增强或减少。其次是质的差异。基因的表达在某一时间段甚至不表达,而在另一时间段又恢复表达。由于cDNA-AFLP技术显示的是在植物转录水平上的差异,因此从分析结果看,表明基因的表达受到时间和空间的多重影响,番茄与TYLCV之间的互作机制和抗病反应也是植物体一系列功能基因转录水平上发生变化的综合反应。
本研究表明,cDNA-AFLP技术对于揭示番茄与TYLCV互作机理是一种有效的方法,同时获得的差异片段也可用于番茄抗TYLCV相关基因的克隆,为未来鉴定这些基因的功能奠定基础。
[1]曹仪植.植物分子生物学 [M].北京:高等教育出版社,2002:184.
[2]罗永华,丁兆忠.分析基因差异表达的几种方法 [J].中国兽医杂志,2010(4):65-67.
[3]郭军,崔冬玉,王晓武,等.cDNA-AFLP结合研究马铃薯晚疫病菌小种特异无毒基因差异表达片段 [J].中国马铃薯,2004,18(1):1-3.
[4]Zheng X, Chen X, Zhang X, et al. Isolation and identification of a gene in response to rice blast disease in rice[J].Plant Mol Biol,2004,54(1):99 -109.
[5]Christina E,Michael K,Katja L,et al.Identification of powderymildew induced barley genes by cDNA-AFLP:functional assessment of an early expressed MAP kinase [J].Plant Molecular Biology,2004,55:1-15.
[6]Boulton M I.Geminiviruses:major threats to world agriculture[J].Annals of Applied Biology,2003,142:143-143.
[7]蔡健和,秦碧霞,朱桂宁,等.番茄黄化曲叶病毒病在广西爆发的原因和防治策略 [J].中国蔬菜,2006(7):47-48.
[8]王冬生,匡开源,张穗,等.上海温室番茄黄化曲叶病毒病的发生与防治 [J].长江蔬菜,2006(10):19-20.
[9]何自福,虞皓,毛明杰,等.中国台湾番茄曲叶病毒侵染引起广东番茄黄化曲叶病 [J].农业生物技术学报,2007,15(1):119-123.
[10]Xu Y,Cai X,Zhou X.Tomato leaf curl Guangxi virus is a distinct monopartitebegomovirusspecies[J].European Journal of Plant Pathology,2007,118(3):287-294.
[11]赵统敏,余文贵,周益军,等.江苏省番茄黄化曲叶病毒病 (TYLCD)的发生与诊断初报 [J].江苏农业学报,2008,23(6):654-655.
[12]谢艳,张仲凯.粉虱传双生病毒的TAS-ELISA及PCR快速检测 [J].植物病理学报,2002,32(2):182-186.
[13]Zamir D,Eksteinmichelson I,Zakay Y,et al.Mapping and introgression of a tomato yellow leaf curl virus tolerance geneTY-1 [J].Theoretical and Applied Genetics,1994,88(2)141-146.
[14]Ji Y, SchusterD L, ScottJW.Ty-3, abegomovirusresistance locus near the tomato yellow leaf curl virus resistance locusTy-1 on chromosome 6 oftomato[J]. Molecular breeding,2007,20:271-284.
[15]Hanson P,Green S K,Kuo G.Ty-2,a gene on chromosome 11 conditioning geminivirus resistance in tomato[J].Tomato Genet Coop Rep,2006,56:17-18.
[16]Ji Y,Scott J W,Maxwell D P,et al.Ty-4,a tomato yellow leaf curl virus resistance gene on chromosome 3 of tomato [J].Tomato Genet Coop Rep,2008,58:29-31.
[17]Anbinder I,Reuveni M,Azari R,et al.Molecular dissection of Tomato leaf curl virus resistance in tomato lineTY172 derived fromSolanumperuvianum[J]. Theoreticaland Applied Genetics,2009,119:519-530.
[18]Banerjee M K,Kallo G.Inheritance of tomato leaf curl virus resistance inLycopersiconhirsutumf.glabratum[J].Euphytica,1987,36:581-584.
[19]Vos P,Hogers R,BleekerM,et al.AFLP:A new technique for DNA finger printing[J].Nucleic Acids Research,1995,23:4407-4414.

