热疗诱导人肝癌细胞HepG2的凋亡
张 力 李毅学 张立广 何瑞龙 (承德医学院附属医院放疗科,河北 承德 067000)
研究表明,肿瘤细胞对于高温的敏感性明显高于正常细胞,高热治疗恶性肿瘤是近年来国内外迅速推广的一种治疗癌症的新方法,并已显出良好的疗效〔1,2〕。近年来,随着热疗理论和技术的发展,将热疗与手术等其他常规治疗方法联合应用可在肿瘤治疗中发挥协同作用〔3〕。尽管热疗在肿瘤综合治疗中得到广泛运用,但有关热疗的理论研究相对滞后,其分子生物学机制的探讨尚不深入。本研究观察热疗不同时间诱导肝癌细胞株HepG2凋亡的效果,并初步探讨其可能的机制,从而为临床应用提供可靠的实验基础。
1 材料与方法
1.1 材料 RPMI1640培养基(GIBCO公司),肝癌细胞株HepG2、AnnexinⅤ-EGFP凋亡试剂盒(南京凯基生物科技有限公司),Bax,Bcl-2 RT-PCR引物是由上海生物工程有限公司设计,Trizol试剂、RT-PCR试剂盒、DNA MarkerDL1000购自大连宝生物公司。
1.2 细胞培养 人肝癌细胞株HepG2:为单层贴壁生长,置于培养液为RPMI1640培养基,内含10%新生牛血清,100 μ/ml青霉素,100 μg/ml链霉素,37℃,5%CO2培养箱内培养至指数生长期进行实验,隔2~3 d传代一次,细胞消化液为0.25%的胰酶。按每瓶5 μl(1×104)细胞悬液接种于培养瓶内,于37℃,5%CO2培养箱内培养24 h后(细胞已贴壁),用于实验。
1.3 实验分组与处理方法 对照组:不做任何处理,一直在培养箱内。热疗组:随机取12瓶细胞,分别置于温度为(43±0.1)℃水浴箱内,分别加热0.5,1,1.5 h再放回37℃,5%CO2培养箱内继续培养24 h。
1.4 AnnexinⅤ/PI双染法流式细胞仪检测肝癌细胞凋亡率取各组 HepG2细胞,用0.25%胰酶消化,1 000 r/min离心10 min,弃上清。加入1 ml冷的PBS,轻轻震荡使细胞悬浮,重复上述步骤。将细胞重悬于250 μl上样缓冲,加入10 μl AnnexinⅤ-EGFP 和 5 μl PI,轻轻混匀,室温避光反应 15 min,上机检测。自动检测出肝癌细胞凋亡率。结果判定:AnnexinⅤ-/PI-为正常细胞,AnnexinⅤ +/PI-为凋亡细胞,AnnexinⅤ +/PI+为坏死细胞。
1.5 RT-PCR检测肝癌细胞Bax,Bcl-2 mRNA的表达 收集细胞,应用Trizol提取细胞总RNA,提取的RNA样品用无RNase污染的水溶解,测定260/280 nm吸光度值,琼脂糖凝胶电泳检测显示所提RNA完整性。按照通用型RT-PCR试剂盒进行具体操作。Bax基因的引物序列上游:5'ACCAAGAAGCTGAGCGAGTGTC3',下 游:5'GGCAGACCGTGACCATCTTTGT3',扩增产物365 bp;Bcl-2基因的引物序列上游:5'TGCACCTGACGCCCTTCAC3',下 游:5'AGACAGCCAGGAGAAATCAAACAG3',扩增产物 293 bp;β-actin上游引物:5'TTCATTGACCTCAACTACAT3',下游引物 5'GAGGGGCCATCCACAGTCTT3',扩增产物 467 bp。PCR 扩增 Bax:94℃ 3 min,94℃ 40 s,58℃50 s,72℃ 2 min,72℃ 10 min,30 个循环;Bcl-2:94℃ 3 min ,94℃ 40 s,59℃ 50 s,72℃ 1 min,72℃ 10 min,30 个循环;内参照 β-actin:94℃ 3 min ,94℃ 40 s,56℃ 40 s ,72℃ 1 min,72℃3 min,30个循环。将产物于2%琼脂糖凝胶电泳,恒压120 V,30 min,UVP成像分析系统拍照观察。用Quantity One软件进行灰度分析,计算目的基因条带与内参照β-actin的灰度比值。
2 结果
2.1 流式细胞仪检测AnnexinV-EGFP标记的肝癌细胞凋亡情况 与正常对照组肝癌细胞凋亡率(5.94±0.17)%相比,热疗0.5,1,1.5 h 3个组肝癌细胞凋亡率分别为(11.10±0.33)%,(17.06±0.98)%,(12.43±0.53)%明显增加(P<0.01),提示热疗可诱导肝癌细胞的凋亡。
2.2 热疗对肝癌细胞中Bax mRNA表达的影响 RT-PCR结果显示,正常对照组Bax与其对应的β-actin mRNA条带灰度值的比值为(0.45±0.05);与正常对照组相比,热疗0.5,1,1.5 h 3个组肝癌细胞Bax与其对应的β-actin mRNA条带灰度值的比值分别为(1.05±0.05,1.51±0.04,0.82±0.04),较正常对照组增加(P<0.01)以加热1 h组最明显,并且Bax/Bcl-2增加(P<0.01)。见图1。
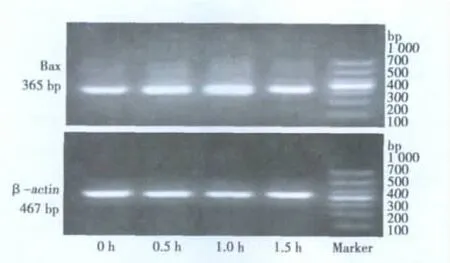
图1 热疗对肝癌细胞中Bax mRNA表达的影响
2.3 热疗对肝癌细胞中Bcl-2 mRNA表达的影响 RT-PCR结果显示,正常对照组Bcl-2与其对应的β-actin mRNA条带灰度值的比值为(2.19±0.04);与正常对照组相比,热疗0.5,1,1.5 h 3个组肝癌细胞Bcl-2与其对应的β-actin mRNA条带灰度值的比值分别为(1.39±0.03,0.92±0.05,1.51±0.03),较正常对照组降低(P<0.01),以加热1 h组最明显。见图2。

图2 热疗对肝癌细胞中Bcl-2 mRNA表达的影响
3 讨论
原发性肝癌系全球发病率和死亡率均较高的恶性肿瘤之一,严重危害人类健康。除部分早期患者可进行手术治疗外,近年来热疗作为一种辅助治疗方法〔4〕,和其他肿瘤治疗方法联合进行逐渐成为肿瘤治疗发展趋势。例如与化疗联合应用可产生互补作用,可增加化疗药物的敏感性,可改善、提高对于抗药性肿瘤的治疗效果〔5〕。热疗可选择性杀伤肿瘤细胞,而对正常细胞没有影响。根据治疗温度的不同,可以将热疗大致分为高温热疗(>43℃)、低温热疗(≤43℃)两类;高温热疗可使靶部位细胞因蛋白质变性而直接死亡,低温热疗则通过诱导细胞凋亡等达到治疗目的〔6,7〕。已有许多实验证实,加热 43℃30 min,可以引起广泛的细胞凋亡〔8〕。
目前认为,肝癌的发生发展除了与细胞的增殖失控和细胞分化异常有关外,另一个重要原因是发生转化的细胞不能正常凋亡。近年来细胞凋亡在热疗中的重要作用引起了广泛关注。研究表明,不同种类细胞株的临界温度不一,差异很大〔9〕。Vorotnikonva等〔10〕报道大肠癌细胞暴露于40℃ 45 min后100%细胞凋亡,温度提高至42℃后,细胞坏死增加,凋亡减少。Rong等〔11〕报道Dunn骨肉瘤细胞在43.5℃持续1 h加温后即可产生凋亡细胞。本研究用43℃分别加温肝癌HepG2细胞0.5,1,1.5 h,结果发现热疗可以使HepG2细胞发生凋亡,且以加温1 h HepG2细胞凋亡最多。
细胞凋亡是多基因调控下按一定程序进行的细胞主动死亡,具有非常重要的意义。Bcl-2家族是目前最受重视的调控细胞凋亡的基因家族,它们可以分为两大类,即凋亡抑制基因(Bcl-2、Bcl-XL、Bcl-W 等)及凋亡诱导基因(Bax、Bcl-xs、Bad、Bid等),两者间的相互作用决定细胞的生存与凋亡。其中研究最多是Bcl-2和Bax基因,其也是调控细胞凋亡的主要分子。Bcl-2基因/蛋白过量表达,细胞存活,Bax基因/蛋白过量表达,则促进细胞凋亡〔12,13〕。本实验表明加热作为一种外来刺激信号,可以通过调节HepG2细胞内相关基因Bax和Bcl-2的基因表达,来诱导细胞凋亡的发生。Bax与Bcl-2可形成异源二聚体,细胞中Bax高表达时形成Bax同源二聚体,加速细胞凋亡;相反,Bcl-2高表达时,形成Bcl-2异源二聚体,抑制细胞凋亡,也就是Bax与Bcl-2相互作用可能还是以两者间的比值来决定细胞的生存与凋亡。
总之,热疗在体外能显著增加肝癌胞株HepG2的凋亡率,其机制可能与上调Bax基因表达、下调Bcl-2基因的表达,增加Bax/Bcl-2的比值有关。这将为临床应用热疗治疗肝癌提供部分理论依据。
1 Zwischenberger JB,Vertrees RA,Bedell EA,et al.Percutaneous venovenous perfusion-induced systemic hyperthermia for lung cancer:a phaseⅠsafely study〔J〕.Ann Thorac Surg,2004;77(6):1916-24.
2 Tranberg KG.Percutaneous ablation of liver tumors〔J〕.Best Pract Res Clin Gastroenterol,2004;18(1):125-45.
3 Ko SH,Ueno T,Yoshimoto Y,et al.Optimizing a novel regional chemotherapeutic agent against melanoma:hyperthermia induced enhancement of temozolomide cytotoxicity〔J〕.Clin Cancer Res,2006;12(1):289-97.
4 Wust P,Hildebrandt B,Sreenivasa G,et al.Hyperthermia in combined treatment of cancer〔J〕.Lancet Oncol,2002;3(8):487-97.
5 Shen J,Zhang W,Wu J,et al.The synergistic reversal effect of multidrug resistance by quercetin and hyperthermia in doxorubicin-resistant human myelogenous leukemia cells〔J〕.Int J Hyperthermia,2008;24(2):151-9.
6 Hildebrandt B,Wust P.The biologic rationale of hyperthermia〔J〕.Cancer Treat Res,2007;134(1):171-84.
7 Peng Yuan-fei,Zheng Min-hua.Cellular and molecular mechanism and application of hyperthermia for tumor therapy〔J〕.World Chin J Digestol,2007;15(12):1319-23.
8 Burd R,Dziedzic TS,Xu Y,et al.Tumor cell apoptosis,lymphocyte recruitment and tumor vascular changes are induced by low temperature,long duration(fever-like)whole body hyperthermia〔J〕.J Cell Physiol,1998;177(1):137-47.
9 Tang R,Zhu ZG,Qu Y,et al.The impact of hyperthermic chemotherapy on human gastric cancer cell lines:preliminary results〔J〕.Oncol Rep,2006;16(3):631-41.
10 Vorotnikova E,Ivkov R,Foreman A,et al.The magnitude and time-dependence of the apoptotic response of normal and malignant cells subjected to ionizing radiation versus hyperthermia〔J〕.Int J Radiat Biol 2006;82(5):549-59.
11 Rong Y,Mack P.Apoptosis induced by hyperthermia in Dunn,osteosarcoma cell line in vitro〔J〕.Int J Hyperthermia,2000;16(1):19-27.
12 Vogelbaum MA,Tong JX,Perugu R,et al.Overexpression of bax in human glioma cell lines〔J〕.J Neurosurg,1999;91(3):483-9.
13 Adams JM,Cory S.Bcl-2-regulated apoptosis:mechanism and therapeutic potential〔J〕.Curr Opin Immunol,2007;19(5):488-96.

