14匹马经典MHC-Ⅰ类分子多态性分析
刘建东,孙留克,林跃智,那 雷,王雪峰,杜 承,周建华*,曲娟娟
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江哈尔滨 150001)
14匹马经典MHC-Ⅰ类分子多态性分析
刘建东1,2,孙留克2,林跃智2,那 雷2,王雪峰2,杜 承2,周建华2*,曲娟娟1*
(1.东北农业大学生命科学学院,黑龙江哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物病研究室,黑龙江哈尔滨 150001)
为分析马经典MHC-I类分子的多态性,本研究从马外周血单个核细胞提取总RNA,并采用RT-PCR方法对14匹马经典MHC-I类分子(包括编码肽结合区的大部分区域、α3区、穿膜区以及胞浆区)进行扩增和序列分析。结果显示,14匹实验马各自具有2个~4个MHC-I等位基因,其在不同马匹之间的表达呈现明显的差异性,主要分布在2个分支。尽管如此,各马匹间均表达具有1个或1个以上相同或高度同源的对应经典MHC-I类分子的mRNA。该研究结果为正在开展的针对马传染性贫血病毒减毒疫苗核心蛋白(p26)以及其他免疫原的CTL表位的筛选提供基础数据。
马;主要组织相容性复合物;多态性;RT-PCR
主要组织相容性复合体I类分子(Major histocompatibility complex,MHC-I)是具有高度多态性的糖蛋白[1]。其编码的分子能够与经抗原呈递细胞加工处理后的抗原肽结合,成为激活相应细胞毒性T淋巴细胞的始动信号之一[2-3]。其功能是决定机体对微生物感染和移植排斥等的特异性免疫应答特性的重要因素之一[4]。经典的MHC-I类分子的多态性不仅表现在预期等位基因的数量,还表现在附加表达不同单倍型的I类基因[5]。基因组发生的高频度碱基替换是形成MHC-I类分子高度多态性的原因,也是机体对疾病正向选择的结果[5]。马的MHC-I基因包括启动子区、信号肽区、α1、α2、α3区、跨膜区、胞浆区及3'非编码区。其中α1和α2区编码MHC分子肽结合区具有较高的多态性[6]。由于不同个体 MHC-I的 α1、α2、α3区呈高度多态性,对同一病原的抗原多肽亲和性不同,而导致免疫应答,特别是T细胞免疫应答的差异[7]。本研究参照文献[6]方法,利用RT-PCR技术对该区的主要序列进行扩增,对马的经典MHC-I类分子的多态性进行了量化分析,为马传染性贫血病毒(Equine infectious anemia virus,EIAV)的CTL表位研究提供重要的实验依据。
1 材料和方法
1.1 实验动物 14匹实验用马均来自黑龙江省通辽,遗传背景不明。
1.2 引物设计 引物设计参照文献[6]报道的马经典MHC-I类分子扩增用特异性引物,上游引物PA:5'-GCAGGAGGGGCCGGAGTATT-3'下游引物:PB:5'-CCGTCTCACACTTTCTG-3'。引物由博仕生物技术有限公司合成,扩增目的片段长度为858 bp。
1.3 目的基因的RT-PCR扩增及测序 采用TRIzol试剂(Axygen)按产品说明提取马全血总RNA。以总RNA反转录合成的cDNA为模板进行PCR扩增。扩增条件为:95℃ 5 min;95℃ 30 s、60℃30 s、72℃1 min,共30个循环;72℃10 min。PCR产物用1%琼脂糖凝胶电泳鉴定,PCR产物经胶回收试剂盒(Omega Bio-Tek公司)回收后克隆至pMD18-T载体中。利用OMEGA小量质粒提取试剂盒提取重组质粒后,由北京六合华大基因科技股份有限公司测序,通过DNAMAN和DNAStar进行序列比对分析。
2 结果与讨论
2.1 RT-PCR扩增马MHC-I类分子 从实验用马分离的PBMC提取的RNA,反转录为cDNA,经特异性引物PA和PB扩增后,进行1%琼脂糖凝胶电泳。结果显示扩增片段约为850 bp,与预期目的片段的长度相符。
2.2 序列测定及分析 对每匹马扩增的基因随机挑选10个~20个克隆进行DNA序列测定。根据特定插入序列的有无,马MHC-I类分子可分为经典和非经典两类。将所获得的序列通过生物学软件进行分析后显示,在所扩增序列中未见非经典的MHC-I类分子[8]。由于MHC-I类分子具有共显性特征,本研究首先删除了相互间核苷酸序列小于1%的克隆,并推测其可能的等位基因数(表1)。随后,根据所选取的78条序列进行了多态性的比较分析。分析结果显示,本研究中所用的14匹马,分别具有2个~4个等位基因。进化树分析数据显示(图1),14匹马匹所获得的序列分属于2个大的分支。鉴于不同的MHC-I类基因对抗原肽提呈能力的差异,以及等位基因的同源情况。我们推测这7匹马可能具有相近的抗原肽提呈能力。本研究结果不但可以为正在开展的针对EIAV减毒疫苗核心蛋白(p26)的CTL表位的筛选提供基础性数据,以确定EIAV弱毒疫苗免疫保护建立过程中有效的CTL表位,也是研究其他马传染性疾病,特别是病毒性传染性疾病T细胞免疫应答的基础之一。
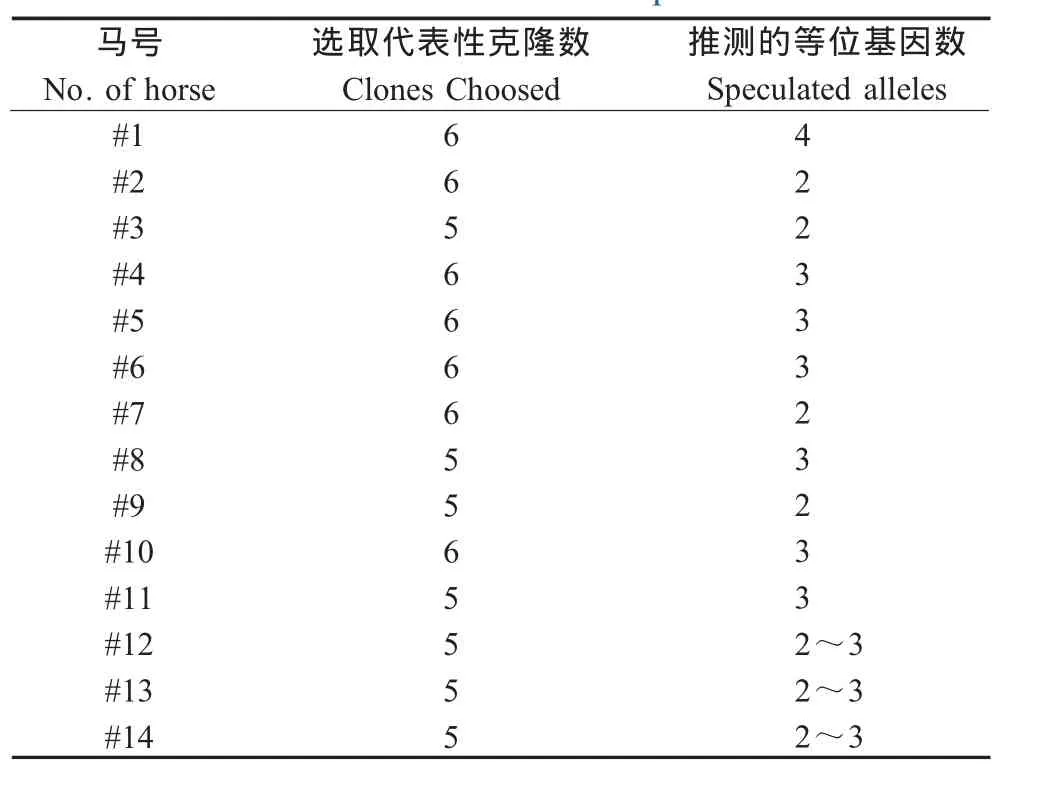
表1 不同实验马匹等位基因表达情况Table 1 Expression of MHC-I alleles in PBMCs isolated from 14 the horses in the experiment

图1 14匹马共78个MHC-I分子克隆的核苷酸序列进化树分析Fig.1 Alignment of nucleotide sequences predicted by all the 78 MHC-1 cDNA clones from 14 horses examined in this study
[1]Bjorkman,P J,Saper M A,Samraoui B,et al.Structure of the human class I histocompatibility antigen,HLA-A2[J].Nature,1987,329(6139):506-512.
[2]Granados D P,Yahyaoui W,Laumont C M,et al.MHC I-associated peptides preferentially derive from transcripts bearing miRNA response elements[J].Blood,2012,119(26):181-191.
[3]Zhang Y,Williams D B.Assembly of MHC class I molecules within the endoplasmic reticulum[J]Immunol Res,2006,35(1-2):151-162.
[4]Huang A Y,Golumbek P,Ahmadzadeh M,et al.Role of bone marrow-derived cells in presenting MHC class I-restricted tumor antigens[J].Science,1994,264(5161):961-965.
[5]Tallmadge R L,Campbell J A,Miller D C,et al.Analysis of MHC class I genes across horse MHC haplotypes[J].Immunogenetics,2010,62(3):159-172.
[6]Chung C,Leib S R,Fraser D G,et al.Novel classical MHC class I alleles identified in horses by sequencing clones of reverse transcription-PCR products[J].Eur J Immunogenet,2003,30(6):387-396.
[7]Cadavid L F,Shufflebotham C,Ruiz F J,et al.Evolutionary instability of the major histocompatibility complex class I loci in New World primates[J].PNAS USA,1997,94(26):14536-14541.
[8]Holmes E C,Ellis S A.Evolutionary history of MHC class I genes in the mammalian order Perissodactyla[J].J Mol Evol,1999,49(3):316-324.
Analysis the polymorphism of classical MHC class I alleles expressed by peripheral blood mononuclear cells from 14 horses in Heilongjiang Province
LIU Jian-dong1,2,SUN Liu-ke2,LIN Yue-zhi2,NA Lei2,WANG Xue-feng2,DU Cheng2,ZHOU Jian-hua2*,QU Juan-juan1*
(1.College of Life Science,Northeast Agricultural University,Harbin 150030,China;2.State Key Laboratory of Veterinary Biotechnology,Harbin Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Harbin 150001,China)
In this study,cDNA sequences encoding majority region of the classical MHC class I from 14 domestic horses were amplified by RT-PCR from total RNA extracted from PBMC.The amplified fragments include coding regions for the peptide binding region(α1, α2 and α3),the transmembrane region and the cytoplasmic domain.Results revealed that there were 2-4 MHC-I alleles in each of these 14 horses,which were consistent with the data published by other studies.In addition,the expressed MHC-I molecules of different horses were noticeable different,showing as two major branches in the phylogenetic tree.However,at least one identical or highly homology MHC-I molecule was identified among these each of these horses.These results provided essential information for the study of CTL epitope in EIAV and other immunogens.
horse;MHC;polymorphism;RT-PCR
S852.4
A
1008-0589(2013)10-0852-03
10.3969/j.issn.1008-0589.2013.10.19
*Correspondingauthor
2013-04-10
国家十二五科技重大专项(2012ZX10001008-004);国家自然科学基金(31070809);国家自然科学青年基金(30901349)
刘建东(1986-),男,山西长治人,硕士研究生,主要从事慢病毒研究.
*通信作者:E-mail:jianhua_uc@126.com
(本文编辑:李 爽)

