重组猪鼻支原体P37蛋白的原核表达及免疫原性分析
熊祺琰,刘占军,马庆红,冯志新,刘茂军,白方方,邵国青
(江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室/国家兽用生物制品工程技术研究中心,江苏南京 210014)
猪鼻支原体(Mycoplasma hyorhinis,Mhr)是一种能够引起猪多发性浆膜炎[1]、关节炎[2]、耳炎[3]、肺炎[4]等病症的致病性支原体。Mhr在临床猪场的感染率较高,主要通过上呼吸道感染进行传播,该病原从呼吸系统向全身发生侵染将导致多发性浆膜炎、关节炎等疾病的发生。Mhr也是细胞培养中引起培养污染的最常见支原体之一。近年来的研究表明Mhr感染与人的多种癌症,包括胃癌[5]、大肠癌[6]、前列腺癌[7-8]等有明显的相关性。
目前Mhr的感染检测主要依赖于PCR方法,尚未有商品化的试剂盒可以用于血清学检测。P37蛋白是Mhr的一种膜蛋白,为Mhr的主要免疫原之一。相关研究表明,P37蛋白在Mhr诱发细胞肿瘤化中起重要作用[9-11]。本研究采用原核系统表达P37重组蛋白,测定其与Mhr阳性血清的反应性,作为建立Mhr ELISA诊断方法的包被抗原候选蛋白;同时检测P37蛋白的免疫原性,为重组疫苗的构建和单克隆抗体(MAb)的制备奠定基础。
1 材料和方法
1.1 菌株、质粒和实验动物 大肠杆菌(E.coli)BL-21(DE3)及表达载体pET-28a(+)均由本研究所保存;16只4周龄~6周龄雄性BALB/c小鼠购自扬州大学比较医学中心。
1.2 主要试剂 硝酸纤维素膜购自美国M illipore公司;镍柱购自南京金斯瑞生物科技有限公司;辣根过氧化物酶标记的羊抗小鼠IgG(HRP-IgG)、羊抗兔HRP-IgG和DAB显色液均购自武汉博士德生物工程有限公司;Mhr抗体阳性兔血清及Mhr抗体阳性小鼠血清为本实验室自制;PCR鉴定引物由南京金斯瑞生物科技有限公司合成,选取P37部分片段为目标PCR片段鉴定P37,设计上游引物序列为5'-TGCTCGAATACGGGTG-3';下游引物序列为5'-AA AAATTGGCTTGAAC-3'。
1.3 Mhr P37基因变异程度分析 检索GenBank收录的Mhr P37基因,同时对本实验室分离并单克隆后保存的12株Mhr菌株的P37基因进行测序。利用DNAStar软件对上述所有P37基因进行比对,分析序列变异程度。
1.4 Mhr P37基因的获得 根据不同菌株间P37的变异程度,选取合适的目的序列进行后续试验。为避免支原体色氨酸密码子需要突变的问题,采用基因合成的方式获得除信号肽外的Mhr P37蛋白全基因序列(1 140 bp),同时利用E.coli偏爱的密码子进行序列优化以帮助表达。两端分别添加NheⅠ和BamHⅠ酶切位点。合成的基因片段经NheⅠ和BamHⅠ双酶切后插入经同样双酶切的pET-28a(+)空质粒载体中,构建得到pET28a-P37重组表达质粒。转化E.coliBL21感受态细胞,PCR筛选阳性克隆,得到的阳性克隆进行一次单克隆,再重复筛选一次,获得阳性菌株,测序鉴定序列的正确性。保存菌种。
1.5 重组Mhr P37蛋白的表达 接种20μL甘油管菌液至5 ML卡那抗性的LB培养基中,过夜培养,次日以2%的量转接于卡那抗性的LB培养基中,振荡培养至OD600nm值为0.4~0.6,加IPTG至终浓度1mmol/L,37℃诱导,于不同时间点收集菌体,进行SDS-PAGE(15%分离胶、5%浓缩胶),测定最佳诱导时间。
1.6 重组Mhr P37蛋白的制备及纯化 以最佳诱导时间诱导表达重组蛋白,收集菌体,超声裂解,离心收集上清液。采用镍柱亲和纯化重组蛋白,透析冻干保存于-20℃。
1.7 重组Mhr P37蛋白的鉴定 利用western blot方法鉴定P37蛋白。重组P37蛋白经SDS-PAGE电泳后,转印至硝酸纤维素膜(NC)上。5%脱脂奶37℃摇动封闭2 h,加入用1%脱脂奶粉和10 mmol/L PBS稀释40倍的Mhr阳性小鼠血清,37℃摇动杂交 1 h。0.05%Tween-20,10 mmol/L PBS洗膜 5次,每次5 min。洗涤后加入用1%脱脂奶粉和10 mmol/L PBS稀释的羊抗小鼠HRP-IgG作为二抗(1∶5 000),37℃作用1 h。同上洗涤后加入显色液,出现明显条带后用蒸馏水冲洗膜以终止反应。
1.8 间接ELISA方法的建立 取纯化的重组Mhr P37蛋白,考马斯亮蓝试剂盒测定蛋白浓度。用包被稀释液0.05mmol/L Na2CO3-Na2HCO3缓冲液(pH9.6)将蛋白稀释至5μg/mL,每孔加100μL,4℃包被过夜,次日用含0.05%Tween-20的PBST溶液洗涤3次,每次5m in;每孔加入200μL 2%BSA于37℃封闭2 h,同上洗涤3次;加入1:100倍稀释的Mhr抗体阳性或阴性兔血清样本,每孔100μL,37℃孵育1 h,洗涤;加入羊抗兔HRP-IgG(1∶8 000),每孔100μL,37℃孵育1 h,洗涤;加入新鲜配制的TMB底物100μL,37℃避光显色10m in;加入50μL 2 mol/L H2SO4终止反应,于450 nm波长测定。
1.9 重组Mhr P37蛋白的免疫原性分析 将小鼠随机分成2组,每组8只。间隔2周免疫一次,共免疫3次。首次免疫采用弗氏完全佐剂乳化,后两次采用弗氏不完全佐剂。G1组肌肉注射免疫乳化的P37蛋白,每只小鼠100μg,G2组免疫乳化的PBS作为阴性对照。不同时间点采血检测血清抗体。分别以Mhr全菌蛋白和重组P37蛋白作为包被抗原,检测P37免疫组血清的反应性。
2 结 果
2.1 Mhr P37基因变异程度分析 GenBank中共检索到4条Mhr P37基因序列(CP003231.1、CP002669.1、CP002170.1、X14140.1),同时对本实验室分离并单克隆后保存的12株Mhr菌株的P37基因进行测序。利用DNAStar软件对上述P37基因进行比对,结果显示核酸变异19处,蛋白变异9处。表明P37蛋白在各个菌株之间变异不大,属于保守性蛋白。基于此结果,本试验利用GenBank中登录号为X14140.1的蛋白翻译序列为目的P37蛋白序列设计重组基因,并进行重组质粒的构建。
2.2 重组质粒的鉴定 选取合成的P37基因的部分片段为目的片段(579 bp)设计引物,PCR鉴定P37基因的插入情况。重组质粒pET28a-P37经PCR扩增得到一条与目的片段大小(579 bp)相符的条带,表明目的基因片段已插入质粒pET-28a(+)中(图1)。经DNA测序结果正确。
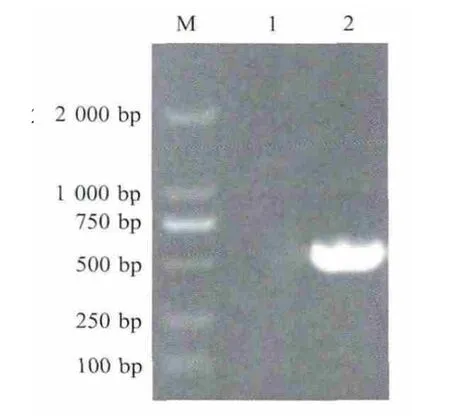
图1 重组质粒pET28a-P37的鉴定Fig.1 Identification of the recombinant plasm id expressing P37
2.3 P37蛋白诱导表达及纯化 用IPTG诱导重组菌,SDS-PAGE结果表明P37蛋白获得表达,大小为44.3 ku,与重组P37的分子量45.97 ku基本相符(图 2)。于诱导后 0 h、2 h、3 h、4 h、5 h、6 h 取样,结果表明加入IPTG诱导4 h后蛋白的表达达到高峰并维持稳定水平,故诱导4 h后即可收集菌体。采用镍柱亲和纯化重组P37蛋白,结果显示纯化效果良好(图2泳道4)。

图2 重组P37蛋白的表达及纯化Fig.2 Expression and purification of the recombinant P37 protein
2.4 重组Mhr P37蛋白的western blot鉴定 利用本实验室制备的Mhr小鼠阳性血清对重组P37蛋白进行鉴定,结果表明诱导后的全菌蛋白能够被Mhr阳性血清识别,产生的交带分子量大小与P37蛋白符合;而阴性对照血清无明显阳性杂交条带(图3)。
2.5 间接ELISA检测 以重组Mhr P37蛋白为包被抗原检测Mhr阳性和阴性兔血清,结果显示重组蛋白可以检测到Mhr抗体(p<0.01),表明该重组P37蛋白具有明显的反应原性(图4)。
2.6 重组Mhr P37蛋白的免疫原性分析 将纯化的重组P37蛋白免疫小鼠,检测其是否能够刺激动物产生抗体。P37免疫后,小鼠产生明显的抗P37抗体,用Mhr全菌蛋白为包被抗原检测也呈现阳性,检测值稍低于P37蛋白包被时的检测值。结果表明该重组P37蛋白具有良好的免疫原性(图5)。
3 讨 论

图3 重组P37蛋白的western blot鉴定Fig.3 Identification of the recombinant P37 protein
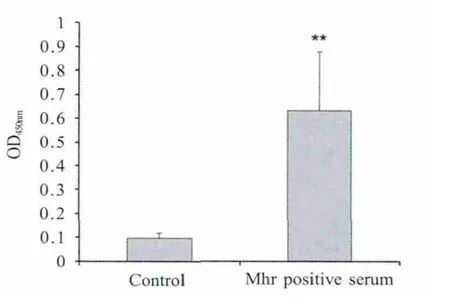
图4 以重组P37蛋白为抗原ELISA检测Mhr抗体Fig.4 Detection of antibody against Mhr by the ELISA assay using the recombinant P37 protein as coating antigen
Mhr是第一种从猪体内分离到的支原体,属于临床猪场常见病原菌之一,感染后可以引起猪的多种炎症性疾病。Mhr对呼吸道纤毛的损伤使得其他病原菌如多杀性巴氏杆菌、猪繁殖呼吸综合征病毒等更容易入侵呼吸道系统形成共感染。
目前,Mhr的检测手段主要包括分离培养、PCR[12]、免疫组化[13]及原位杂交[1]等方法。PCR方法通常使用鼻拭子及支气管肺泡灌洗液作为待检样品,其中鼻拭子样本检出率较低,通常只适用于群体感染性的判断,对于个体发病而言容易出现假阴性,支气管肺泡灌洗液虽然可以通过麻醉动物后利用纤维支气管镜等仪器实现活体采集,但难以应用于临床进行大规模采样。同样,免疫组化方法也需要迫杀动物后才能进行,这不适用于临床检测。与此相比,血清学检测是临床主要的检测手段。刘星等利用Mhr特异性MAb建立了阻断ELISA方法检测血清中Mhr[14],但目前市场上尚无商品化售卖的Mhr血清抗体检测试剂盒。
P37蛋白是Mhr的一种膜蛋白,近年来的研究表明P37蛋白在Mhr诱发肿瘤中起重要作用,其机制可能包括诱导单核细胞表达和释放TNF-α[9]、激活金属基质蛋白酶MMP-2及表皮生长因子受体的磷酸化等[10]。在本研究中,构建了能够在大肠杆菌中优化表达Mhr P37蛋白的重组质粒,可以在原核系统大量表达P37蛋白,经亲和层析得到纯度较高的P37重组蛋白。该蛋白可以与Mhr阳性血清杂交产生阳性条带,以其为包被抗原能够检测Mhr阳性血清,这为进一步建立和优化血清学ELISA检测方法提供可能。另外,免疫试验证明该重组P37蛋白也具有良好的免疫原性,可以产生Mhr反应性的抗体,为Mhr重组疫苗及P37相关重组肿瘤疫苗的研制奠定基础。
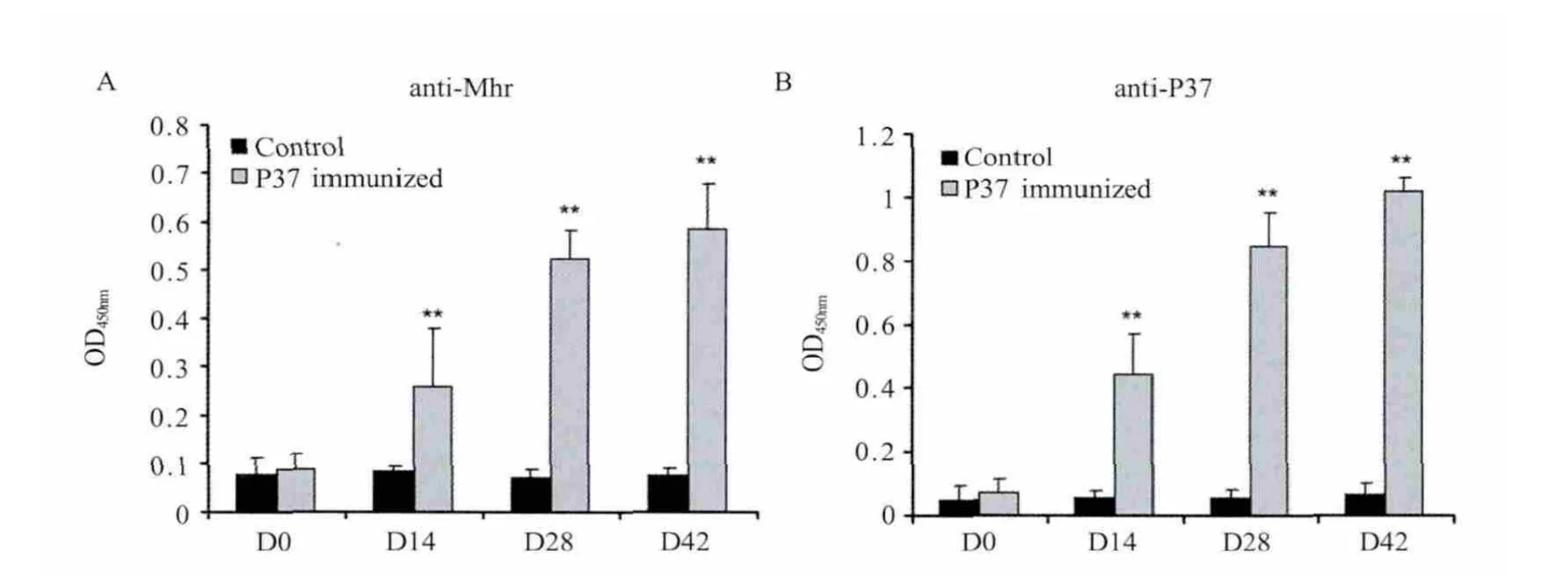
图5 重组P37蛋白的免疫原性分析Fig.5 Immunogenicity analysis of the recombinant P37 protein
[1]Kim B,Lee K,Han K,et al.Development of in situ hybridization for the detection ofMycoplasma hyorhinisinformalinfixed paraffin-embedded tissues from naturally infected pigs with polyserositis[J].JVet Med Sci,2010,72(9):1225-1227.
[2]Jayagopala Reddy N R,W ilkie B N,Borgs P,et al.Cytokines inMycoplasma hyorhinis-induced arthritis in pigs bred selectively for high and low immune responses[J].Infect Immun,2000,68(3):1150-1155.
[3]Friis N F,Kokotovic B,Svensmark B.M ycoplasma hyorhinisisolation from cases of otitis media in piglets[J].Acta Vet Scand,2002,43(3):191-193.
[4]Lin J H,Chen S P,Yeh K S,et al.Mycoplasma hyorhinisin Taiwan:diagnosis and isolation of sw ine pneumonia pathogen[J].Vet Microbiol,2006,115(1-3):111-116.
[5]Yang Hua,Qu Li-ke,Ma Hua-chong,et al.M ycoplasma hyorhinisinfection in gastric carcinoma and its effects on the malignant phenotypes of gastric cancer cells [J].BMC Gastroenterol,2010,10:132-138.
[6]Mariotti E,Gemei M,M irabelli P,et al.The percentage of CD133+cells in human colorectal cancer cell lines is influenced byMycoplasma hyorhinisinfection[J].BMC Cancer,2010,10:120-126.
[7]Urbanek C,Goodison S,Chang M,et al.Detection of antibodies directed atM.hyorhinisp37 in the serum ofmen with new ly diagnosed prostate cancer[J].BMC Cancer,2011,11:233-237.
[8]Nam iki K,Goodison S,Porvasnik S,et al.Persistent exposure toMycoplasmainduces malignant transformation of human prostate cells[J].PLoSOne,2009,4(9):e6872.
[9]宁金鹰,吴健.猪鼻支原体蛋白P37诱导人外周血单核细胞释放肿瘤坏死因子[J].科学通报,2003,48(4):353-357.
[10]Gong Man-man,Meng Lin,Jiang Bei-hai,et al.p37 fromMycoplasma hyorhinispromotes cancer cell invasiveness and metastasis through activation of MMP-2 and followed by phosphorylation of EGFR[J].Mol Cancer Ther,2008,7(3):530-537.
[11]龚曼曼,孟麟,寿成超.P37腺病毒表达载体的构建及对乳癌细胞的促迁移作用[J].生物化学与生物物理进展,2007,34(11):1147-1151.
[12]Caron J,Ouardani M,Dea S.Diagnosis and differentiation ofMycoplasmahyopneumoniaeandMycoplasmahyorhinisinfections in pigs by PCR amplification of the p36 and p46 genes[J].JClin Microbiol,2000,38(4):1390-1396.
[13]Morita T,Muraki Y,Awakura T,et al.Detection ofMycoplasma hyorhinisin porcine eustachitis[J].JVet Med Sci,1993,55(3):475-477.
[14]刘星,张丽芳,杨玉萍,等.抗猪鼻支原体单克隆抗体的研制及双抗体夹心ELISA检测法的建立[J].中国比较医学杂志,2008,18(3): 55-58.

