表达鸡毒支原体TM 1蛋白基因重组新城疫病毒的构建及其免疫原性研究
冯秋霖,刘茂军,祁 芳,陈 曦,邵国青,葛金英*,步志高*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江哈尔滨 150001;2.江苏省农业科学院兽医研究所,江苏南京 210095)
鸡毒支原体(Mycoplasma gallisepticum,MG)主要引起鸡慢性呼吸道疾病,降低机体免疫力,导致其它病原的继发感染,属于危害养鸡业的重要疾病之一[1]。
MG是一种缺乏细胞壁的革兰氏阴性菌。呈高度多形性,以二分裂法或芽生方式增殖。在MG基因组DNA中TM 1基因编码一个分子量为29 ku的外膜保护性抗原蛋白,在鸡体内能诱导产生保护性抗体[2]。将该纯化的蛋白接种鸡后,通过攻毒实验证明可保护80%的免疫鸡免受MG感染。
新城疫病毒(NDV)弱毒疫苗通过鸡胚尿囊腔接种的方式生产,操作简单,易于大规模产业化生产,并且生产成本低。病毒活载体疫苗不需佐剂即可诱导机体产生比较广泛的免疫应答,包括体液免疫和较强的细胞免疫,甚至粘膜免疫,是目前及未来禽病疫苗研制与开发的主要方向之一[3]。
因此,本研究以NDV LaSota弱毒疫苗株为载体,构建表达TM 1基因的重组NDV,并在SPF雏鸡中进行免疫原性研究,探索其作为安全、有效和低成本的新型NDV和MG二联活疫苗的可行性。
1 材料和方法
1.1 主要实验材料 表达T7聚合酶重组痘病毒vTF7-3由NIH的Moss博士惠赠;MG H株由江苏省农业科学院兽医研究所提供;重组NDV弱毒疫苗株rLaSota、NDV感染克隆pBRN-FL-PmeⅠ以及辅助核蛋白(pBS-NP)、磷蛋白(pBS-P)和大聚合酶蛋白(pBS-L)重组质粒均由本实验室构建[4-5];鸡抗NDV、鸡抗MG和鼠抗MG高免血清均由本研究室制备;SPF鸡胚和SPF雏鸡由本研究所SPF实验动物中心提供。
1.2 主要试剂 T4 DNA连接酶及限制性内切酶均购自NEB公司;Prime Star HSDNA Polymerase购自TaKaRa公司;兔抗鸡IgG-FITC、山羊抗鼠IgG及羊抗鼠IgG-TIRTC购自Sigma公司;RNA提取试剂TRIzol、鼠源反转录酶(M-MLV)试剂盒以及磷酸钙转染试剂盒购自Invitrogen公司;DNA胶回收试剂盒,质粒DNA提取试剂盒购自QIAGEN公司;鸡毒支原体ELISA检测试剂盒购自上海丽臣生物科技有限公司。
1.3 MG TM1基因的合成和序列分析 根据GenBank中登录的MG-TM 1基因的ORF序列(NC_004829.1)由上海捷瑞生物工程有限公司合成。
1.4 表达TM 1基因的重组感染性克隆的构建 将合成的TM 1基因经PmeⅠ酶切处理后,回收TM 1片段,连接于同样经PmeⅠ酶切去磷酸化的NDV感染性克隆pBRN-FL-PmeⅠ中[5],构建表达MG-TM 1基因的重组感染性克隆,pBRN-FL-TM 1(图1)。

图1 表达MG TM 1基因的重组型NDV基因组全长cDNA的构建Fig.1 Construction of genomic cDNA of recombinant NDV expressing MG TM 1
1.5 重组病毒的拯救 将MOI约为0.01表达T7聚合酶的重组痘病毒vTF7-3接种于90%的BHK-21细胞单层1 h后,利用磷酸钙转染试剂盒,将pBRN-FL-H及辅助质粒pBS-NP、pBS-P和pBS-L分别以每孔 5μg、2.5μg、1.25μg、1.25μg共转染BHK-21细胞,具体拯救方法见参考文献[5]。收获血凝(HA)及血凝抑制(HI)检测均为阳性的尿囊液,并按常规方法接种于9~11日龄鸡胚,滴定每毫升病毒液的EID50。将拯救的重组病毒命名为rLa-TM 1。
1.6 重组病毒的RT-PCR鉴定 采用TRIzol法提取rLa-TM 1接种鸡胚尿囊液中的总RNA。以MGTM 1-F(5'-GCGAATTCATGAATAAGAAAAGAATCA TCTTAAAGAC-3')和pBRN-8306-R(5'-GACTGCATT CACTGATGAG-3')为引物,进行RT-PCR扩增[6],对扩增的PCR产物进行测序分析。
1.7 TM1蛋白表达的激光共聚焦检测 分别将rLa-TM 1和rLaSota按MOI约为1.0感染BHK-21细胞,培养24 h后以3%多聚甲醛室温固定20 Min。以鼠抗MG高免血清(1∶50)和鸡抗NDV高免血清(1∶50)为一抗,山羊抗鼠 IgG-TIRTC(1∶200)和兔抗鸡IgG-FITC(1∶200)为二抗,对细胞进行DAPI细胞核染色处理。利用激光共聚焦显微镜进行检测。
1.8 重组病毒的致病性试验 按文献[7]的常规方法对重组病毒rLa-TM 1 F3代进行平均鸡胚致死时间(MDT)、脑内致死指数(ICPI)及静脉内致病指数(IVPI)等致病性指标测定。
1.9 重组病毒对鸡的免疫试验及抗体的测定 30只1周龄的SPF雏鸡,随机分为3组,将rLa-TM 1、rLaSota病毒液以106EID50的剂量分别以滴鼻点眼途径接种2组SPF雏鸡,第3组设为对照组。7 d后对雏鸡进行翅下静脉采血,并进行对NDV和MG特异的ELISA抗体检测试验。
免疫3周后,气管内注射MG菌(0.5×109cfu/0.5m L)进行攻毒。观察雏鸡呼吸道症状,记录雏鸡发病死亡情况。攻毒两周后,剖检观察免疫组和对照组鸡的气囊、气管、肺脏的病变情况。
2 结果
2.1 表达TM1基因的重组感染性克隆的构建和重组病毒的拯救 在NDV LaSota疫苗株反向遗传操作系统的基础上,利用PCR在MG-TM 1基因两端引入转录调控终止子(GE)、启动子(GS)序列和PmeⅠ酶切位点后,插入同样经PmeⅠ酶切处理的NDV感染性克隆pBRN-FL-PmeⅠ,构建获得表达TM 1基因的重组NDV cDNA克隆pBRN-FL-TM 1。
以pBRN-FL-TM 1与表达NDV NP、P、L蛋白的辅助质粒共转染BHK-21细胞。收获细胞培养上清接种9~11日龄SPF鸡胚,继续培养5 d后,收获尿囊液进行HA和HI试验,结果显示均为阳性。
2.2 重组病毒的RT-PCR鉴定 提取具有血凝活性的病毒液RNA,利用RT-PCR方法扩增出1 960 bp的片段(图1),进一步的序列分析结果显示,重组病毒基因组的预期位点正确插入了MG-TM 1基因及所引入的转录调控序列。
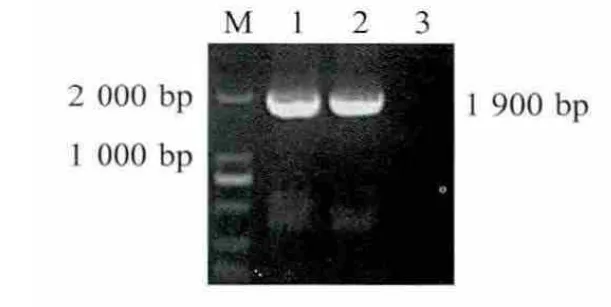
图1 RT-PCR扩增重组病毒的MG-TM 1基因Fig.1 RT-PCR identification of recombinant virus of rLa-TM 1
2.3 TM 1蛋白表达的共聚焦检测 将rLa-TM 1、亲本株rLaSota分别感染BHK-21细胞,培养24 h后固定细胞,以鸡抗NDV高免血清和鼠抗MG高免血清为一抗,兔抗鸡IgG-FITC和山羊抗鼠IgGTIRTC为二抗,DAPI细胞核染色处理制备共聚焦样品。通过激光共聚焦观察到rLaSota感染的细胞内只有NDV蛋白表达;在rLa-TM 1感染的BHK-21细胞中存在NDV和MG两类蛋白,并且TM 1所表达的蛋白位于其细胞膜上(图2)。
图2 激光共聚焦观察MG-TM 1蛋白在重组病毒感染细胞内的表达Fig.2 Immunofluorescence analysis of rLa-TM 1 protein expression
2.4 重组病毒的致病性分析 重组病毒株rLa-TM 1 F3代的 EID50为 108.83/0.1 ML;MDT为 132 h,ICPI和IVPI均为0,属于温和或缓发型病毒株。该结果表明重组弱毒株保持了LaSota亲本疫苗株对鸡胚的高滴度生长适应和低致病的特性。
2.5 重组病毒免疫鸡血清中MG抗体的检测 将rLaSota和rLa-TM 1分别接种一周龄SPF雏鸡。通过间接ElISA方法对所采集血样的抗体滴度进行检测。结果显示,rLaSota免疫组和空白对照组免疫后其体内均未检测到抗MG的抗体。而免疫rLa-TM 1组雏鸡在免疫后一周即可检测到显著的抗MG抗体,并逐渐升高,在3~4周达到一个平台期。免疫3周后进行攻毒,对照组的抗体略有升高。
2.6 重组病毒对SPF鸡的免疫攻毒保护试验 免疫3周后,对3组SPF鸡气管内进行MG攻毒,从第9 d开始非免疫对照组和rLaSota免疫组开始先后表现为精神不振,减食,流鼻涕,伸颈呼吸。而rLa-TM 1免疫组则未出现明显的临床症状。
攻毒2周后,对试验组和对照组进行剖检。免疫rLaSota组和对照组气囊明显增厚、浑浊,有黄色粘稠物,部分鸡喉头气管有淤血。rLa-TM 1免疫组气囊透、喉头及气管均无病变,保护率为90%(表 1)。

表1 攻毒后的发病率统计结果Table 1 The protection of chicks immunized w ith rLa-TM 1 against challenging w ith MG
3 讨 论
本研究利用反向遗传操作平台,将TM 1基因整合到LaSota弱毒疫苗株的基因中,构建重组病毒rLa-TM 1。将重组病毒感染BHK-21细胞,共聚焦法免疫荧光检测结果表明,大量TM 1编码的蛋白表达在细胞膜上。通过ELISA方法对免疫组和对照组血清进行检测,结果表明免疫组可产生较高水平的抗体。经MG强毒株进行攻毒保护试验,rLa-MG免疫组保护率可达到90%以上,而对照组则100%发病。实验结果证明NDV作为弱毒疫苗载体可以使表达的外源蛋白接近于天然状态,诱导更好的免疫保护反应。
郝永清等构建了TM 1基因真核表达质粒,通过肌肉注射途径免疫SPF雏鸡,然后经ELISA和流式细胞术对免疫鸡进行体液免疫和细胞免疫评估,结果表明所构建的真核表达重组质粒既可诱导机体产生体液免疫,也可以产生细胞免疫。攻毒试验证明,其免疫保护率达到79.5%[8]。由于生物安全性等方面的原因,目前基因疫苗在生产中还未能推广应用。在本研究中,构建的重组NDV接种鸡胚所收集尿囊液中的病毒滴度可高达每毫升109.5EID50以上。重组疫苗的MDT≥130 h,ICPI和IVPI均为0,保持了LaSota弱毒疫苗亲本毒株对鸡胚良好的高滴度生长适应性和低致病性,具有很高的安全性。
由于MG培养条件苛刻,所以制造灭活苗和弱毒苗的成本较高。有时由于培养条件不良还可使MG某些免疫保护性抗原不能充分表达,造成灭活苗免疫不确实。另外,近年来研究表明MG的免疫机制以细胞免疫为主,而灭活苗诱导的免疫以体液免疫为主,所以灭活苗免疫往往无法达到预期效果。弱毒苗虽然既可诱导体液免疫也可诱导细胞免疫,但现行的弱毒苗的效力不够稳定,有时不能产生良好的免疫。本研究通过滴鼻点眼途径免疫鸡,证明NDV活载体疫苗能引起机体产生体液免疫、细胞免疫和粘膜免疫应答。此外,NDV活载体疫苗可通过饮水、喷雾、滴鼻、点眼或注射等多种方式给苗,使用极为方便;NDV具有高滴度的鸡胚生长特性,生产成本极为低。该项研究为MG重组活病毒疫苗的进一步研究奠定了基础,有望成为防制NDV和MG感染更廉价、安全的新型重组基因工程活载体疫苗。
[1]牟建清,艾武,张秀美.鸡毒支原体感染的诊断与防治研究进展[J].山东农业科学,2000,4:54-55.
[2]Saito S,Fujisawa A,Ohkawa S,et al.Cloning and DNA sequence of a 29 kilodalton polypeptide gene of Mycoplasma gallisepticumas a possible protective antigen[J].Vaccine,1993,11(10):1061-1066.
[3]温志远,葛金英,王永,等.水泡性口炎病毒印第安纳株反基因操作系统的建[J].中国预防兽医学报,2006,5:489-492.
[4]Ge Jin-ying,Bu Zhi-gao,Chen Hua-lan,et al.New castle disease virus-based live attenuated vaccine completely protects chickens and mice from lethal challenge of homologous and heterologous H5N1 avian influenza viruses[J].JVirol,2007,81:150-158.
[5]葛金英,温志远,步志高,等.表达绿色荧光蛋白重组新城疫病毒LaSota疫苗株的构建[J].微生物学报,2006,46(4):547-551.
[6]王永,葛金英,步志高,等.置换HN基因对新城疫病毒LaSota株致病力的影响[J].微生物学报,2008,48(5):638-664.
[7]Office International des Epizooties.OIE manual of diagnostic tests and vaccines for terrestrial animals[M].Office International des Epizooties,Paris,France,2004.
[8]郝永清,王秀青,周艳君,等.鸡毒霉形体TM-1基因原核表达载体的构建及表达[J].中国兽医科学 2004,(04):18-20.

