一株鸭源H5N2禽流感病毒全基因组序列分析及对鸡的致病性研究
朱占松,张 曦,崔鹏飞,谭 丹,关立峥,李文辉,邓国华*,陈化兰
(1.东北农业大学,黑龙江哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点实验室,黑龙江哈尔滨 150001)
A型禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科流感病毒属的成员,根据其致病性可以分为高致病性(HPAIV)和低致病性(LPAIV)[1]。在过去的30年里,HPAIV H5N2在美国、墨西哥、意大利都曾大范围流行过,而我国香港在1997年、2003年也曾发生过HPAIV H5N2亚型引起人类感染、死亡的事件[2-3]。特别是在2012年南非和台湾H5N2 LPAIV再次爆发,而野鸟、水禽被认为是AIV天然的储存库,并且该病毒可以直接或间接传播给其他宿主。目前国内也有报道称从野鸟体内分离到多株H5N2 AIV,同时基因的突变引起糖基化位点的改变,增加了LPAIV突变为HPLAIV可能性[4-5]。因此,对H5N2 LPAIV的公共卫生学意义予以重视。本研究将从重庆市家禽市场分离的一株鸭源H5N2亚型AIV的基因特性、遗传演化以及致病性、传播和复制能力进行了相关研究。
1 材料和方法
1.1 病毒株和实验动物 H5N2病毒分离株来自2012年重庆市活禽市场的正常家禽监测样品,由国家禽流感参考实验室分离鉴定,命名为:A/Duck/CQ/S2036/2012(H5N2)(CQ/036/12);SPF鸡胚及 4周龄SPF鸡购自哈尔滨兽医研究所实验动物中心。
1.2 主要试剂 rTaqDNA聚合酶、DNA Marker DL2000购自TaKaRa公司;LS TRIzol RNA提取试剂、RNaseOUT、反转录酶(MLV)试剂盒均购自Invitrogen公司;胶回收试剂盒购自OMEGA公司;DNA测序试剂盒购自Applied Biosystems公司。
1.3 病毒的增殖及鸡胚半数感染量(EID50)测定 将AIV分离株经有限稀释后用11日龄SPF鸡胚纯化3代,进行病毒扩增;增殖后的H5N2亚型AIV按10倍倍比稀释,各稀释度经尿囊腔接种4枚11日龄SPF鸡胚,37℃培养,48 h后收集尿囊液测其血凝价,根据Reed-Muench法计算EID50。
1.4 全基因组分析
1.4.1 RNA提取与PCR扩增采用LS TRIzol试剂提取RNA,应用MLV试剂进行反转录。根据Gen-Bank中H5N2亚型AIV各基因片段序列选择保守性最高的区域设计PCR引物进行目的片段的扩增,利用胶回收试剂盒回收PCR产物。
1.4.2 序列测定与分析PCR产物通过ABI测序仪进行测序;利用DNA Star软件中Seqman程序拼接序列,MegAlign进行同源性比较;应用Meg5进行进化树的绘制及分析。
1.5 对SPF鸡致病性试验 按每只100μL含有106EID50病毒经鼻腔感染13只4周龄SPF鸡,另外两只接种等量的PBS作为对照,在负压隔离器中饲养,72 h后迫杀3只鸡,并采集脑、气管、胸腺、肝、脾、肾、肺等脏器组织进行病毒分离滴定。在感染后连续7 d采集泄殖腔和喉头拭子,并接种鸡胚通过测定尿囊液的血凝活性进行病毒滴度测定。在感染14 d后采集血清,检测感染后转阳情况。
1.6 对BALB/c小鼠致病性试验 将病毒稀释至终浓度为106EID50/50μL,用干冰轻微麻醉后经鼻腔感染50μL,感染组8只,对照组5只;72 h后迫杀3只采集脑、脾、肾、肺、鼻甲5种脏器,脏器匀浆后接种11日龄鸡胚进行组织病毒含量的滴定,根据Reed-Muench法计算其EID50,用于测定病毒在小鼠体内的复制情况。其余组连续观察14 d。
2 结 果
2.1 序列进化分析 对CQ/036/12病毒株全基因组序列的进化分析显示,HA基因全长1 695 nt,共编码565个氨基酸。HA蛋白裂解位点氨基酸序列为341R-----TRGLF350共缺失5个氨基酸,具有低致病AIV的特征。HA蛋白在26位、27位、39位、181位、302位、500位、559位存在7个潜在糖基化位点,不存在156、170和289位糖基化位点、CQ/036/12株HA基因属于欧亚分支,与病毒A/baikal teal/Xianghai/426/2011(H5N2)核苷酸序列同源性最高为97.3%(图1)。
CQ/036/12病毒分离株NA基因属于欧亚分支全长1 410 nt,共编码469个氨基酸,而且无颈部缺失。与病毒A/garganey/Altai/1213/2007(H5N2)核苷酸序列同源性最高为97.7%。68位、199位存在潜在糖基化位点。
内部基因序列及进化分析显示,病毒分离株CQ/036/12的内部基因均属于欧亚系、其中M基因与A/duck/Korea/DY104/2007(H4N6)的同源性为99.3%,NP基因与A/pintail/Korea/1173/2009(H7N7)的同源性为98.5%,表明与其它亚型病毒发生互相重组(表1)。内部基因PB2和PA均与A/garganey/Altai/1213/2007(H5N2)的同源性最高。表明该病毒的内部基因来源复杂,可能与韩国、阿尔山的毒株有着共同的祖先(图 1)。
2.2 病毒对SPF鸡的感染性试验 病毒分离株CQ/036/12感染SPF鸡后,均无明显临床症状,但从喉拭子和泄殖腔拭子中均能检测到病毒,喉拭子排毒期持续至第7 d,泄殖腔排毒持续至第5 d,但并不能引起同居鸡感染(表2)。CQ/036/12株感染14 d后血清检测结果显示抗体阳转比例为6/9,同居对照组鸡血清均呈阴性反应。同居鸡的拭子滴定结果和血清检测结果一致,表明该病毒不能在鸡群之间发生有效传播。对脏器进行病毒滴定,试验结果表明仅在肺脏和气管中检测到病毒,并不能引起鸡的全身性感染和在其他脏器内有效复制的能力(表3)。
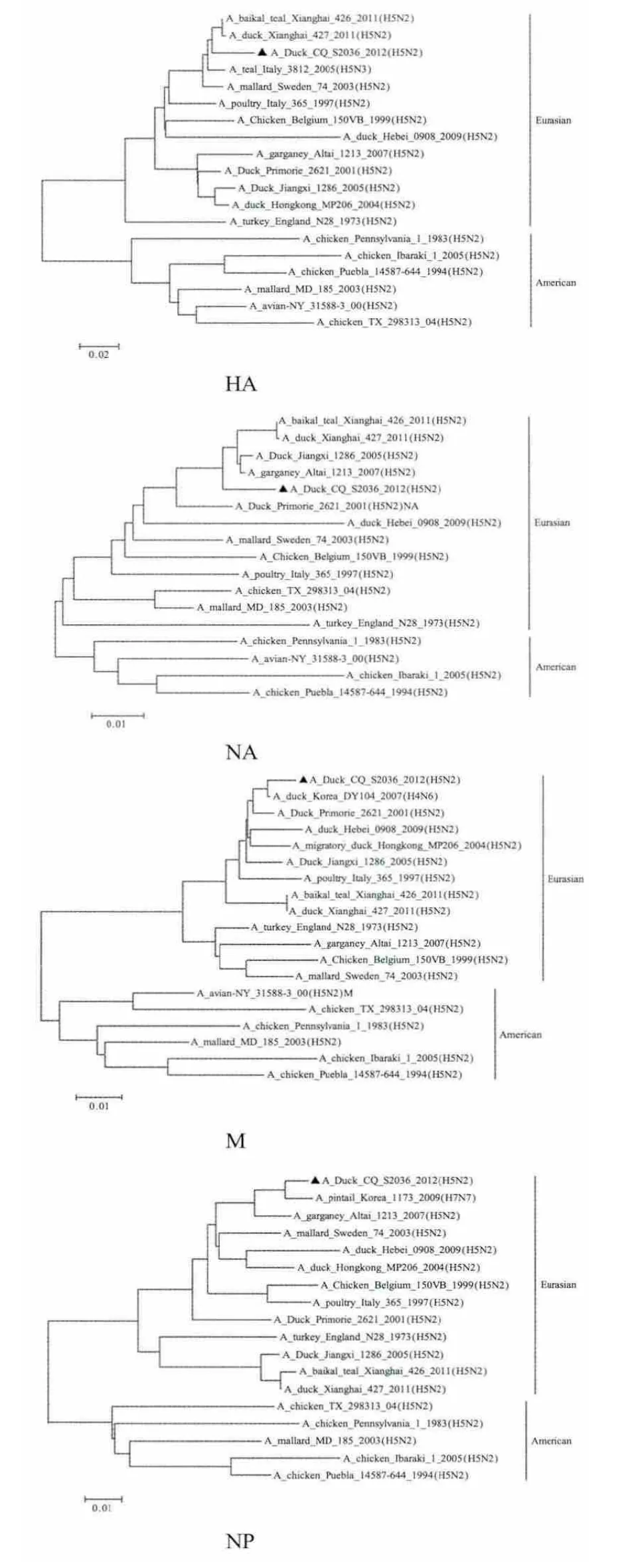
图1 CQ/036/12株的基因进化树Fig.1 Phyogenetic tree based on CQ/036/12
2.3 病毒对BALB/c小鼠的感染性试验 小鼠接种病毒后,并无明显临床症状,试验组小鼠体质量呈现一过性下降,与对照组相比体重增长缓慢(图2),迫杀的3只小鼠脏器病毒滴定结果显示,表明病毒仅能在呼吸道内复制,其他脏器未检测到病毒(表4)。

表1 毒株CQ/036/12的各基因片段BLAST分析结果Table 1 The Blast analysis of genes of genes of CQ/036/12 influenze virus isolates

表2 感染后病毒的滴度检测结果Table 2 Virus titration post infection

表3 病毒感染后第3d SPF鸡脏器病毒滴度检测Table 3 Virus titration of H5N2 viruses in chickens organs on day 3 post inoculation

表4 感染后第3d小鼠脏器病毒滴度检测Table 4 Virus titration of H5N2 viruse in mice organs on day 3 post inoculation

图2 攻毒后两周内小鼠体质量变化Fig.2 Weight change ofmice inoculated with CQ/036/12
3 讨 论
2012年国家禽流感参考实验室在春季监测工作中,从重庆市活禽交易市场中正常家鸭体内分离出一株鸭源H5N2亚型禽流感病毒(DK/CQ/036/12)。分别对SPF鸡和BALB/c小鼠的感染性试验数据显示为LPAIV,这一点与该病毒株的HA基因裂解位点具有典型的LPAIV基因特征相一致。核苷酸同源率分析表明CQ/036/12病毒株的基因均属于欧亚分支,其全部的基因片段均来自我国周边国家和地区,同源性均在97%以上,特别是与NP、M两个基因同源性最高的分别来自于H7、H4,是一株典型的由不同亚型的病毒株重组而成[5-6]。在SPF鸡感染试验中,均未出现任何临床症状,但从病毒的分离复制结果显示,感染鸡的喉头、泄殖腔拭子病毒滴定均为阳性,同时在鸡和小鼠的气管、肺脏中也出现了病毒的复制,这表明病毒可以在鸡体内进行有效的复制,对不同组织有一定的特异嗜性。虽然AIV的致病和组织嗜性的确切机制目前还不清楚,但很可能由多因素共同作用的结果,不同器官的唾液酸类型和神经氨酸酶的pH稳定性可能在决定不同病毒组织嗜性上起决定作用[7-10]。通过动物试验也发现低致病的H5N2亚型AIV虽然不能够引起家禽的死亡,但却能够在家禽体内有效的复制和传播。而研究已经表明致病性H5N2亚型AIV在家禽中流行适应后能够突变为HPALV从而造成禽流感暴发[11-13]。因此,加强对家禽禽流感的监测与防控对防制我国禽流感疫情具有重要意义。
[1]Jiao Pei-rong,Wei Liang-meng,Liao Ming,et al.Complete genome sequence of an H5N2 avian influenza virus isolated from a parrot in Southern China[J].J Virol,2012,86(16):8890-8892.
[2]Kyoko S,Stefan H,Masato H,et al.PB2 am ino acid at position 627 affects replicative efficiency,but not cell tropism,of Hong Kong H5N1 influzenza A viruses in mice[J].Virology,2004,320:258-266.
[3]Zhao Su-hong,Jin Mei-lin.Genetic characterization of a novel recombinant H5N2 avian influenza virus isolated from chickens in Tibet[J].JVirol,2012,86(24):13836-13839.
[4]Lee JH,Pascua P N Q,Choi Y K,et al.Isolation and genetic characterization of H5N2 influenza viruses from pigs in Korea[J].JVirol,2012,86(24):13836-13839.
[5]Jung K,Song D S.Evidence of the cocirculation of influenza H1N1,H1N2 and H3N2 viruses in the pig population of Korea[J].Vet Rec,2007,161:104-105.
[6]Kawaoka S,Webster R G.Is virulence of H5N2 influenza viruses in chickens associated with loss of carbohydrate from the haemagglutinin[J].Virology,1984,139:303-316.
[7]Hatta M,Gao Peng,Halfmann P,et al.Molecular basis for high virulence of Hong Kong H5N1 influenza A viruses[J].Science,2001,293:1840-1842.
[8]Song D S,Lee J Y,Park B K,et al.Isolation of H3N2 sw ine influenza virus in South Korea[J].Vet Diagn Investig,2007,15:30-34.
[9]单芬.一株H5N2亚型鹦鹉源禽流感病毒分子进化分析[J].病毒学报,2010,3:183-188.
[10]张文亮,张曦,朱占松,等.两株H4N3禽流感病毒全基因组序列分析及对小鼠的致病性研究[J].中国预防兽医学报,2012,34(4):266-269.
[11]Lee C W,Senne D A,Suarez D L,et al.Effect of vaccine use in the evolution of Mexican lineage H5N2 avian influenza virus.[J].JVirol,2007,78:8372-8381.
[12]罗维玉,胡永浩,邓国华,等.两株鹅源H6N2亚型禽流感广东分离株的全序列分析及致病性研究[J].中国预防兽医学报,2012,34(5):345-349.
[13]Lee JH.Isolation and genetic characterization of H5N2 influenza viruses from pigs in Korea[J].JVirol,2009,83:4205-4215.

