人脐带间充质干细胞源性心肌细胞的纯化及生物学特性鉴定
汪 涛 林晓波 吴 毅 陈晓东 马桂霞 贺谷雨 蔡志伟 刘必刚 秦 山马 廉,
目前心肌梗死、心力衰竭等心血管疾病的干细胞治疗已逐渐开展,并取得了一定的效果。心肌病是儿童期严重的疾病,预后较差,存活者常伴有持久的心肌损害和心功能不全,目前尚无确切有效的治疗方法,干细胞移植可能成为儿童心肌病治疗的一个新希望。但用于心脏疾病移植的成体干细胞是非心脏源性的,其向心肌细胞、内皮细胞分化的数量很少,不能满足心肌重建的需要。寻找一种多潜能的心血管干/祖细胞,提高其分化率是突破目前干细胞移植治疗心血管疾病“瓶颈”的重要环节。人脐带间充质干细胞( MSCs) 具有多向分化潜能,且干细胞含量多,取材方便,因而有必要探讨人脐带MSCs 来源的心肌细胞的纯化及功能,为心脏细胞移植寻找一种新的干细胞来源。
1 方法
1.1 伦理和知情同意 本研究新生儿脐带的取材得到新生儿家属的同意。
1.2 材料 新生儿脐带取自汕头大学医学院第二附属医院出生的正常新生儿。DMEM 培养基( GIBCO 公司) ,胎牛血清( FBS,GIBCO 公司) ,抗体肌钙蛋白Ⅰ( troponin Ⅰ) 、结蛋白( desmin) 及人心肌球蛋白轻链( MLC-2v) ( 上海酶联生物科技有限公司) ,pMLC2v-EGFP 质粒( GeneCopoeia 公司合成,含嘌呤霉素抗性基因) ,5-氮杂胞苷( 5-aza,Sigma公司) ,ABC 试剂盒( Thermo Scientific) ;山羊抗兔IgG 异硫氰酸荧光素抗体( Bethyl,USA) ,Trizol( Invtrogen 公司) ,引物由深圳华大基因公司合成,RT-PCR 试剂盒( TaKaRa 公司) ,转染试剂盒( Roche) 。
1.3 MSCs 的培养和鉴定 方法参见文献[1],主要步骤简述如下。
1.3.1 细胞培养 取新生儿脐带一条,去表皮、脐动脉及脐静脉,取华尔通氏胶( Wharton's jelly) ,剪切为1 ~2 mm3的组织块,接种于25 cm2培养瓶中培养,细胞培养液为DMEM 培养基。新生细胞呈贴壁生长,待细胞生长至融合80% ~90%时传代。用0.125%的胰蛋白酶37℃消化3 ~5 min 后终止消化,收集细胞,将细胞接种至25 cm2培养瓶,继续用含10%FBS 的DMEM 细胞培养液培养。
同批细胞分成实验组和对照组,实验组细胞进行质粒转染、筛选和5-aza 诱导;对照组细胞不进行质粒转染、筛选和5-aza 诱导,仅用培养基培养。
1.3.2 质粒pMLC2v-EGFP 转染MSCs 及进行筛选 将人脐带MSCs 传代至6 孔板,待细胞生长融合至密度占培养板面积的70% ~80%进行转染,转染前1 d 细胞换新的DMEM 培养基。转染步骤:取2 mL EP 管,加入200 μL 无血清DMEM,再加入2 mg pMLC2v-EGFP 质粒,轻轻混匀,再加入6 mL X-treme GENE HP DNA Transfection Reagent,轻轻混匀,静置15 ~20 min;将上述转染液加至准备好的一孔细胞中,放入37℃细胞培养箱中培养24 ~48 h 后,1∶3传代,加入1 μg·mL-1嘌呤霉素筛选液筛选2 周。转染后48 h 荧光显微镜下观察细胞是否有绿色荧光蛋白表达。
1.3.3 体外诱导 将转染及筛选后人脐带MSCs 在生长融合达60% ~70%时,更换培养液,加入10 μmol·L-15-aza( 不含FBS)[2]诱导剂,24 h 后吸去5-aza 诱导液,换为含10%FBS 的DMEM 培养基继续培养至28 d。诱导期间用倒置相差显微镜观察细胞形态变化。
1.3.4 诱导后心肌细胞的免疫荧光染色 将诱导后心肌细胞爬片,PBS 清洗,4%多聚甲醇固定20 min,PBS 清洗3 min× 3 次,加入0.1%Triton-X 透化15 min,PBS 清洗3 min× 3 次,加1%BSA 封闭液30 min ,滴加1 抗( troponin I、desmin 及MLC2v) 稀释度均为1∶200,4°C 过夜,PBS 清洗2 min× 3 次,滴加山羊抗兔IgG 异硫氰酸荧光素抗体( 稀释度为1∶200)1 h,避光操作;PBS 洗涤后用0.1 μg·mL-1PI 复染。PBS 洗涤后,封片后荧光显微镜下观察,结果拍照留底。
1.3.5 RT-PCR 检测诱导后心肌细胞标记物Desmin 和Nkx2.5 表达 提取对照组和实验组细胞总RNA,逆转录得到cDNA。正反引物及扩增产物的长度如下: β-actin 引物F:5'-CACACTGTGCCCATCTACGA-3',R:5'-TACAGGTCTTTGCGGATGTC-3'(400 bp) 。Desmin 引物F:5'-ACCGCTTCGCCAACTACATC-3'; R: 5'-TCACTGGCAAATCGGTCCTC-3'(727 bp) 。Nkx2. 5 引 物F:: 5'-GGAGAAGACAGAGGCGGACA-3';R:5'-ACGCCGAAGTTCACGAAGTT-3'(525 bp) 。扩增产物用1.0%琼脂糖凝胶电泳显影,照相分析结果。
2 结果
2.1 人脐带来源干细胞的原代培养 人脐带华尔通氏胶小块组织在培养液中培养,5 ~7 d 后可见新生细胞,细胞呈贴壁生长,形状多为长条状或多角形,分布不均( 图1A) 。原代细胞培养10 ~14 d 进行传代,传代后在本实验条件下3 ~5 d 细胞增殖4 ~5 倍,再次传代,体外培养10 代以上,细胞增殖速度在9 代后有所减缓,细胞形态较宽大,且不规则( 图1B) 。

图1 人脐带间充质干细胞Fig 1 Human umbilical cord mesenchymal stem cells
2. 2 人脐带MSCs 筛选 加入嘌呤霉素筛选2 周,可见未转染进质粒的细胞死亡脱落,转染成功的细胞继续贴壁生长,未受嘌呤霉素影响。荧光显微镜下观察存活细胞可见绿色荧光,表明质粒成功转染进人脐带MSCs,稳定表达绿色荧光蛋白( 图2A) 。
2.3 人脐带来源的MSCs 向心肌细胞分化 显微镜下可见实验组细胞体积逐渐增大,较多杆状细胞,少量的多变形等不规则形态,胞浆内条纹样结构,培养4 周后细胞逐渐融合并相互连接形成肌管样结构;对照组细胞多为梭形,体积较小,有少量的杆状细胞,单核。两组未观察到分化细胞的自发跳动。
2.4 经5-aza 诱导后心肌细胞标记的免疫荧光检测MSCs 经转染及筛选,再经5-aza 诱导后,荧光显微镜下可见诱导后细胞均表达心肌细胞的标记物desmin( 图2B) 、troponin Ⅰ( 图2C) 和MLC-2v( 图2D) ,而未经转染及诱导的细胞检测结果为阴性( 图2E、F、G) 。
2.5 RT-PCR 检测结果 转染及诱导前人脐带MSCs Nkx2.5 和desmin RT-PCR 检测结果为阴性,经转染及5aza诱导后,细胞的Nkx2.5 和desmin 检测结果呈阳性( 图3A、B) 。
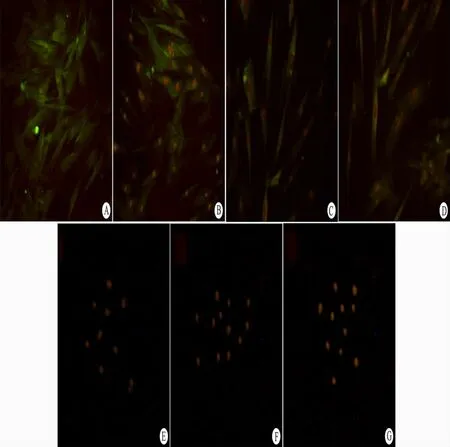
图2 转染筛选后和诱导后细胞免疫荧光染色所见Fig 2 After transfection,screening,and induction the results of immune fluorescent staining
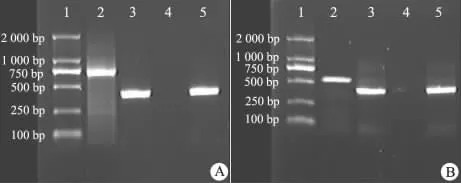
图3 Nkx2.5 和desmin RT-PCR 扩增产物琼脂糖电泳Fig 3 Agarose gel electrophoresis of RT-PCR amplifying products of Nkx2.5 and desmin
3 讨论
随着多篇重要文献对成体干细胞横向分化能力的质疑[3~5],以及胚胎干细胞存在伦理争议,因此,MSCs 因其特有的优势受到国内外研究者的重视。由于MSCs 具有一定的向心肌细胞分化的可塑性,同时易于取材和体外扩增,自体移植无免疫排斥和伦理问题,因此,对MSCs 移植治疗心肌梗死应用研究的探索近年来发展较快。2001 年德国Strauer 等[6,7]首次将MSCs 应用于心肌梗死的移植治疗,使患者的心功能得到改善,随后又证实MSCs 应用于临床治疗是安全和有效的。近年来国际上很多研究团队致力于MSCs 的心脏移植治疗试验[8~10]。
2003 年Mitchell 等[11]发现人脐带华尔通氏胶来源的基质细胞具有多能干细胞特性,之后对华尔通氏胶来源的人脐带MSCs 的认识和利用取得了很大的进步[12~14],与人胚胎干细胞( hESC) 、骨髓间充质干细胞( BMSC) 相比,人脐带MSCs 具有明显的优势: ①成本较低,来源丰富; ②不会给捐献者造成新的创伤和痛苦;③不涉及伦理问题;④人脐带MSCs 是一种较为原始的干细胞,具有极强的可塑性;⑤与BMSC 相比具有更强的扩增能力; ⑥无致瘤活性和低免疫原性;⑦与BMSC 相比,不会随着传代次数增加和机体年龄增长导致增殖能力和分化能力降低。因此,人脐带MSCs将可能成为心脏细胞移植的重要细胞来源。
如何将人脐带MSCs 诱导成为能够用于临床心脏移植的心肌细胞? 总结目前各种研究报道,诱导方法主要有3种:①体外分化研究,在体外药物诱导的模型中,去甲基化药物5-aza、成纤维样生长因子、血小板源性生长因子B 或条件培养基刺激诱导都是常用的体外诱导MSCs 向心肌细胞分化的方法[2,15,16]。Wang 等[17]发现人脐带华尔通氏胶来源的MSCs 与脐带血MSCs 表型相似,在5-aza 的作用下或者与心肌细胞共同培养的条件下能分化为具有心肌细胞标记物( N-cadherin 和troponin Ⅰ) 的细胞。本课题组前期研究发现,人脐带华尔通氏胶来源的MSCs 经5-aza 和DMSO 各自诱导后,能够向心肌细胞分化,表达心肌细胞标记物[18]。②用原代培养的心肌细胞与MSCs 共培养方法证实,原代培养心肌细胞与MSCs 接触是促进MSCs 向心肌样细胞分化的重要因素,两种细胞间接触通讯,从而使MSCs 可能接受了向心肌方向定向分化的某种特异性信号[19,20]。③体内诱导分化,研究发现,MSCs 移植治疗心肌梗死,可以促进功能血管的形成,减少心肌细胞的凋亡,防止了梗死扩展[21]; 同时由于新生的心肌组织改变了心肌梗死后的瘢痕形成进程,从而抑制左室重构的发生[22],减轻了左室扩张[5],极大地改善心功能。但以上诱导方法不能得到完全纯化的组织特定细胞是其主要的障碍,因此,如何纯化人脐带MSCs 来源的心肌细胞对于临床移植治疗具有重要的意义。
本研究在前期工作的基础上,采用细胞捕捉方法,将MLC-2v 基因启动子与嘌呤霉素抗性基因融合,转染于人脐带MSCs,通过嘌呤霉素筛选,纯化培养出MLC-2v 阳性细胞。5-aza 是胞嘧啶核苷的一个类似物,可引起DNA 中某些胞嘧啶的低甲基化,从而参与激活表型特异性的基因。这些基因在甲基化状态下含有一个肌源性决定部位,处于转录失活状态,用5-aza 诱导后,该部位去甲基化,转录激活,引起细胞向心肌源性细胞分化[23]。本研究将纯化培养出MLC-2v 阳性细胞经5-aza 诱导,诱导后细胞通过免疫荧光检测均表达心肌细胞标记物desmin、troponin Ⅰ和MLC-2v;Nkx2.5 是与心肌细胞分化密切相关的早期转录因子,本研究应用RT-PCR 技术测定分化的心肌样细胞有早期转录因子Nkx2.5 的表达。同时也检测到desmin 的表达,而诱导前的细胞均没有表达Nkx2.5 和desmin,较大提高诱导的成功率,得到相对纯化的心肌样细胞,可为临床心脏疾病的细胞移植治疗提供重要的细胞来源奠定实验基础。
通过基因修饰方法得到的心肌样细胞用于移植治疗仍有很多基础及临床问题需要解决,如通过基因修饰方法得到的心肌样细胞能否有心肌细胞的功能,移植到宿主后能否继续存活并改善心功能,这些方面还需要进一步实验研究。
[1]Ma L(马廉),Cui BL,Feng XY, et al. Biological characteristics of human umbilical cord-derived mesenchymal stem cells and their differentiation into neurocyte-like cells.Chin J Pediatr( 中华儿科杂志),2006,44(7):513-517
[2]Makino S,Fukuda K,Miyoshi S,et al. Cardiomyocytes can be generated from marrow stromal cells in vitro.J Clin Invest,1999,103(5):697-705
[3]Yang Z, Wang JM, Chen L, et al.Acute exercise-induced nitric oxide production contributes to upregulation of circulating endothelial progenitor cells in healthy subjects.J Hum Hypertens,2007,21(6):452-460
[4]Yang Z(杨震), Tao J, Tu C, et al. In vitro induction,differentiation and seeding of source cells for the endothelialization of small-diameter artificial blood vessel of polyurethane. Chinese Journal of Clinical Rehabilitation(中国临床康复),2006,10(29): 184-186
[5]Min JY, Hampton TG, Wang JF, et al.Depressed tolerance to fluorocarbon-simulated ischemia in failing myocardium due to impaired Ca(2 +) (i) modulation.Am J Physiol Heart Circ Physiol,2000,278(5):1446-1456
[6]Strauer BE, Brehm M, Zeus T, et al. Intracoronary ,humanautologous stem cell transplantation for myocardial regeneration following myocardial infarction. Dtsch Med Wochenschr,2001,126(34-35):932-938
[7]Strauer BE, Brehm M, Zeus T,et al. Repair of infracted myocardium by autologous intracoronary mononuclear bone marrow cell transplanta tionin humans.Circulation,2002,106(15):1913-1918
[8]Hu X, Yu SP, Fraser JL, et al. Transplantation of hypoxiapreconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. J Thorac Cardiovasc Surg,2008,135(4):799-808
[9]Hughey CC, Johnsen VL, Ma L, et al. Mesenchymal stem cell transplantation for the infarcted heart: a role in minimizing abnormalities in cardiac-specific energy metabolism. Am J Physiol Endocrinol Metab,2012,302(2):163-172
[10]Katare R, Riu F, Mitchell K, Gubernator M,et al.Transplantation of human pericyte progenitor cells improves the repair of infarcted heart through activation of an angiogenic program involving micro-RNA-132.Circ Res,2011,109(8):894-906
[11]Mitchell KE, Weiss ML, Mitchell BM,et al. Matrix cells from Wharton's jelly form neurons and glia. Stem Cells,2003,21(1):50-60
[12]Meng MY, Pang W, Jiang LH, et al.Stemness gene expression profile analysis in human umbilical cord mesenchymal stem cells.Exp Biol Med (Maywood),2012,237(6):709-719
[13]Gu Z, Akiyama K, Ma X, et al.Transplantation of umbilical cord mesenchymal stem cells alleviates lupus nephritis in MRL/lpr mice.Lupus,2010,19(13):1502-1514
[14]Cai J, Li W, Su H, et al.Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells.J Biol Chem,2010,285(15):11227-11234
[15]Ma Y, Zhang L, Launikonis BS, et al. Growth hormone secretagogues preserve the electrophysiological properties of mouse cardiomyocytes isolated from in vitro ischemia/reperfusion heart.Endocrinology,2012,153(11):5480-5490
[16]Liu Y, Song J, Liu W, et al. Growth and differentiation of rat bone marrow stromal cells: does 5-azacytidine trigger their cardiomyogenic differentiation? Cardiovasc Res,2003,58(2):460-468
[17]Wang HS, Hung SC, Peng ST,et al. Mesenchymal stem cells in the Wharton's jelly of the human umbilical cord. Stem Cells,2004,22(7):1330-1337
[18]Lin XB(林晓波),He HY, Frieda L, et al. Differentiation of human umbilical cord-derived mesenchymal stem cells into cardiomyocytes. J App l Clin Pediatr(实用儿科临床杂志),2007,22(13):971-973
[19]Ball SG, Shuttleworth AC, Kielty CM. Direct cell contact influences bone marrow mesenchymal stem cell fate. Int J Biochem Cell Biol,2004,36(4):714-727
[20]Xu M, Wani M, Dai YS, et al.Differentiation of bone marrow stromal cells into the cardiac phenotype requires intercellular communication with myocytes .Circulation,2004,110(17):2658-2665
[21]Shahzad U, Li G, Zhang Y, et al.Transmyocardial revascularization induces mesenchymal stem cell engraftment in infarcted hearts.Ann Thorac Surg,2012,94(2):556-562
[22]Yang YJ, Qian HY, Huang J, et al.Combined therapy with simvastatin and bone marrow-derived mesenchymal stem cells increases benefits in infarcted swine hearts.Arterioscler Thromb Vasc Biol,2009,29(12):2076-2082
[23]Zhang Y, Chu Y, Shen W, et al. Effect of 5-azacytidine induction duration on differentiation of human first-trimester fetal mesenchymal stem cells towards cardiomyocyte-like cells.Interact Cardiovasc Thorac Surg,2009,9(6):943-946

