血清神经特异性烯醇化酶和视椎蛋白样蛋白1 水平对新生大鼠缺氧缺血性脑病的诊断价值
闫 睿 初桂兰
新生儿缺氧缺血性脑病( HIE) 是围生期常见的严重疾病,也是目前新生儿重要的死亡原因之一。由于HIE 多由宫内缺氧和( 或) 产程缺氧所致,其发生发展较为隐匿。HIE 的诊断手段有产科Apgar 评分、新生儿神经反射和颅脑影像学检查等,前两者存在主观性,而影像学诊断由于新生儿配合困难,需镇静处理,尚不能广泛开展。因此,在上述诊断手段的基础上寻求更易于检测的血清标志物有较好的临床价值。血清神经特异性烯醇化酶( NSE) 与神经细胞分化及成熟有关[1];视椎蛋白样蛋白1( VILIP-1) 在脑的表达丰度最高,与神经功能异常密切相关[2],两者均与脑损伤程度呈正相关。但两者对HIE 的诊断价值尚未见报道,为此本文建立新生大鼠HIE 模型,检测建模后不同时点血清NSE 和VILIP-1 水平,探讨其诊断价值,以期为帮助HIE的诊断提供理论上的依据。
1 方法
1.1 实验动物 新生7 d Wistar 大鼠,生长条件相同,体重(11.2 ±2.4) g,雌雄不限,共144 只,由天津市放射研究所实验动物中心提供。
1.2 建模和分组 参照Rice 等[3]报道的方法建立新生大鼠HIE 模型,简述如下:结扎左侧颈总动脉,术后放回母鼠身边恢复2 h,后置于2.5 L 密闭玻璃容器中,以0.5 L·min-1输入湿化的8%氧气和92%氮气的混合气体1 h,取出新生大鼠返回母鼠身边继续喂养。分为3 组: 假手术组仅分离但不结扎左侧颈总动脉,对照组建模后不予干预,治疗组建模后予维生素E 100 μg·g-1灌胃,每日1 次。每组大鼠各48 只。
1.3 观察指标 ①模型制备指标:病变侧脑组织大体异常改变;每组取24 只大鼠于建模后72 h 内观察行为学异常,如向左侧倾倒或自发性左旋、肢体抽搐和尖叫等;②各组于建模后1、6、12、24、48 和72 h 检测血清NSE 和VILIP-1 水平,每个时点处死4 只大鼠,EP 管接取断头处血液2 ~5滴,室温静置40 min 以上,常温离心13 000 rpm × 12 min(2 次) ,吸取上清,采用ELISA 法检测。NSE 和VILIP-1 试剂盒购自Sigma 公司。
1.4 统计学方法 计量数据以x±s表示,组间比较采用t检验;计数资料以百分比表示,率的显著性采用χ2检验。对NSE 和VILIP-1 水平绘制受试者工作特征( ROC) 曲线,计算曲线下面积( AUC) 。采用SPSS 11.5 软件进行统计分析,P <0.05 为差异有统计学意义。
2 结果
2.1 HIE 模型评价 对照组建模后脑组织大体可见缺血组织呈苍白色,正常组织呈红色。对照组和治疗组缺氧5 min 后相继出现间歇性抖动、躁动不安、翻滚、抽搐和活动减少等,缺氧结束后2 ~3 h 可自行恢复。
2.2 行为学评价 至本研究观察时点建模后72 h,假手术组新生大鼠未观察到向左侧倾倒或自发性左旋、肢体抽搐和尖叫等行为学异常。对照组观察到上述3 种行为异常分别有7、11 和8 只新生大鼠; 治疗组分别有8、10 和7 只新生大鼠;对照组、治疗组行为异常发生率显著高于假手术组( P 均<0.05) ,行为异常发生率对照组和治疗组间差异无统计学意义。
2.3 各组NSE 和VILIP-1 水平比较 图1 显示,与假手术组比较,对照组12、24 和48 h 时点的NSE 水平显著增高( P <0.05) ;与对照组比较,治疗组24、48 和72 h 时点的NSE 水平显著下降,差异有统计学意义( P <0.05) 。
与假手术组比较,对照组12、24、48 和72 h 时点的VILIP-1 水平显著增高( P <0.05) ; 与对照组比较,治疗组6、12 和24 h 时点的VILIP-1 水平显著降低( P <0.05) 。
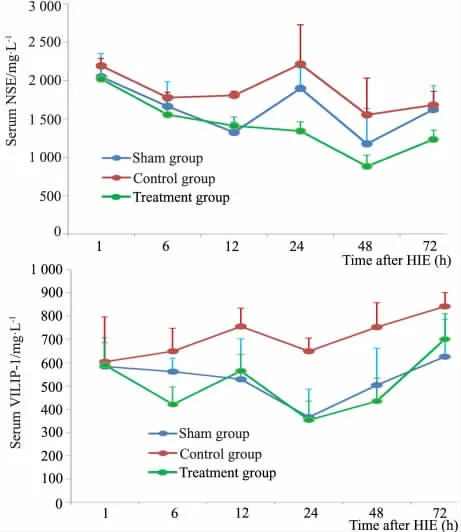
图1 各组不同时点NSE 和VILIP-1 水平比较Fig 1 Comparison of serum NSE and VILIP-1 levels at different time points of different groups
2.4 ROC 曲线分析 以对照组作为HIE 诊断金标准,以24 h 时点对照组和假手术组血清NSE 和VILIP-1 水平绘制ROC 曲线( 图2) ,NSE ROC AUC 为0.649(95%CI:0.511 ~0.898) ,以1 630 mg·L-1为阈值,诊断HIE 的敏感度为72.4%,特异度为63.7%; VILIP-1 ROC AUC 为0.840(95%CI:0.622 ~0.931) ,以590 mg·L-1为阈值,其诊断HIE 的敏感度为75.9%,特异度为99.9%。
为了进一步提高诊断准确性,将NSE 和VILIP-1 结合绘制ROC 曲线( 图3) ,AUC 为0.862( 95% CI: 0.641 ~0.944) ,取假阳性率为10%,预测概率值为0.901 3。
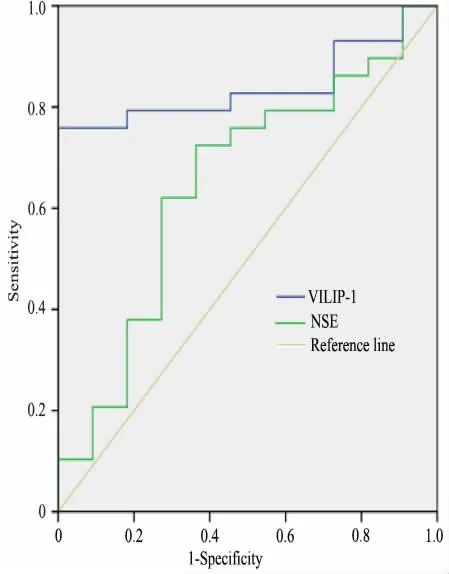
图2 NSE 和VILIP-1 诊断HIE 的ROCFig 2 The ROC curve of NSE and VILIP-1 to diagnose HIE

图3 NSE 和VILIP-1 联合诊断HIE 的ROCFig 3 The ROC curve of NSE combined with VILIP-1 to diagnose HIE
3 讨论
有研究发现,新生7 d 大鼠中枢神经系统不成熟,其发育程度类似于孕32 ~34 周的人类胎儿或新生儿。缺氧缺血性脑损伤通常局限于颈总动脉结扎一侧的大脑半球,包括选择性神经元死亡和凋亡,大脑皮质,皮质下及脑室周围白质,海马,纹状体及丘脑组织损伤[1,4]。本文对新生大鼠结扎左侧颈总动脉后缺氧,可观察到向左侧倾倒或自发性左旋、肢体抽搐和尖叫等行为学异常现象,提示存在神经细胞受损。[5]。
本文选择的血清标志物NSE 和VILIP-1 均与脑损伤有关,其中NSE 与神经细胞分化及成熟有关,可保护神经细胞免受缺氧损害[6]。当神经元水肿、变性和坏死时可释放,使脑脊液和血清NSE 升高,且脑脊液和血清NSE 水平呈正相关。近年有研究表明,NSE 在脑损伤的诊断和预后方面具有重要意义,可用来判断脑卒中、脑外伤[7]、缺氧性脑病、脑炎、肿瘤脑转移和癫持续状态等神经损伤严重程度及预后[8],且NSE 升高程度与脑损伤程度呈正相关[9]。VILIP-1 参与神经元的钙依赖型信号传导,调节信号瀑布[10,11],有研究显示缺血性脑卒中发生24 h,有44%的患者外周血可检测到VILIP-1,而对照组仅为8%。
本研究发现,对照组12 ~48 h 时点NSE 和VILIP-1 表达水平均显著高于假手术组,VILIP-1 变化趋势与NSE 接近,均在24 h 升高幅度最大,且VILIP-1 的持续升高可持续至72 h。但1 和6 h 时点与假手术差异无统计学意义,考虑可能与以下原因有关:①NSE 是坏死细胞释放的产物,早期病情较轻,坏死细胞数量较少,因此NSE 水平仅轻度升高;②NSE 从脑细胞释放首先进入脑脊液,穿过血脑屏障引起血清NSE 浓度升高存在延迟; ③VILIP-1 的表达与脑损伤存在延迟效应。ROC 曲线分析显示,NSE AUC 为0.649,VILIP-1 AUC 为0.840,提示VILIP 诊断价值更好,两者结合AUC 为0.862,优于单一指标。另有文献报道,即使轻度(2%) 溶血亦可能导致NSE 水平升高5 倍[12]。因此,当有溶血发生时可能导致NSE 检测结果呈假阳性。
新生儿HIE 造成的神经损害多为不可逆,目前较为有效的治疗手段为在对症支持基础上加亚低温治疗[13~15]。维生素E 为抗氧化剂,减少超氧化物对细胞的损伤[16]。临床上用于治疗脑卒中[17],虽然新生儿HIE 与成年人脑卒中发病机制不尽相同,前者是由于血液携氧量降低,后者是由于血流中断,但共同点是均出现脑细胞缺氧。HIE 造成脑细胞坏死和凋亡已成为共识[10],因此推断细胞内亦存在氧自由基增多,故本研究治疗组选择维生素E 进行干预,主要观察其对NSE 和VILIP-1 水平的影响,结果显示,治疗组NSE 水平较对照组下降,从12 h 时点起差异有统计学意义;VILIP-1 水平6、12 和24 h 治疗组显著低于对照组,提示维生素E 干预24 h 后的效果可能较差。但治疗组和对照组在观察时间内行为学异常率差异无统计学意义,提示神经功能未能恢复,推测原因如下:①NSE 具有神经细胞保护功能,维生素E 降低血清NSE 水平,不利于神经细胞恢复;②维生素E 疗程和剂量不足。
本文研究结果显示,NSE 和VILIP-1 对新生大鼠HIE具有中等的诊断价值,但两者均为神经损伤指标,在新生儿颅内感染、癫或其他神经系统疾病亦可升高[18],其中NSE 已证实在神经母细胞瘤患儿体内显著增加[19],因此仍需结合其他诊断手段进行诊断。维生素E 对新生儿HIE的疗效不显著。
[1]Olivecrona Z, Koskinen LO. The release of S-100B and NSE in severe traumatic head injury is associated with APOE ε4.Acta Neurochir (Wien),2012,154(4):675-680
[2]Tarawneh R, Lee JM, Ladenson JH, et al. CSF VILIP-1 predicts rates of cognitive decline in early Alzheimer disease.Neurology,2012,78(10):709-719
[3]Rice JE 3rd, Vannucci RC, Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat.Ann Neurol,1981,9(2):131-141
[4]Hussein MH, Daoud GA, Kakita H, et al. High cerebrospinal fluid antioxidants and interleukin 8 are protective of hypoxic brain damage in newborns. Free Radic Res,2010,44(4):422-429
[5]Bi Y(毕业), Chen JJ, Li Y, et al. The role of CYP2E1 in the protection of garlic oil's from n-hexane-induced neurotoxicity. Chinese Journal of Industrial Hygiene and Occupational Diseases (中华劳动卫生职业病杂志),2011,29(11):825-833
[6]Ennen CS, Huisman TA, Savage WJ, et al. Glial fibrillary acidic protein as a biomarker for neonatal hypoxic-ischemic encephalopathy treated with whole-body cooling. Am J Obstet Gynecol,2011,205(3):251
[7]Alam JM, Baig JA, Mahmood SR, et al. Diagnostic utility of neuron specific enolase (NSE) in serum and pleural fluids from patients with lung cancer and tuberculosis. Pak J Biochem,2010,43(3):131-134
[8]Goodman MD, Makley AT, Huber NL, et al. Hypobaric hypoxia exacerbates the neuroinflammatory response to traumatic brain injury. J Surg Res,2011,165(1):30-37
[9]Berger RP, Bazaco MC, Wagner AK, et al. Trajectory analysis of serum biomarker concentrations facilitates outcome prediction after pediatric traumatic and hypoxemic brain injury.Dev Neurosci,2010,32(5-6):396-405
[10]Park HA, Kubicki N, Gnyawali S, et al. Natural vitamin E alpha-tocotrienol protects against ischemic stroke by induction of multidrug resistance-associated protein 1. Stroke,2011,42(8):2308-2314
[11]Yamagata K, Tagami M, Yamori Y. Neuronal vulnerability of stroke-prone spontaneously hypertensive rats to ischemia and its prevention with antioxidants such as vitamin E. Neuroscience,2010,170(1):1-7
[12]Daubin C, Quentin C, Allouche S, et al. Serum neuronspecific enolase as predictor of outcome in comatose cardiacarrest survivors: a prospective cohort study. BMC Cardiovasc Disord,2011,11:48
[13]Key Laboratory of Neonatal Diseases,Ministry of Health(卫生部新生儿疾病重点实验室),Children's Hospital of Fudan University ,Editorial Board of Chinese Journal of Evidencebased Pediatrics. Guideline of evidence-based treatment for hypoxic-ischemic encephalopathy in full-term infants(standard version,2011). Chin J Evid Based Pediatr(中国循证儿科杂志),2011,6(5):327-335
[14]Key Laboratory of Neonatal Diseases,Ministry of Health(卫生部新生儿疾病重点实验室),Children's Hospital of Fudan University ,Editorial Board of Chinese Journal of Evidencebased Pediatrics. 足月儿缺氧缺血性脑病循证治疗指南(2011-简化版). Chin J Evid Based Pediatr(中国循证儿科杂志),2011,6(5):336
[15]Key Laboratory of Neonatal Diseases,Ministry of Health(卫生部新生儿疾病重点实验室),Children's Hospital of Fudan University.Programme of mild hypothermia treatment for hypoxic-ischemic encephalopathy in neonates(2011)Chin J Evid Based Pediatr(中国循证儿科杂志),2011,6(5):337-339
[16]Planche V, Brochet C, Bakkouch A, et al. Importance of hemolysis on neuron-specific enolase measurement. Ann Biol Clin (Paris),2010,68(2):239-242
[17]Northington FJ, Chavez-Valdez R, Martin LJ. Neuronal cell death in neonatal hypoxia-ischemia. Ann Neurol,2011,69(5):743-758
[18]Zhao CJ, Noack C, Brackmann M, et al. Neuronal Ca2 +sensor VILIP-1 leads to the upregulation of functional alpha4beta2 nicotinic acetylcholine receptors in hippocampal neurons. Mol Cell Neurosci,2009,40(2):280-292
[19]Seaton G, Hogg EL, Jo J, et al. Sensing change: The emerging role of calcium sensors in neuronal disease.Semin Cell Dev Biol,2011,22(5):530-535

