西江下游浮游植物群落周年变化模式
王 超,赖子尼,李新辉,* ,高 原,李跃飞,余煜棉
(1.中国水产科学研究院珠江水产研究所,广州 510380;2.农业部珠江中下游渔业资源环境科学观测实验站,广州 526100;3.广东工业大学,广州 510006)
浮游植物利用光能驱动光合作用产生有机物,是水域生态环境中生命有机体的初级生产者,形成水生动物食物链的基础环节[1-3]。其通过吸收水体中的营养盐成分促进自身的生长繁殖,同时也满足了浮游动物的摄食需求,进而开启了能量在水生动物食物链中的传递,并最终将影响渔业资源的输出甚至整个水域生态系统的稳定。此外,浮游植物群落的组成和变化与水环境密切相关,是水环境细微变化的敏感指示生物[4]。
西江源出云南沾益马雄山,河长2074.8km,是珠江最大的支流。该流域地处亚热带,水生态环境良好,渔业资源较为丰富,是沿江城市居民日常生活用水的主要来源。肇庆江段位于西江的下游,是珠江干流汇入珠三角河网水域的咽喉通道,受上游河水冲刷所带来的泥沙、矿物质和有机物的影响,该江段的水体较为浑浊,营养物质含量丰富,加之水流较缓,滞留时间较长,为水生动物和浮游植物提供了较好的生存环境。为了解西江水生态系统的现状及未来演化趋势,本研究小组自2005年起在西江肇庆江段设置长期监测点(距离河口约160多km),内容涉及鱼类群落、漂流性仔鱼、浮游生物、水化因子和重金属污染等。其中,浮游植物的连续监测工作始于2008年,具体监测时间为每天8:00;2010年起改为昼夜分布的连续监测,分早、中、晚3个时段进行。
根据我们所掌握的资料,目前有关西江浮游植物的研究报道并不多。除了20世纪80年代初由珠江水产研究所牵头对珠江水系的渔业资源进行调查时涉及到了西江浮游植物的常见科属,近年来仅见王超等[5-6]对西江两个广东鲂(Megalobrama terminalis)产卵场的浮游植物组成及颗粒直链藻的种群生态特征进行了研究报道。国际上的相关研究发现,江河浮游植物群落结构的普遍模式为绿藻在种类丰富度上占据优势地位,而少数硅藻物种在生物量上占据优势[7-9]。作者的研究报道已表明中心纲硅藻颗粒直链藻(Aulacoseira granulata)是调查江段的全年优势种[6],但是有关浮游植物群落组成及变化的内容仍未进行阐述。此外,国际上的相关假说认为在营养盐较为丰富的低地河流中,浮游植物群落组成及变化主要受物理因素的影响,与营养盐含量关联不大[10]。本文基于西江肇庆江段长期监测点2009年浮游植物群落及环境因子的数据资料,阐析浮游植物群落的周年变化特征及其与环境因子的关系,并与国际上在类似区域的研究成果进行对比,分析它们的共性及差异,为西江水域生态环境评价和保护工作提供科学依据。
1 材料与方法
1.1 调查站位和时间
调查站位是本研究小组的长期监测点,位于肇庆市区肇庆渔政码头上游约50 m处(23°2'40″N,112°27'5″E)(图1),本次调查时间为2009年1月1日至12月30日,调查频率为每5d 1次,具体时间为每天8:00。春节期间(2月15日、20日)未进行野外样本的采集工作。

图1 调查站位布设图Fig.1 Map of sampling sites
1.2 样本采集、处理及数据收集
浮游植物样本取表层(离水面0.5 m)水样1 L装入聚乙烯瓶中,立即用鲁格氏液固定,使其最终浓度为15‰。水样运回实验室后,立即移入标记刻度1000 mL玻璃量筒内,加盖静置24 h后,用管口包裹筛绢的虹吸管或吸管小心吸去上清液。如此反复多次,直至将水样浓缩至30—100 mL。分析时取均匀样品1 mL注入Sedgewick—Rafte浮游植物计数框中,在Nikon TS100倒置显微镜下进行浮游植物的种类鉴定和计数。另取500 mL水样,现场过滤后置入带冰块的冷藏箱中运回实验室,用水质流动注射分析仪进行营养盐分析。
水温数据采用自动水温记录仪获得,每小时记录1次。径流量和水位的数据是从以下网址:http://xxfb.hydroinfo.gov.cn获得,降雨量的数据是从以下网址:http://www.weatheronline.co.uk/weather的趋势图上读取近似的数据。
1.3 数据整理和相关分析
浮游植物生物量的计算方法参照Hillebrand等[11],通过体积法计算取几何近似值,分析过程中将生物量在总种群中所占百分比大于5%的物种定为优势种。
为了更好地阐析浮游植物群落组成及变化与环境因子之间的关系,对浮游植物总种类丰富度、真浮游植物种类丰富度和偶然性浮游植物进行了比较分析,物种的划分依据参照Van den Hoek等[12]的结果。
本文后述的种群演替的时间变化图用Origin 6.1软件完成,而种群变化与环境因子之间的关系用Canoco 4.5软件进行分析,并得到PCA二维降序图。
2 结果
2.1 水文环境
文章中所调查的西江肇庆段水文环境数据随时间变化情况引自作者报道的资料[6]。
在研究水域中,9月份之前水温呈缓慢上升,4月10日前水温基本低于20℃,全年最低水温出现在1月15日,仅8月20日至9月15日期间水温高于30℃,9月10日达到最大值,之后下降,11月10日后水温开始在20℃左右徘徊,一般低于20℃。相邻两次调查的水温最大差值出现在11月10日和15日之间,差值为14.35℃。
西江肇庆段全年径流量仅在5月至8月期间出现4个明显的洪峰,与之相比,其它季节变化不大。但是仍可发现4月份之前的径流量基本维持在3000 m3/s以下水平,4月份开始缓慢上升;8月1日第4个峰值过后,径流量开始下降,10月1日后,径流量基本维持在2000 m3/s以下水平。
调查期间,除1月和2月外,其它月份均有降雨。6月和7月的降雨频率最高,其中7月份的降雨频率达85.71%。单月仅出现1次降雨的包括8、10、11、12月。单日降雨量最大值出现在9月15日,为50.5 mm。
2.2 物种组成及优势种分布
调查期间共发现浮游植物种类7门,245种(包括变种、变型)。其中硅藻32属104种,占总种数的42.44%;绿藻37属85种,占总种数的34.69%;裸藻6属31种,占总种数的12.65%;蓝藻8属18种,占总种数的7.34%;其它包括甲藻4种,金藻2种和黄藻1种。
调查期间主要物种(包括优势种和常见物种)的组成和分布如表1所示,包括硅藻7种,绿藻6种,裸藻2种。其中,出现率高且对总生物量贡献大的物种有颗粒直链藻原变种(Aulacoseira granulata var.granulata)、变异直链藻(Melosira varians)和尖新月藻变异变种(Closterium acutum var.variabile),仅颗粒直链藻原变种为真浮游植物种类。出现率高且对总生物量贡献小的物种有梅尼小环藻(Cyclotella meneghiniana)、扭曲小环藻(Cyclotella comta)、短小楔形藻(Licmophora abbreviata)、舟形藻(Navicula sp.)、镰形纤维藻奇异变种(Ankistrodesmus falcatus var.mirabilis)和被甲栅藻(Scenedesmus armatus),大多数种类为真浮游植物。其它物种出现率低且对总生物量的贡献小,仅在某些月份成为优势种,多为真浮游植物种类。
2.3 种类丰富度的时间变化
由图2可知,浮游植物种类丰富度的时间变化模式整体呈现高温季节高,低温季节低的特点。种类丰富度的变化范围为2—58种,最大值出现在7月20日,最小值出现在3月5日。4月份之前,种类数总和维持在20种以下,之后呈现上升趋势,持续至8月底。8月份之前出现了几个明显的高值,分别为4月25日的49种,5月25日的55种和7月20日的58种;8月份的种类数维持在较高的水平,该月最大值为8月30日的50种。自9月份开始,种类数的变化比较平稳,基本维持在15—25种的水平。浮游植物主要类群(硅藻和绿藻)种类丰富度的时间变化模式与总种群的变化模式基本一致(图2)。从百分组成上看,硅藻和绿藻在总种群中所占百分比之和一般不低于80%(图2);从两者的相对组成上看,1月,硅藻和绿藻相等;2—4月,绿藻优于硅藻;5—12月,硅藻优于绿藻,其中10—12月,硅藻的优势度极为明显(图2)。
真浮游植物种类丰富度的时间变化模式与总种类数的变化模式是一致的(图2),种类丰富度的变化范围为1—29种,最大值出现在7月20日,最小值出现在3月5日。真浮游植物的主要类群为硅藻、绿藻和裸藻,其中硅藻种类数的周年变化模式比较平稳,变化幅度(0—8种)也不大,这与硅藻总种类数的单峰型的变化模式是不一致的,与其变化幅度(0—29种)也存在很大差异(图2);绿藻为真浮游植物的最主要类群,其周年变化模式与绿藻总种类数的变化模式一致,其变化幅度(0—18种)与总种类数的变化幅度(0—21种)差异也不大;裸藻物种基本均为真浮游种类,主要出现在高温季节。从百分组成上看,绿藻为真浮游种类的最主要类群,一般不低于50%;硅藻次之,但是高温季节百分比明显低于低温季节,3月至9月期间维持在20%左右;裸藻百分比额变化范围为0—31%,最大值出现在6月,4月至8月的其它月份维持在20%左右(图2)。

表1 主要物种(优势种和常见物种)的组成和分布Table1 Composition and distribution of main species(dominant and common species)
2.4 种群生物量的时间变动
由图3可知,调查期间浮游植物的总生物量变化呈现明显的双峰型,两个峰值分别出现在8月30日(5.29 mg/L)和11月1日(10.91 mg/L)。生物量的变化范围为0.003—10.91 mg/L,均值为0.39 mg/L,最小值出现在3月15日。硅藻是浮游植物总生物量的最主要组成类群,调查期间其在总种群中所占百分比均大于50%,尤其在8月至12月期间,其百分组成基本不低于90%(图3)。除硅藻外,1月至3月期间的主要类群为绿藻,4月至7月期间的主要类群为绿藻和裸藻。
真浮游植物生物量的周年变化模式与总浮游植物非常一致,两个峰值也分别出现在8月30日(5.26 mg/L)和11月1日(10.88 mg/L)。生物量的变化范围为0.0001—10.88 mg/L,均值为0.35 mg/L,最小值出现在3月1日。从百分组成上看,除1月至3月期间硅藻的优势程度更加明显之外,还发现,4月至7月期间裸藻生物量贡献大于绿藻,这与图中绿藻贡献大于裸藻的结果相反。其它月份各类群的相对组成均为硅藻占据绝对优势(图3)。
2.5 相关分析
2.5.1 种类丰富度与环境因子的关系
用Canoco软件首先对5个浮游植物类群(硅藻、绿藻、裸藻、蓝藻和其它)的总种类丰富度数据进行去趋势对应分析(DCA),在所得的各特征值部分发现4个排序轴中梯度最大值小于3,以此为依据选择线性模型中的间接梯度分析PCA模型对5个浮游植物类群的种类丰富度与9种环境因子(水温、径流量、降雨量、硅酸盐、磷酸盐、硝态氮、亚硝态氮、氨氮和总氮)进行相关分析,图4为所得到的种类丰富度与环境因子的PCA二维降序图。
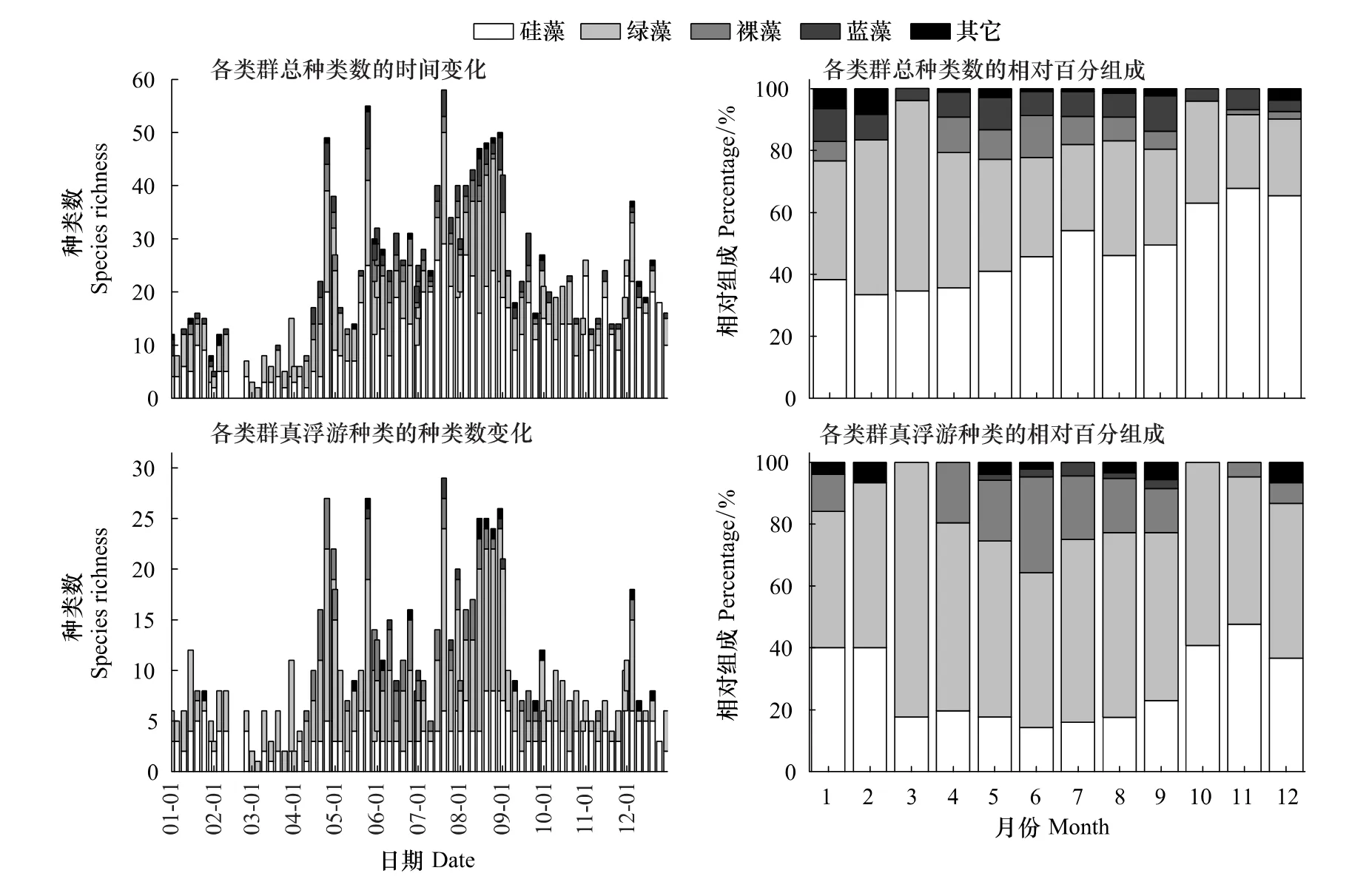
图2 浮游植物种类丰富度的时间变化及相对组成Fig.2 Temporal variations of phytoplankton species richness and relative contribution
对于浮游植物各类群种类丰富度而言,第一、第二排序轴之间的相关系数为0,表明这两个排序轴所包含的信息是相互独立的(表2);对于环境因子来说,前2个排序轴的累计贡献率分别为57.8%和90.3%,这说明前2个排序轴约含有9种环境因子的90%的信息,所以可以用PCA二维降维图研究9种环境因子间的相互关系(表3)。各类群种类丰富度第一个排序轴与环境因子第一个排序轴的相关系数较高,为0.78,各类群种类丰富度第二个排序轴与环境因子第二个排序轴的相关系数为0.73(表2),这表明PCA二维降序图可以较好地解释种类丰富度与环境因子之间的关系(图4)。
从PCA二维降序图可看出,浮游植物各类群种类丰富度与水温和径流量的排序方向一致,均呈正相关,因而当水温高、径流量大时,有利于所有藻类丰富度的增加;而硅酸盐主要影响硅藻、对蓝藻和其它藻类也稍有影响(均呈正相关),但与绿藻及裸藻的相关性不高(其夹角余弦值较小),故影响并不明显,因而当硅酸盐含量高时,主要是对硅藻丰富度的增加有好处。
用Canoco软件对5个浮游植物类群的生物量数据进行分析处理的过程与种类丰富度的相同,最终得到各类群生物量与环境因子的PCA二维降序图(图5)。
对于各类群生物量而言,第一、第二排序轴之间的相关系数为0,表明这两个排序轴所包含的信息是相互独立的;对于环境因子来说,前2个排序轴分别含有9种环境因子的99.3%和0.7%的信息,这表明基本上可以用二维降维图的横坐标值研究9种环境因子间的相互关系(图5,表3)。浮游植物各类群生物量第一个排序轴与环境因子第一个排序轴的相关系数为0.45;各类群生物量与环境因子第二个排序轴的相关系数为0.42(表2),这表明PCA二维降序图基本可以用来解释生物量与环境因子之间的关系。

图3 浮游植物生物量的时间变化及各类群相对丰度Fig.3 Temporal variations of phytoplankton population density 、biomass and relative contribution
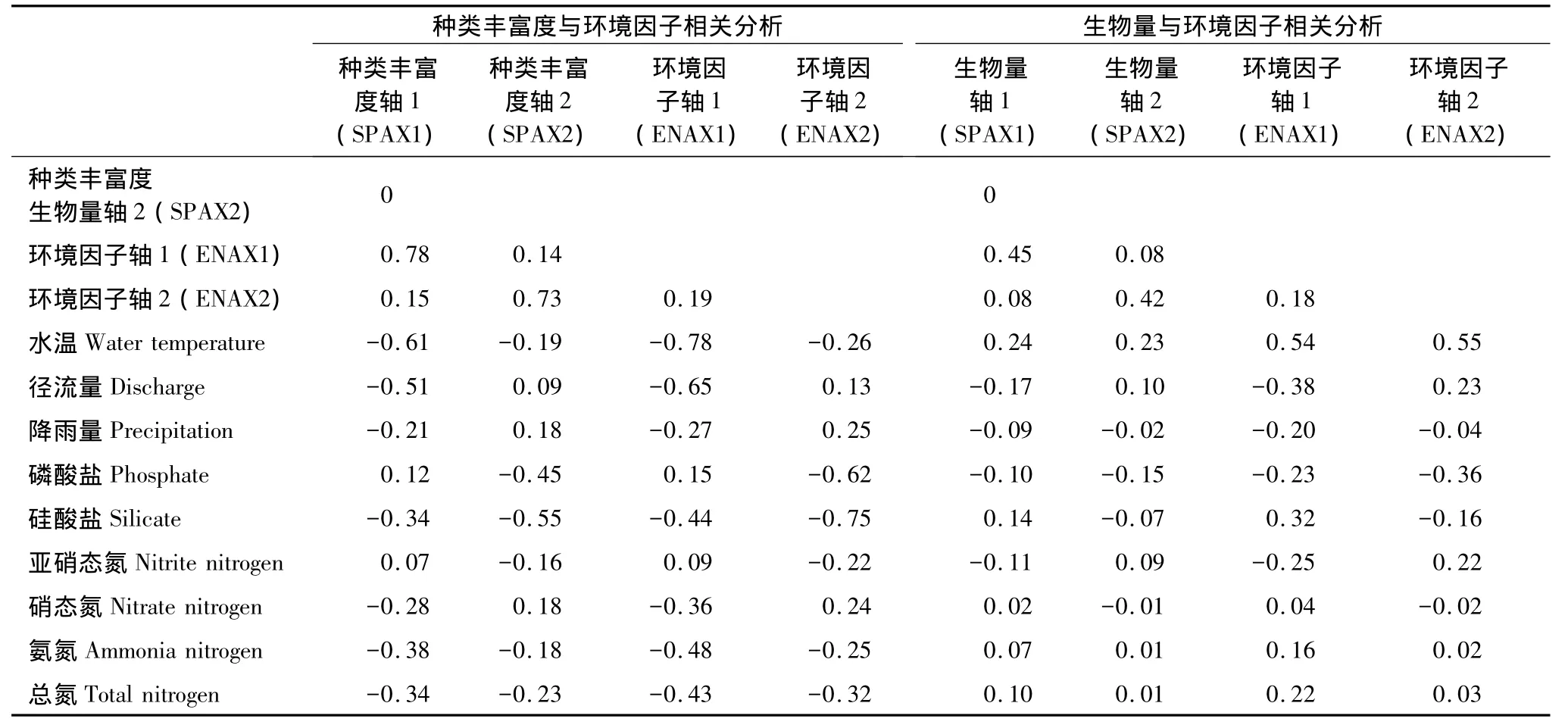
表2 浮游植物种类丰富度和生物量、环境因子前2个PCA排序轴与环境因子间的相关系数Table2 Correlation coefficients for phytoplankton species richness,biomass,environment factors axis1 and axis2,and environmental factors
PCA二维降序图表明,浮游植物各类群生物量主要与水温、径流量和硅酸盐有关。水温升高时,主要有利于硅藻、绿藻、蓝藻和其它藻类的生长,对裸藻的生长也稍有些好处;径流量大时,主要有利于裸藻的生长,对蓝藻、绿藻和其它藻类生物量的增长也稍有好处,但不利于硅藻的生长(因径流量与硅藻的夹角为钝角,两者呈负相关);而硅酸盐对藻类生长的影响主要是硅藻,当其浓度升高时,硅藻生物量的增长会加大,但对裸藻的生长没好处,与蓝藻、绿藻和其它藻类的线性相关程度并不高,影响不明显。

图4 浮游植物种类丰富度与环境因子的PCA二维降序图Fig.4 Ordination diagram of the first two axes of principle correspondence analysis of phytoplankton species richness and environmental factors

图5 浮游植物生物量与环境因子的PCA二维降序图Fig.5 Ordination diagram of the first two axes of principle correspondence analysis of phytoplankton biomass and environmental factors
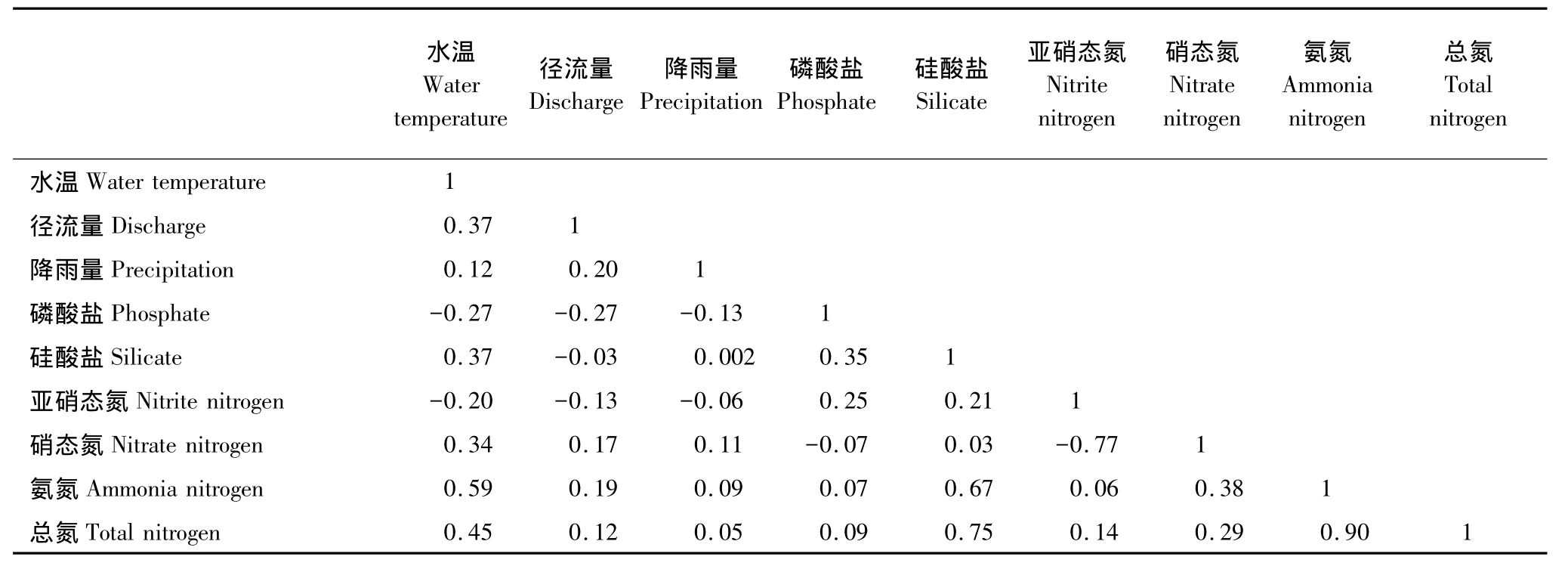
表3 PCA分析中环境因子之间的相关系数矩阵的下半区Table3 The next part of coefficient matrix between environmental factors in PCA analysis
3 讨论
研究结果显示,西江下游浮游植物种类和类群组成丰富,这与Bahnwart等[13]的研究结论是一致的,其认为具有一定的水深且流速缓慢的下游江段有利于不同浮游植物类群的存在和生长。硅藻和绿藻是西江肇庆江段浮游植物群落的最主要类群,此外,裸藻在种类及生物量组成上均有一定的贡献,蓝藻虽然在种类组成上有一定的贡献,但是生物量极低,这种群落组成模式与国内外其它江河[14-18]的研究结果也是一致的。
如表1所示,调查江段的主要物种仅有15种(包括硅藻7种,绿藻6种和裸藻2种),其中出现率高且对生物量贡献大的物种仅3种(包括2种硅藻和1种绿藻)。有研究表明,存在少数优势种并伴随大量零星的其它物种是世界上大的江河生态系统中浮游植物群落结构的主要特征[19-20]。作者的前期工作已表明,颗粒直链藻是调查江段的全年优势种[6],其它优势种的出现不具有连续性,对生物量的贡献也明显偏低(表1)。此外,在所鉴定的245种藻类物种中,出现率大于10%的物种仅69种,绝大多数为零星出现。以上结果均表明,调查江段的浮游植物群落结构特征与国内外其它江河的结论相吻合。
浮游植物总种类丰富度的周年变化呈现明显的季节特征(图2),PCA分析结果表明,当水温高、径流量大时,有助于提高所有类群种类丰富度;硅酸盐含量高时,能提高硅藻的丰富度(图4)。Unni和Pawar[16]在Mahanadi江的研究表明,对浮游植物种群影响最大的环境因子是水温。西江肇庆段的浮游植物种类丰富度呈现高温季节高,低温季节低的特点(图2),一方面,是因为西江大多数藻类物种直接喜好高温,另一方面,高温季节一般伴随着高强度光照,有利于藻类进行光合作用。Lakshminarayana[21]调查发现Ganga江夏季的浮游植物种类从之前的37种增长到82种,这与夏季水温升高和高光照有直接关系。此外,种类丰富度与径流量也存在显著正相关关系(图4),不难发现种类丰富度的季节波动与径流量的季节波动规律关系密切[6]。Train和Rodrigues[22]在Baía江的调查发现洪水期的种类丰富度最大。高径流量不仅可以从上游带来更多的藻类物种从而增强藻类丰富度的累积效应,也可以通过更强烈的水体搅动作用使已沉降藻类和底栖藻类重新悬浮回到表层水体中,从而增加了种类丰富度。硅藻是调查江段浮游植物群落的最重要组成类群,硅藻物种的细胞壁组成需要大量的硅元素[23-24],因此硅酸盐浓度的升高有助于硅藻种类组成的稳定和生物量的增长。尽管真浮游植物总种类数的周年变化趋势与总浮游植物的变化趋势及其相近,但是不同类群之间却存在不一致性(图2)。单从最主要类群硅藻和绿藻来看,真浮游硅藻种类数周年变化平稳,与硅藻总种类数的单峰模式及数值均存在显著差异;而真浮游绿藻种类的周年变化趋势及数值与绿藻总种类丰度极其接近,这说明调查江段的浮游植物物种组成中,硅藻组成主要依赖半浮游种类和偶然性浮游种类,而绿藻组成主要依赖真浮游种类。Istvánovics和Honti[9]认为江河浮游藻类的自我维持种群主要是半浮游硅藻物种,而真正的浮游种群主要是绿藻,其主要依靠周期性的外源注入。研究结果支持此观点,但是所得到的半浮游和偶然性浮游硅藻物种主要来自于外源注入还是调查江段的底栖种类再悬浮,有待进一步研究和验证。
调查期间,浮游植物生物量呈现明显的双峰型(图3),且2个峰值均出现在4次洪峰之后。PCA分析结果显示,水温升高有利于硅藻、绿藻、蓝藻和其它藻类生物量的增长,对裸藻的增长也稍有些好处,但是两个峰值出现之前,尽管水温持续上升,生物量一直维持在较低水平,没有明显变化,很可能是因为水温上升对浮游植物生长的促进作用被径流量增大导致的稀释作用所掩盖。PCA分析结果也显示,径流量大时虽然有助于其它藻类类群生物量的增长,但对硅藻的生长不利,而硅藻恰恰是生物量的最重要贡献者。调查期间,生物量的两个峰值所对应的水体径流量分别为3430 m3/s和1680 m3/s,代表了相对稳定的水体环境。巧合的是,浮游植物生物量的两个峰值的比值(大/小)2.06近似等于各自对应的径流量数值的反比值2.04(大/小),这在一定程度上反映了水体径流量增大对浮游植物种群丰度的稀释作用。Salmaso和Braioni[25]认为径流量大不仅可以稀释藻类密度,同时引起的水体浑浊可以削弱藻类对光的可利用率,相反,径流量小,水体中悬浮颗粒少,水下光照条件好,在适宜的水温条件下,浮游植物种群丰度和生物量均会出现较大增长[26-27]。Istvánovics和Honti[9]在匈牙利的3条河流的研究也发现,叶绿素a浓度与径流量存在负相关关系。除稀释作用影响外,高径流量时浮游植物生物量还受制于较短的运输时间和平流损耗的影响[28]。从各类群的相对组成上看,硅藻生物量占据绝对优势(图3)。Swale[29]的研究发现,绿藻主要在水流较快的江河上游江段占据优势,而硅藻主要在江河下游江段占据优势。其它江河的研究也发现,硅藻占据绝对优势地位,并伴随有大量不同的绿藻物种是世界上不同江河的基本特征[14-15,30-33]。真浮游植物生物量的变化趋势和数值与总浮游植物极其接近,这主要得益于真浮游硅藻物种颗粒直链藻的优势,其对生物量的最大贡献接近100%(表1)。
综上所述,硅藻和绿藻是调查江段浮游植物群落的重要组成类群,且硅藻在生物量上占据绝对优势,这与国际上江河浮游植物的群落组成模式是比较一致的。但是硅藻的种类丰富度略高于绿藻,这很可能与调查江段的硅酸盐含量比较丰富有关。浮游植物各类群的种类丰富度和生物量的周年变化趋势均与水温和径流量的关系密切,这与国际上相关假说的结论也是一致的,不过水温对种类丰富度和生物量的增长均起到积极作用;而径流量对种类丰富度的增长起积极作用,主要是有助于真浮游绿藻种类的外源补充及半浮游和偶然性浮游硅藻的补充;径流量对生物量的增长起消极作用,主要是径流量的增大所带来的稀释作用减缓了生物量增长的速度。
致谢:营养盐数据由穆三妞等协助测定,样本采集由肇庆渔政支队协助完成,中国科学院南海海洋研究所林强研究员帮助写作,特此致谢。
[1] Forsberg B R,Araujolima C A R M,Martinelli L A,Victoria R L,Bonassi J A.Autotrophic carbon-sources for fish of the central Amazon.Ecology,1993,74:643-652.
[2] Skidmore R E,Maberly SC,Whitton B A.Patterns of spatial and temporal variation in phytoplankton chlorophyll a in the River Trent and its tributaries.The Science of the Total Environment,1998,210/211:357-365.
[3] Cloern J E and Dufford R.Phytoplankton community ecology:Principles applied in San Francisco Bay.Marine Ecology Progress Series,2005,285:11-28.
[4] Kowe R,Skidmore R E,Whitton B A,Pinder A C.Modelling phytoplankton dynamics in the River Swale,an upland river in NE England.The Science of the Total Environment,1998,210/211:535-546.
[5] Wang C,Li X H,Lai Z N,Tan X C,Li J,Li Y F,Pang SX.The study on community structure difference of phytoplankton in two Megalobrama hoffmanni spawning grounds of Xijiang River.Guangdong Agriculture Science,2010,4:156-160.
[6] Wang C,Lai Z N,Li Y F,Li X H,Lek S,Hong Y,Tan X C,Li J.Population ecology of Aulacoseira granulata in Xijiang River.Acta Ecologica Sinica,2012,32(15):4793-4802.
[7] Rojo et al.,1994.An elementary,structural analysis of river phytoplankton.Hydrobiologia 289:43-55
[8] Reynolds and Descy 1996.The production,biomass and structure of phytoplankton in large rivers.Arch Hydrobiol.Suppl.113:161-187
[9] Istvánovics V and Honti M,2011.Phytoplankton growth in three rivers:The role of meroplankton and the benthic retention hypothesis.Limnology and Oceanography,56(4):1439-1452
[10] Tavernini S,Pierobon E and Viaroli P.Physical factors and dissolved reactive silica affect phytoplankton community structure and dynamics in a lowland eutrophic river(Po river,Italy).Hydrobiologia,2011,669:213-225
[11] Hillebrand H,Dûrselen C D,Kirschtel D,Pollingher U,Zohary T.Biovolume calculation for pelagic and benthic microalgae.Journal of Phycology,1999,35:403-424.
[12] Van den Hoek,C D G Mann and H M Jahns,1995.Algae.An Introduction to Phycology.Cambridge University Press,Cambridge
[13] Bahnwart M,Hübener T and Schubert H.Downstream changes in phytoplankton composition and biomass in a lowland river-lake system(Warnow River,Germany).Hydrobiologia,1999,391:99-111.
[14] Holmes N T H and Whitton B A.Phytoplankton of four rivers,the Tyne Wear,Tees and Swale.Hydrobiologia,1981,80:111-127.
[15] Schmidt A.Main characteristics of the phytoplankton of the Southern Hungarian section of the River Danube.Hydrobiologia,1994,289:97-108.
[16] Unni K S and Pawar S.The phytoplankton along a pollution gradient in the river Mahanadi(M.P.state)India a multivariate approach.Hydrobiologia,2000,430:87-96.
[17] O'Farrell I,Lombardo R J,Pinto P T,Loez C.The assessment of water quality in the Lower Luján River(Buenos Aires,Argentina):phytoplankton and algal bioassays.Environmental Pollution,2002,120:207-218.
[18] Descy J P,Leitao M,Everbecq E,Smitz J S and Deliège J F.Phytoplankton of the River Loire,France:a biodiversity and modelling study.Journal of Plankton Research,2012,34(2):120-135.
[19] Descy J P.Ecology of the phytoplankton of the River Moselle:effects of disturbances on community structure and diversity.Hydrobiologia,1993,249:111-116.
[20] Devercelli M.Phytoplankton of the Middle Paraná River during an anomalous hydrological period:a morphological and functional approach.Hydrobiologia,2006,563:465-478.
[21] Lakshminarayana J SS.Studies on the phytoplankton of the River Ganges,Varanasi,India,Part II“The seasonal growth and succession of the plankton algae in the River Ganges”.Hydrobiologia,1965,25:138-165.
[22] Train S and Rodrigues L C.Temporal fluctuations of the phytoplankton community of the Baía River floodplain,Mato Grosso do Sul,Brazil.Hydrobiologia,1998,361:125-134.
[23] Hoetzel G,Croome R.Population dynamics of Aulacoseira granulata(EHR.)SIMONSON(Bacillariophyceae,Centrales),the dominant alga in the Murray River,Australia.Archiv fuer Hydrobiologie,1996,136:191-215.
[24] Odebrecht C,Abreu P C,Möller O O,Niencheski L F,Proença L A,Torgan L C.Drought effects on pelagic properties in the shallow and turbid Patos Lagoon,Brazil.Estuaries,2005,28:675-685.
[25] Salmaso N and Braioni M G.Factors controlling the seasonal development and distribution of the phytoplankton community in the lowland course of a large river in Northern Italy(River Adige).Aquatic Ecology,2008,42:533-545.
[26] Carvajal-Chitty H I.Some notes about the Intermediate Disturbance Hypothesis and its effects on the phytoplankton of the middle Orinoco River.Hydrobiologia,1993,249:117-124.
[27] Piirsoo K.Phytoplankton of Estonian rivers in midsummer.Hydrobiologia,2001,444:135-146.
[28] Townsend SA,Przybylska M,Miloshis M.Phytoplankton composition and constraints to biomass in the middle reaches of an Australian tropical river during base flow.Marine and Freshwater Research,2012,63:48-59.
[29] Swale E M F.Phytoplankton in two English rivers.Journal of Ecology,1969,57:1-23.
[30] Hudon C,Paquet S,Jarry V.Downstream variations of phytoplankton in the St.Lawrence River(Québec,Canada).Hydrobiologia,1996,337:11-26.
[31] Ha K,Kim H W,Joo G.J.The phytoplankton succession in the lower part of hypertrophic Nakdong River(Mulgum),South Korea.Hydrobiologia,1998,369/370:217-227.
[32] Zalocar de Domitrovic Y.Structure and variation of the Paraguay River phytoplankton in two periods of its hydrological cycle.Hydrobiologia,2002,472:177-196.
[33] Devercelli M.Changes in phytoplankton morpho-functional groups induced by extreme hydroclimatic events in the Middle Paraná River(Argentina).Hydrobiologia,2010,639:5-19.
参考文献:
[5] 王超,李新辉,赖子尼,谭细畅,李捷,李跃飞,庞世勋.西江广东鲂产卵场浮游植物群落差异分析.广东农业科学,2010,4:156-160.
[6] 王超,赖子尼,李跃飞,李新辉,Sovan Lek,洪颐,谭细畅,李捷.西江颗粒直链藻种群生态特征.生态学报,2012,32(15):4793-4802.

