不同施氮处理玉米根茬在土壤中矿化分解特性
蔡 苗,董燕婕,李佰军,周建斌
(西北农林科技大学资源环境学院农业部西北植物营养与农业环境重点实验室,杨凌 712100)
农田生态系统受人为利用和管理措施的影响较大,作物成熟后地上部分被移除,大量根系残茬存留在土壤里。作物根茬留田是培肥地力的主要机理之一,越来越受到人们的重视。
不少学者从农学角度研究了玉米根系的分布特性。玉米根系的扩展范围一般为1.25 m,大部分根系可达1.6 m[1]。张喜英[2]指出,夏玉米80% 以上的根系集中分布在0—40 cm 土层中。苗惠田等[3]研究表明,不同施肥处理中玉米根茬平均占整株玉米生物量的5.5%。在表层(0—30 cm)土壤中玉米根系干重占总根重的65.7%—74.2%[4]。农业生产中施用化肥,在提高作物产量的同时,也增加了作物秸秆和根茬的数量。有研究表明,施用氮磷钾肥料后玉米根茬生物量是不施肥对照的2.5倍[3];此外,玉米根系分布及其含氮量也明显受到氮肥种类与施氮量的影响[5]。
一些研究指出,玉米秸秆残体和根系残体对土壤有机碳的积累作用存在差异,与作物地上部分茎秆碳相比,根系中的碳更加稳定,对土壤有机碳的贡献作用更显著[6-7],且对根际的影响最大[8]。目前关于不同施肥处理与玉米根茬养分特性的关系及根茬还田对土壤养分循环的影响等报道较少。为此,本文以不同施氮量处理下的玉米根茬为研究对象,采用室内培养试验方法研究其在不同土层深度的土壤中分解转化特性及对土壤碳、氮组分的影响,旨在了解施肥与作物根茬养分特性的关系,为合理施肥、维持生态系统养分平衡提供理论依据。
1 材料与方法
1.1 供试材料
不同施氮量处理的玉米根茬采自西北农林科技大学农作一站(108°04'07″E,34°17'56″N)不同栽培模式定位试验田。该定位试验始于2003年6月,实行冬小麦—夏玉米轮作,一年两熟。夏玉米每年6月初播种,10月初收获。氮肥施用尿素(含N 46%),每季作物施氮量为0、120和240 kg N/hm2,试验不同处理重复4次,玉米种植期间分别在苗期和拔节期追肥,各占总施氮量的1/3和2/3,穴施。玉米品种为郑单958。供试土壤取自同一定位试验田,土壤类型为褐土类,塿土亚类,红油土属,系统分类为土垫旱耕人为土,耕层土壤质地为粉砂质粘壤土。
2010年10月初玉米收获时,用铁锹在施氮量为0、120和240 kg N/hm2小区收集0—20 cm深度的玉米根茬,分别用R0、R120、R240表示。在不同施氮处理小区中沿梅花形分别收集5株玉米根茬,带回实验室后洗去泥土,90℃杀青半小时,60℃烘干,粉碎并通过1 mm筛,按照相同施氮量处理混合均匀后备用。收集玉米根茬同时,采集玉米种植保护带15—20 cm和45—50 cm两个土层土壤,剔除作物根、石块等杂物,风干,磨细过2 mm筛备用。土壤样品及玉米根茬基本性状如表1所示。
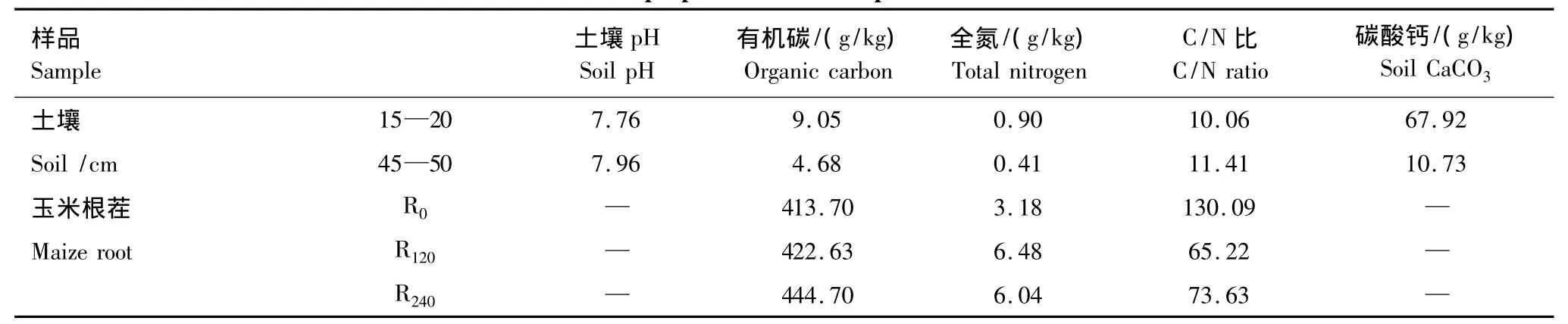
表1 土壤及玉米根茬样品基本性质Table1 Basic properties of soil samples and maize roots
1.2 矿化培养试验
以上述15—20 cm和45—50 cm两个层次土壤和R0、R120、R2403种不同施氮量处理玉米根茬为研究因素,同时设不加玉米根茬的土壤作为对照,组成完全方案,共8个处理,每个处理重复15次。培养试验开始前测定土壤含水量,加蒸馏水至含水量为土壤田间持水量的70%,预培养一周以恢复土壤微生物活性。称取土样20 g(按烘干土计算),3种不同施氮量处理玉米根茬以2% 的比例分别与两个层次的土样混合均匀后装入培养瓶,同时设不加根茬的土壤对照(CK)和无土壤样品的空白处理。在培养的第 1、2、3、5、6、7、8、9、11、16、18、22、26、30、35、41、47、53、58、64、70、76、79、84、89、93、97、103、105 天测定各处理 CO2释放量,并于培养第 0、10、30、60、100天取各处理中的3个重复测定土壤微生物量碳、可溶性有机碳和矿质态氮含量。
1.3 分析项目及测定方法
土壤和玉米根茬中的有机碳采用重铬酸钾-外加热法;土壤和玉米根茬中全氮采用半微量凯氏法;土壤碳酸钙采用气量法测定;土壤含水量用烘干法;pH值测定水土比为5∶1[9]。
CO2释放量采用碱液吸收法测定[10]。将盛有10 mL 0.1 mol/L NaOH溶液的塑料瓶和装有土样的培养瓶置于同一外瓶中,加盖密封,置于25℃ 恒温培养箱中。定期更换NaOH溶液,并用称重法保持水分。1.5 mL 1 mol/L BaCl2沉淀-0.1 mol/L盐酸溶液滴定剩余NaOH溶液,根据NaOH消耗量计算培养期间CO2释放。
土壤微生物量碳测定采用氯仿熏蒸浸提法[11],用0.5 mol/L K2SO4浸提(水土比4∶1),土壤微生物量碳含量以熏蒸和未熏蒸土壤的碳含量之差除以转化系数kEC得到(kEC=0.45)[12]。土壤可溶性有机碳用0.5 mol/L K2SO4浸提(水土比4∶1),TOC分析仪(Phoenix 8000)测定。土壤矿质态氮用0.5 mol/L K2SO4浸提(水土比4∶1),流动分析仪测定,矿质态氮为铵态氮和硝态氮含量之和。
1.4 数据处理方法
数据分析采用Microsoft Excel 2007和SAS8.0软件进行方差分析,Duncan法进行多重比较。采用一次动力学方程模型,拟合玉米根茬碳矿化随培养时间的累积量变化[13-14],表达式为:Ct=C0(1-e-kt),式中C0为潜在碳矿化释放的CO2量,Ct为经过t时间后累积释放的CO2量,k为碳库周转速率,半周转期T1/2=ln2/k。
2 结果与分析
2.1 不同施氮量玉米根茬碳矿化特性
培养过程中不同施氮量处理的玉米根茬CO2释放速率如图1所示。培养起始阶段3种根茬在两个层次土壤中CO2释放速率均最高,随时间延长逐渐降低,这与培养起始玉米根茬中微生物易利用的碳源较多有关。培养6周后15—20 cm土层土壤各处理CO2释放速率趋于稳定,而45—50 cm土层土壤培养3周后CO2释放速率趋于平稳。不同施氮量处理玉米根茬相比,R120和R240根茬CO2释放速率高于R0,R120与R240之间差异不显著。培养后期(>80 d)不同处理玉米根茬矿化速率基本稳定在10 mg·kg-1·d-1。
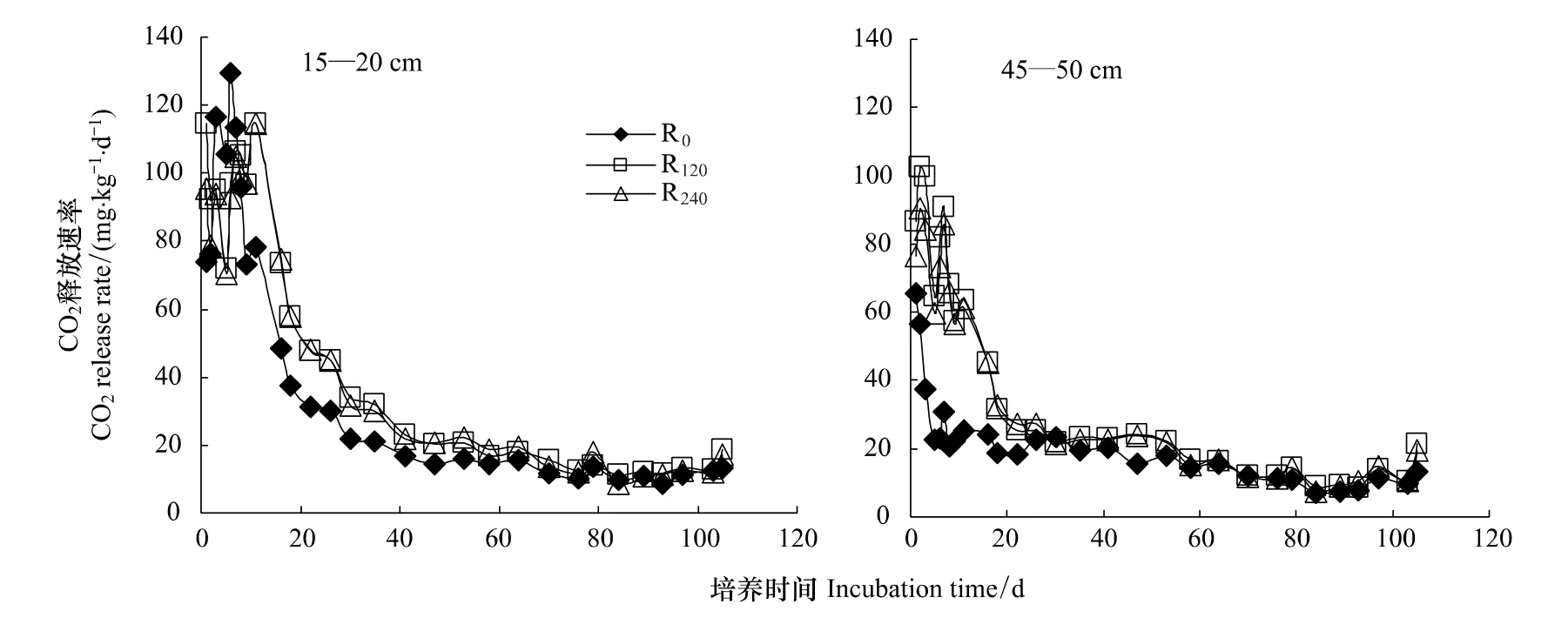
图1 不同施氮量处理玉米根茬CO2释放速率动态变化Fig.1 Dynamics of CO2 release rate of maize roots derived from different nitrogen fertilization fields
添加玉米根茬的土壤CO2释放量与对照土壤CO2释放量的差值反映了培养过程中玉米根茬有机碳的表观矿化量。不同处理玉米根茬累积表观矿化量动态变化如图2所示。15—20 cm土层土壤中不同施氮处理玉米根茬在培养的前20 d累积表观矿化量差异不显著,之后R120和R240根茬碳矿化量逐渐高于R0,R120与R240之间无明显差异。45—50 cm土层土壤中R120和R240根茬的累积表观矿化量始终高于R0。培养前期(前20d)在15—20 cm土层土壤中根茬矿化量占整个培养过程(105d)根茬有机碳矿化总量的52.24%—55.01%,在45—50 cm土壤中根茬矿化量占有机碳矿化总量的32.67%—46.65%。
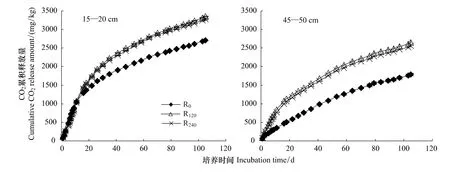
图2 不同施氮量处理玉米根茬CO2累积释放量动态变化Fig.2 Amount of cumulative CO2 release of maize roots derived from different nitrogen fertilization fields
不同处理玉米根茬在土壤中分解特性见表2。培养结束时(105d)在15—20 cm和45—50 cm土层土壤中,不同施氮量处理玉米根茬CO2累积释放量均为R120最高,R240次之,R0最低。15—20 cm和45—50 cm土层土壤中R120根茬的CO2累积释放量较R0分别高23.69% 和48.44%,差异显著(P<0.05),R120和R240根茬之间差异不显著。
不同处理玉米根茬碳矿化率为培养结束时根茬CO2累积释放量占培养起始时加入根茬总有机碳含量的比例。由表2可见,培养结束时不同处理玉米根茬碳矿化率在15—20 cm和45—50 cm土层土壤中均为R120>R240>R0,3 种根茬彼此间差异显著(P<0.05)。不同土层相比,R0、R120、R240根茬在15—20 cm 土层土壤中的碳矿化率分别比其在45—50 cm土层土壤中高51.70%、26.41%、27.84%。
如表2所示,采用一次动力学方程拟合玉米根茬CO2累积释放量随培养时间变化方程的相关系数均达到极显著水平(P<0.01)。不同土层土壤中,根茬潜在碳矿化量C0为R120>R240>R0。不同土层土壤比较,15—20 cm土层土壤玉米根茬的潜在碳矿化量高于45—50 cm土壤相应根茬。生物活性碳库周转速率k在15—20 cm土层土壤大于在45—50 cm土层土壤,即在下层土壤中R0、R120和R240根茬的活性碳库半周转期较上层土壤分别长2.1、3.4 和4.4 d。
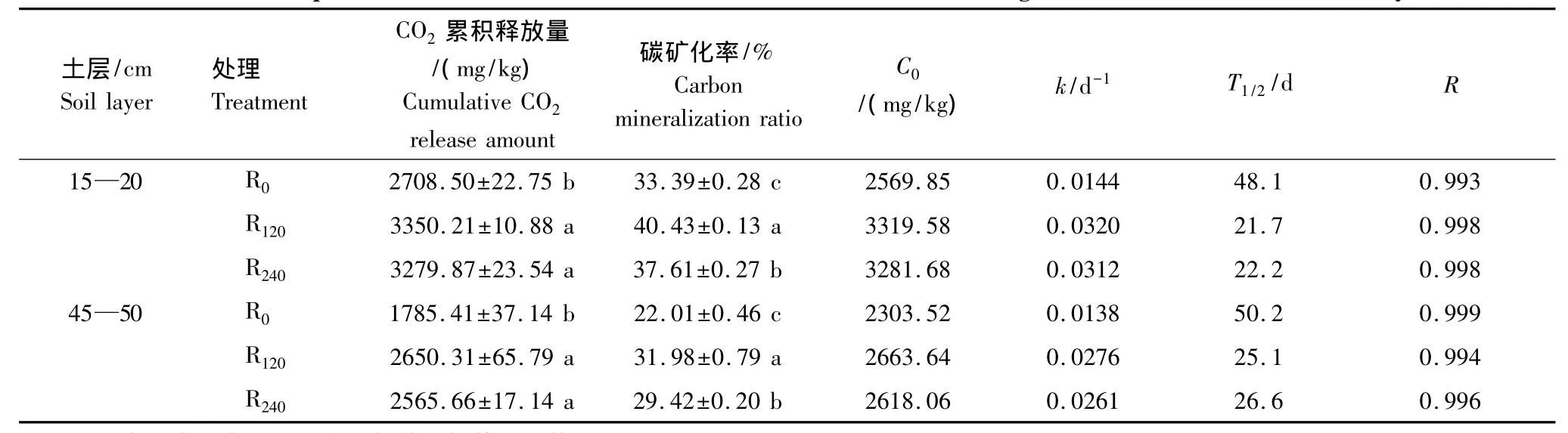
表2 不同施氮量处理玉米根茬在土壤不同土层的分解特性Table2 Decomposition characteristics of maize roots derived from different nitrogen fertilization fields in two soil layers
2.2 添加玉米根茬对土壤碳、氮组分的影响
2.2.1 土壤微生物量碳(SMBC)含量动态变化
由图3可知,添加玉米根茬处理在15—20 cm及45—50 cm土层土壤中的微生物量碳含量均较对照土壤显著提高(P<0.05)。添加3种不同施氮量处理玉米根茬处理的土壤在培养过程中15—20 cm和45—50 cm土层SMBC平均含量范围分别为355.88—468.37 mg/kg和103.57—180.42 mg/kg。培养期间(105d)同一土层不同施氮量玉米根茬处理SMBC的平均含量为R120最高,R240次之,R0处理最低,R120与R240之间差异不显著。15—20 cm土层土壤CK、R0、R120和R240处理土壤微生物量碳的平均含量分别为45—50 cm土层土壤相应处理的13.45、3.12、2.55 和2.65 倍,差异显著(P<0.05)。培养 10d 时 45—50 cm 土层土壤中添加 R0、R120和R240根茬的处理土壤微生物量碳含量较培养起始(0 d)提高了11.94%—43.96%。
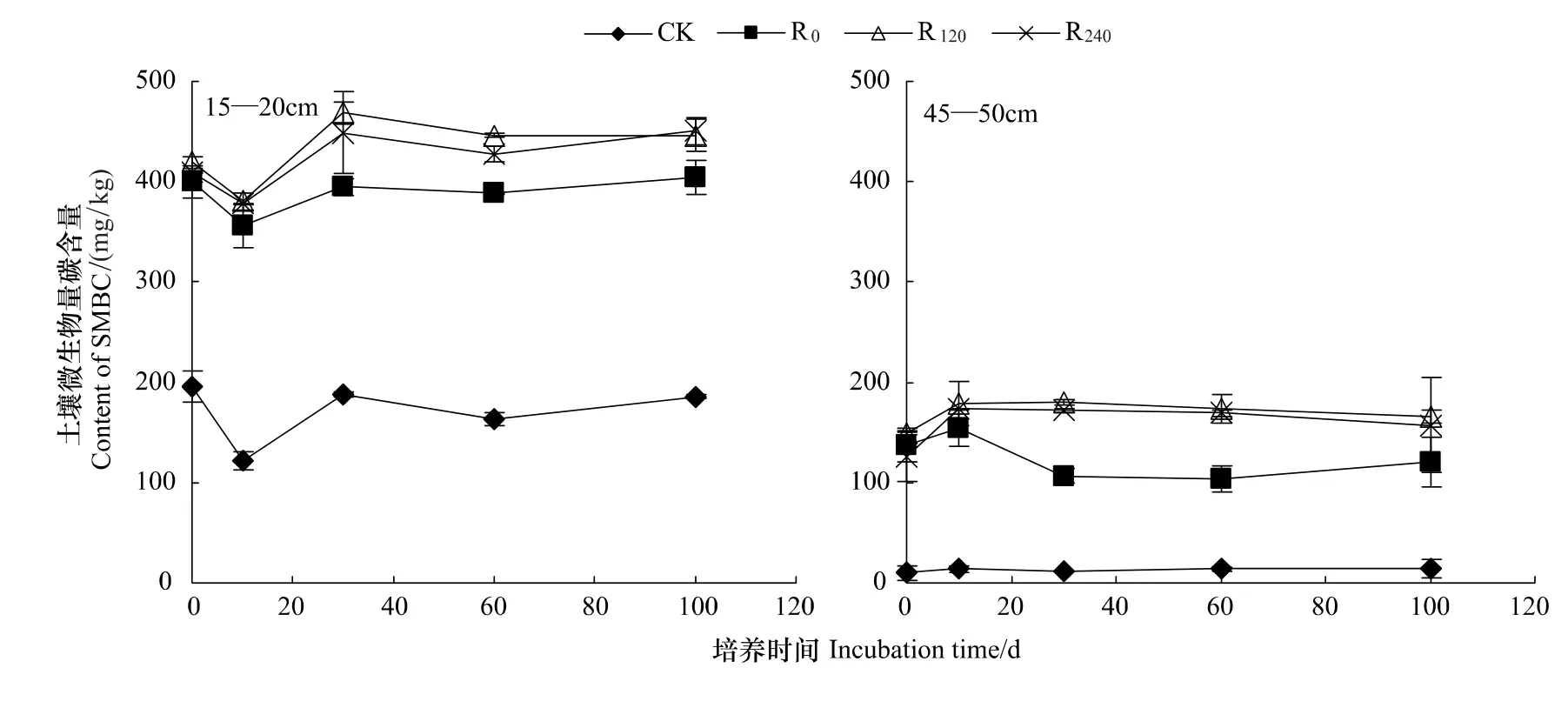
图3 不同根茬处理培养过程中SMBC含量动态变化Fig.3 Dynamics of SMBC concentrations in soils mixed with different maize roots during the 105-day incubation period
2.2.2 土壤可溶性有机碳(DOC)含量动态变化
由图4可见,添加玉米根茬处理15—20 cm和45—50 cm土层土壤DOC含量均较对照土壤显著提高。培养过程中15—20 cm及45—50 cm土层土壤DOC平均含量分别为90.1—155.6 mg/kg和52.0—160.8 mg/kg,R0、R120、R240处理差异不显著。DOC平均含量最高为45—50 cm土层土壤R120处理,最低为45—50 cm土层CK处理。同一土层土壤,DOC平均含量为R120最高,R240次之,R0最低。15—20 cm土层CK、R0、R240处理DOC平均含量较45—50 cm土层分别高73.4%、28.0% 和1.7%。
培养30 d时15—20 cm土层各处理土壤DOC含量达到整个培养期间最低,比起始DOC含量降低了26.9%—45.9%;45—50 cm土层除CK处理在30 d时DOC含量最低,其余处理DOC含量均在培养10 d时达到最低值,较起始降低了60.5%—71.2%,之后各处理土壤DOC含量呈逐渐增加趋势。培养结束时,15—20 cm和45—50 cm土层 R0、R120、R240处理 DOC含量较培养起始分别降低了14.0%—35.8% 和31.4%—61.1%,其中R120处理DOC含量下降最多,R240处理次之,R0处理下降幅度最小。
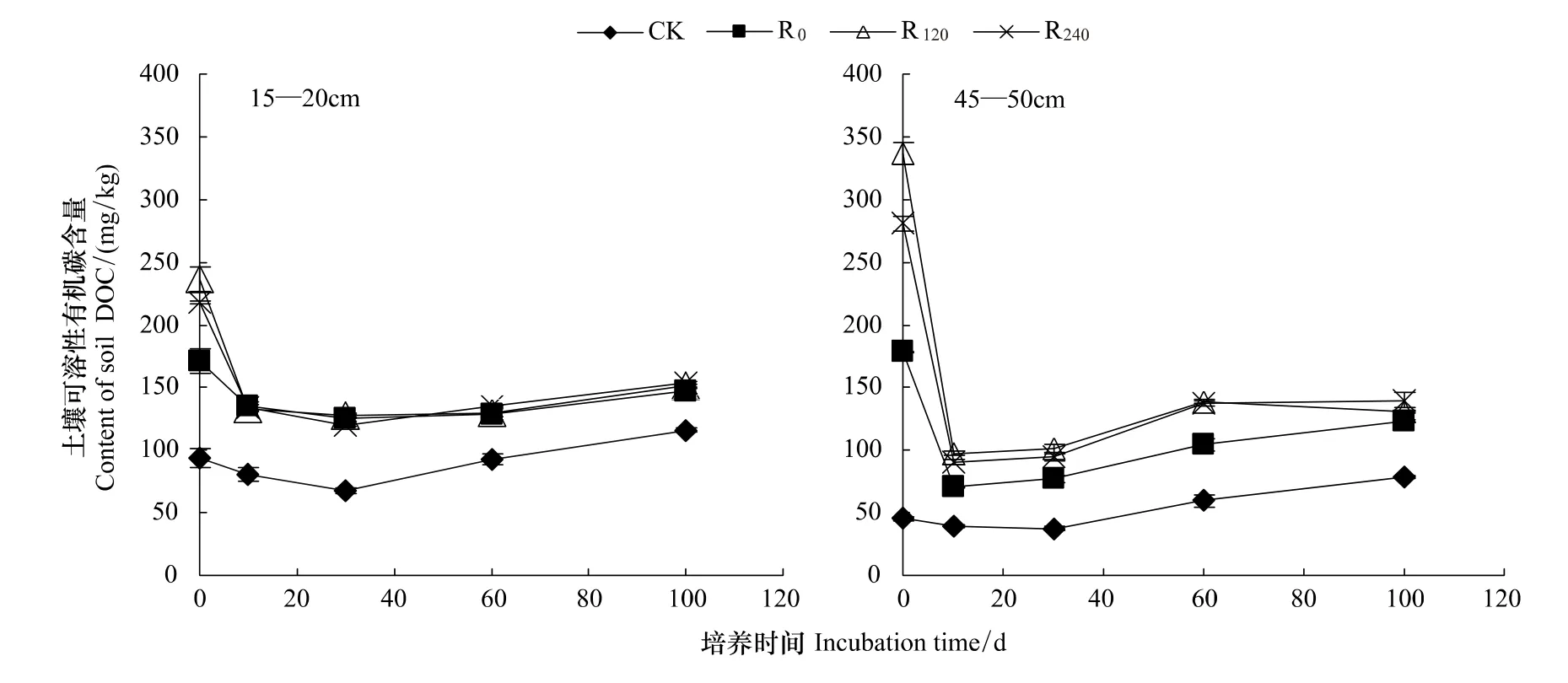
图4 不同根茬处理培养过程中DOC含量动态变化Fig.4 Dynamics of DOC concentrations in soils mixed with different maize roots during the 105-day incubation period
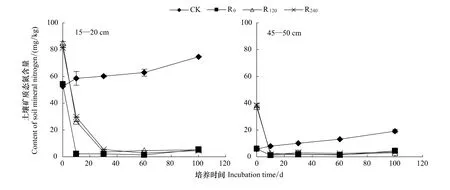
图5 不同根茬处理培养过程中土壤矿质态氮含量动态变化Fig.5 Dynamics of soil mineral N concentrations in soils mixed with different maize roots during the 105-day incubation period
2.2.3 土壤矿质态氮含量动态变化
由图5可见,培养起始时15—20 cm和45—50 cm土层土壤R120和R240处理土壤矿质态氮含量显著高于R0和CK处理。随着培养时间延长,CK处理土壤矿质态氮含量呈逐渐增加趋势。R0、R120和R240处理的土壤矿质态氮含量在培养10 d时显著下降,在15—20 cm和45—50 cm土层土壤中,分别比培养起始降低了63.7%—96.1% 和80.0%—95.8%,其中15—20 cm土层土壤R0处理矿质态氮含量下降幅度最大。培养10d至结束,R0、R120和R240处理土壤矿质态氮含量均显著低于对照土壤,添加R0、R120和R240根茬的各处理之间矿质态氮含量差异不显著。培养后期(60—100 d)添加R0、R120和R240根茬处理的土壤矿质态氮含量有所增加,培养100 d时矿质态氮含量在15—20 cm和45—50 cm土层土壤分别比培养60 d时增加了14.17%—338.45% 和 36.41%—235.96%。
3 讨论
3.1 不同施氮处理玉米根茬在土壤中分解特性的差异
从培养过程中玉米根茬的分解动态看,培养前期根茬碳矿化速率较高,随着培养的进行,其分解释放的CO2量逐渐降低。这是因为培养起始时根茬中单糖、有机酸和蛋白质等易分解有机物质的逐渐消耗,微生物难降解利用的组分(如木质素、多酚等)比例增加有关[15],与其他学者的研究结果一致[16]。
本试验表明,长期不同施肥处理会影响根茬在土壤中的分解特性。与不施氮肥根茬R0相比,施氮量为120和240 kg N/hm2小区的玉米根茬在培养过程中有机碳矿化率在15—20 cm和45—50 cm土层土壤中分别增加了21.06%、12.65%和45.28%、33.68%,这与施用氮肥处理提高了玉米根茬氮素含量,降低了根茬的碳氮比有关。与不施氮肥根茬R0相比,R120、R240根茬全氮含量分别提高103.77%、89.94%,C/N分别降低49.87%、43.40%(表1)。Saetre等[17]利用15N标记试验表明,C/N低的有机物料能够加快土壤碳、氮循环。陈兴丽[16]等研究表明施用化肥或化肥与有机肥配施显著增加了玉米秸秆中氮素含量,使得秸秆C/N明显降低,施氮量为0、120和240 kg N/hm2处理的玉米秸秆C/N为N120>N0>N240,碳矿化率N120与N0秸秆无明显差异,N240秸秆高于前两者。本研究结果中玉米根茬C/N为R0>R240>R120,R120和R240根茬碳矿化率显著高于R0,根茬C/N与其培养过程中有机碳累积表观矿化量呈极显著(P<0.01)负相关关系。植物残体中易分解活性有机物的含量与其分解特性具有紧密的联系,作物秸秆与根茬存在差异。从培养起始时加入不同处理玉米根茬土壤矿质氮及可溶性有机碳的含量看(图4,图5),加入R120、R240处理玉米根茬土壤矿质氮及可溶性有机碳含量显著高于不施氮肥根茬R0,说明不同增施氮肥处理同时增加了玉米根茬中活性有机碳及无机氮的含量,这可能是其有机碳分解率较不施肥根茬高的主要原因。
3.2 不同施氮处理玉米根茬对土壤活性有机碳组分的影响
与对照土壤相比,添加玉米根茬显著增加了土壤SMBC含量,与其他学者的研究结果一致[18]。王淑平[19]等研究,较对照和单施化肥土壤相比,玉米秸秆和根茬留田可分别增加土壤微生物量碳含量38.4%—84.9%和27.2%—51.6%。这与玉米根茬为土壤微生物提供有效养分和能源,促进了微生物的活性、繁衍有关。不同施氮处理玉米根茬相比,施用氮肥处理玉米根茬(R120、R240)培养过程中土壤微生物量碳含量均高于不施肥玉米根茬R0。不同施肥处理玉米根茬对土壤微生物量碳的影响主要与不同玉米根茬的碳、氮等化学组分的差异性有关,同时也反映了微生物利用根茬中养分的特异性。
土壤可溶性有机碳是土壤有机碳库中最活跃的组分之一,是土壤微生物的最主要能源[20],可溶性有机物中有10%—40%的组分能够直接被微生物分解利用[21]。土壤中的可溶性有机碳是土壤有机物转化和微生物代谢活动的中间产物,其含量的高低是土壤微生物对有机物分解与利用的综合反映[22]。张晋京等[23]试验表明,玉米秸秆本身含有较多的水溶性物质。本研究中加入玉米根茬后,给土壤中补充了丰富的可溶性有机碳,为土壤微生物繁殖提供了可利用的碳源,促使微生物数量增加。不同处理随着培养时间延长,土壤可溶性有机碳含量逐渐降低。培养30 d时15—20 cm土层土壤各处理DOC含量比起始时降低了26.9%—45.9%,45—50 cm土层土壤DOC含量在培养10 d时比起始降低了60.5%—71.2%,说明土壤中大量可溶性有机碳因易被微生物利用而在培养前期大量发生矿化,这与赵满兴[22]的培养试验结果相符。随着培养进行,微生物逐渐利用难分解的有机物质,产生可溶性有机物,使得土壤中可溶性有机碳含量缓慢增加。
虽然土壤微生物量碳及可溶性有机碳均是土壤有机碳库中最活跃的组分,但培养过程中其变化趋势存在差异(图3,图4)。土壤DOC含量可能来源于根系本身,也可来自土壤有机物质在腐解过程中的分解,因此有必要进一步研究这两个组分间的联系。
3.3 根茬在不同土层土壤中的分解特性差异
不同土层土壤比较,不同施氮量处理根茬在15—20 cm土层土壤的CO2累积表观释放量、有机碳矿化率、潜在可释放CO2量、土壤微生物量碳含量等均高于45—50 cm土层土壤,玉米根茬在下层土壤的半周转期也较上层土壤时间长,这与下层土壤肥力较低,土壤微生物活性弱有关。Sanaullah[24]研究称,根系物质对下层土壤有机质的贡献很大,有机物在下层土壤中的平均滞留时间较长。根系残体的加入能够显著增加土体上、下层中的微生物数量。与表土相比,下层土壤较好的非生物腐解条件能够弥补其不良的物理化学特性。本研究采用培养试验的方法比较了不同施肥处理玉米根茬在采自不同土层土壤中的分解特性,应该看到,室内培养条件与田间实际存在很大差异,因此,有必要进一步采用田间试验研究作物根茬还田在不同层次土壤中的分解转化特性及其对土壤碳、氮等养分循环的影响。
根茬是农田生态系统中土壤有机物归还的主要来源。许多研究关注施肥提高作物产量及增加归还土壤根茬的数量,本研究表明,不同施肥处理影响玉米根茬碳、氮等养分含量,进而对其施入土壤后分解转化特性产生影响。因此,在评价根茬还田培肥土壤及其在农田生态系统碳、氮等养分循环中的作用时,应考虑不同施肥处理对根茬特性的影响,以达到平衡施肥,提高产量和保持地力常新的目的。
[1] Liu JM,An SQ,Liao R W,Ren SX,Liang H.Temporal variation and spatial distribution of the root system of corn in a soil profile.Chinese Journal of Eco-Agriculture,2009,17(3):517-521.
[2] Zhang X Y.Crop Root and Soil Water Utility.Beijing:China Meteorological Press,1999.
[3] Miao H T,Zhang W J,Lu JL,Huang SM,Xu M G.Effects of long-term fertilization on assimilated carbon content and distribution proportion of maize in fluvio-aquic soil.Scientia Agricultura Sinica,2010,43(23):4852-4861.
[4] Wang X L,Ren C L,Cheng Q C,Dai J Y,Jiang Y.Effect of fertilizer application on quantity of maize roots.Journal of Jilin Agricultural University,1990,12(3):55-60.
[5] Yi Z X,Wang P,Tu N M.Responses of roots distribution and nitrogen content of summer maize to nitrogen fertilization types and amounts.Plant Nutrition and Fertilizer Science,2009,15(1):91-98.
[6] Gale W J,Cambardella C A.Carbon dynamics of surface residue-and root-derived organic matter under simulated no-till.Soil Science Society of America Journal,2000,64(1):190-195.
[7] Rasse D P,Rumpel C,Dignac M F.Is soil carbon mostly root carbon?Mechanisms for a specific stabilization.Plant and Soil,2005,269(1/2):341-356.
[8] Wilts A R,Reicosky D C,Allmaras R R,Clapp CE.Long-term corn residue effects:harvest alternatives,soil carbon turnover,and root-derived carbon.Soil Science Society of America Journal,2004,68(4):1342-1351.
[9] Bao SD.Soil and Agricultural Chemistry Analysis.3rd ed.Beijing:China Agricultural Press,2005.
[10] Wen Q X.Research Method of Soil Organic Matter.Beijing:China Agriculture Press,1984:273-281.
[11] Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass C.Soil Biology and Biochemistry,1987,19(6):703-707.
[12] Wu J,Joergensen R G,Pommerening B,Chaussod R,Brookes P C.Measurement of soil microbial biomass C by fumigation-extraction-an automated procedure.Soil Biology and Biochemistry,1990,22(8):1167-1169.
[13] Xu J B,He Y Q,Li C L,Liu X L,Jiang C L.Relationship between biologically active organic carbon pool and carbon fractions in upland soils different in fertilization.Soils,2007,39(4):627-632.
[14] Zhuge Y P,Zhang X D,Liu Q.Effect of long-term fertilization on respiration process of mollisols.Chinese Journal of Soil Science,2005,6(3):391-394.
[15] Berg B.Litter decomposition and organic matter turnover in northern forest soils.Forest Ecology and Management,2000,133(1/2):13-22.
[16] Chen X L,Zhou J B,Liu J L,Gao Z X,Yang X Y.Effects of fertilization on carbon/nitrogen ratio of maize straw and its mineralization in soil.Chinese Journal of Applied Ecology,2009,20(2):314-319.
[17] Saetre P,Stark J M.Microbial dynamics and carbon and nitrogen cycling following re-wetting of soils beneath two semi-arid plant species.Oecologia,2005,142(2):247-260.
[18] Song R,Wu C S,Mou JM,Jiang Y,Guo JX.Effects of maize stubble remaining in field on dynamics of soil microbial biomass Cand soil enzyme activities.Chinese Journal of Applied Ecology,2002,13(3):303-306.
[19] Wang SP,Zhou G S,Jiang Y M,Wang M H,Jiang Y,Liu X Y.Effect of corn stalk and stubble remained in field on soil biochemical factors.Journal of Jilin Agricultural University,2002,24(6):54-57.
[20] Haynes R J.Labile organic matter as an indicator of organic matter quality in arable and pastoral soils in New Zealand.Soil Biology and Biochemistry,2000,32(2):211-219.
[21] Kalbitz K,Solinger S,Park JH,Michalzik B,Matzner E.Controls on the dynamics of dissolved organic matter in soils:a review.Soil Science,2000,165(4):277-304.
[22] Zhao M X,Karsten K,Zhou J B.Variation of content and structural characteristics of dissolved organic carbon and nitrogen in soluble organic matter during mineralization of several soils in the loess region.Acta Pedologica Sinica,2008,45(3):476-484.
[23] Zhang JJ,Dou S,Jiang Y,Li C L,Ping L F.Dynamic changes of organic carbon contents in soil during period of decomposition of corn stalks.Journal of Jilin Agricultural University,2000,22(3):67-72.
[24] Sanaullah M,Chabbi A,Leifeld J,Bardoux G,Billou D,Rumpel C.Decomposition and stabilization of root litter in top-and subsoil horizons:what is the difference?Plant and Soil,2010,338(1/2):127-141.
参考文献:
[1] 刘晶淼,安顺清,廖荣伟,任三学,梁宏.玉米根系在土壤剖面中的分布研究.中国生态农业学报,2009,17(3):517-521.
[2] 张喜英.作物根系与土壤水利用.北京:气象出版社,1999.
[3] 苗惠田,张文菊,吕家珑,黄绍敏,徐明岗.长期施肥对潮土玉米碳含量及分配比例的影响.中国农业科学,2010,43(23):4852-4861.
[4] 王兴礼,任成礼,程其昌,代静玉,姜岩.施用化学肥料对玉米根茬数量的影响.吉林农业大学学报,1990,12(3):55-60.
[5] 易镇邪,王璞,屠乃美.夏播玉米根系分布与含氮量对氮肥类型与施氮量的响应.植物营养与肥料学报,2009,15(1):91-98.
[9] 鲍士旦.土壤农化分析(第三版).北京:中国农业出版社,2005.
[10] 文启孝.土壤有机质研究法.北京:农业出版社,1984:273-281.
[13] 徐江兵,何园球,李成亮,刘晓利,姜灿烂.不同施肥处理红壤生物活性有机碳变化及与有机碳组分的关系.土壤,2007,39(4):627-632.
[14] 诸葛玉平,张旭东,刘启.长期施肥对黑土呼吸过程的影响.土壤通报,2005,6(3):391-394.
[16] 陈兴丽,周建斌,刘建亮,高忠霞,杨学云.不同施肥处理对玉米秸秆碳氮比及其矿化特性的影响.应用生态学报,2009,20(2):314-319.
[18] 宋日,吴春胜,牟金明,姜岩,郭继勋.玉米根茬留田对土壤微生物量碳和酶活性动态变化特征的影响.应用生态学报,2002,13(3):303-306.
[19] 王淑平,周广胜,姜亦梅,王明辉,姜岩,刘孝义.玉米植株残体留田对土壤生化环境因子的影响.吉林农业大学学报,2002,24(6):54-57.
[22] 赵满兴,Karsten K,周建斌.黄土区几种土壤培养过程中可溶性有机碳、氮含量及特性的变化.土壤学报,2008,45(3):476-484.
[23] 张晋京,窦森,江源,李翠兰,平立凤.玉米秸秆分解期间土壤中有机碳数量的动态变化研究.吉林农业大学学报,2000,22(3):67-72.

