低温胁迫时间对4种幼苗生理生化及光合特性的影响
邵怡若,许建新,,薛 立,* ,张 柔,吴彩琼,卢广超
(1.华南农业大学林学院,广州 510642;2.深圳市铁汉生态环境股份有限公司,深圳 518040)
低温影响植物生长发育、生理和光合特性[1]。植物在长期适应低温胁迫过程中,逐步形成独特的生理生化特性,例如积累渗透物质,叶绿素含量、抗氧化酶系统发生变化[[2],调整光合特性[1]。因此,生理和光合指标成为评价植物抗寒性的重要指标[3]。
近年来,随着城镇化的快速发展,人类大量消耗石材资源形成了许多矿山废弃地。矿山废弃地缺少表土以及地表植被,直接暴露于光照之下,蒸发加强,温度变化剧烈,冬季低温通过改变色素组成,降低叶绿素荧光以及损害叶绿体发育[4]而影响植物的光合[5],限制植物的定居[6],因而寒害成为采矿石废弃地植被恢复的主要环境胁迫之一。因此,研究低温对矿山植被恢复植物的生理和光合特性影响具有重要的价值。盐肤木(Rhus chinensis)、假连翘(Duranta repens)、老鸭嘴(Thunbergia grandiflora)、葛藤(Pueraria lobota)是热带、亚热带地区重要的矿山植被恢复植物,但是鲜有对这4种植物抗寒性研究的报道。本研究以这4种植物幼苗为研究对象,人工模拟低温环境,从叶绿素、渗透调节物质、抗氧化酶系统和光合特性等方面比较研究了它们的耐寒性强弱,以期为矿山废弃地的植被恢复提供科学依据。
1 研究方法
1.1 试验材料
本试验在华南农业大学林学院三楼进行。以来自深圳市林科院种苗示范基地的1年生盐肤木、假连翘、老鸭嘴和葛藤的实生容器苗为材料,营养袋直径9 cm,高9 cm,基质用林下表土与黄心土,比例3∶7。幼苗的基本情况见表1。
1.2 试验方法
每种植物选生长良好和长势基本一致的容器苗24株,移入RXZ智能型人工气候箱进行低温处理(自然生长为对照)。光照时间设为8:00—17:00,光照强度为120μmol·m-2·s-1,相对湿度保持在80%—85%。以30℃为对照,进行第0 h测定。人工气候箱以6℃/h降温,幼苗在气候箱内经历约4 h降至(6.0±0.5)℃,保持该温度为处理温度。在第0、24、48、72小时以及恢复48 h(R)(低温解除)时进行各项指标测定。

表1 4种幼苗的基本情况(平均值±标准差)Table1 Characteristics of seedlings of four examined plant species(mean±SD)
1.3 样品采集
采样时间为8:00,以从植株顶芽开始的第3—8片完全展开叶为供试材料,用蒸馏水擦净表面污物,将叶片剪碎、混合均匀后,进行不同生理指标测定,每个指标做3个重复。
1.4 生理指标的测定
生理生化指标 叶绿素含量的测定用分光光度法,脯氨酸含量的测定用酸性茚三酮法,SOD活性的测定用氯化硝基四氮唑蓝(NBT)光化还原法,MDA含量的测定用硫代巴比妥酸比色法(TBA)[7],可溶性蛋白质含量的测定用考马斯亮蓝法[8],可溶性糖含量的测定用蒽酮比色法[9]。
光合指标 选择每株幼苗的第3位至第8位功能叶(6枚叶片)挂牌标记,于早晨9:00—12:00采用美国Li-Cor公司生产的Li-6400便携式光合系统分析仪测定幼苗叶片的净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)、蒸腾速率(Tr),每枚叶片测定3次。测定条件:叶室温度控制在20—25℃,光强为1000 μmol·m-2·s-1,CO2浓度为400μmol/mol,流速为500μmol/s。
1.5 数据分析与处理
数据统计分析和作图由Excel和SAS8.1软件系统完成。用Duncan多重比较检验同一幼苗在不同处理时间后差异显著性,检验显著性水平为0.05。
主成分分析法能够较少损失原有信息的前提下,将原来个数较多且彼此相关的指标转换成新的个数较少且彼此独立的综合指标[10]。按下列公式对各指标数值进行标准化,
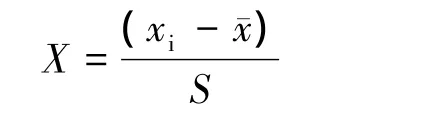
式中,X为标准化后所得数据,xi为某项指标的原始数据,¯x为某项指标的平均值。对标准化后的数据进行主成分分析。以累积贡献率达85%以上为参考值,确定主成分个数。因主成分之间相互独立且有着不同的贡献率,所以每个主成分得分是其加权值,其中权重是主成分对应的贡献率,由主成分的特征向量计算出每种幼苗的主成分得分[11-12]。本研究运用主成分计算各个抗寒指标的得分,按得分多少评定各植物的抗寒能力。
2 结果分析
2.1 不同低温胁迫时间对幼苗生理生化指标的影响
2.1.1 不同低温胁迫时间对幼苗叶绿素含量的影响
低温胁迫处理期间,盐肤木、老鸭嘴和葛藤幼苗的叶绿素含量持续下降,低温24 h时分别下降为对照的96.4%、87.2%和 96.3%,低温72 h时分别下降为对照的71.0%、57.3%和73.0%,均显著小于后者(P<0.05)(图1)。假连翘幼苗的叶绿素含量先升后降,低温24 h时上升为对照的134.0%,低温72 h时比对照显著下降了13.6%(P<0.05)。4种幼苗恢复48 h时的叶绿素含量均显著大于低温72 h时的值(P<0.05)(图1)。
2.1.2 不同低温胁迫时间对幼苗脯氨酸含量的影响
随低温胁迫时间的延长,盐肤木和假连翘幼苗的脯氨酸含量均持续上升,在低温72 h时与对照相比显著上升了38.6%和42.8%(P<0.05)(图2)。老鸭嘴幼苗的脯氨酸含量下降后趋于平稳,低温72 h时显著小于对照(P<0.05)。葛藤幼苗的脯氨酸含量上升后趋于平稳。4种幼苗恢复48 h时的脯氨酸含量与低温72 h时相比均无显著差异。
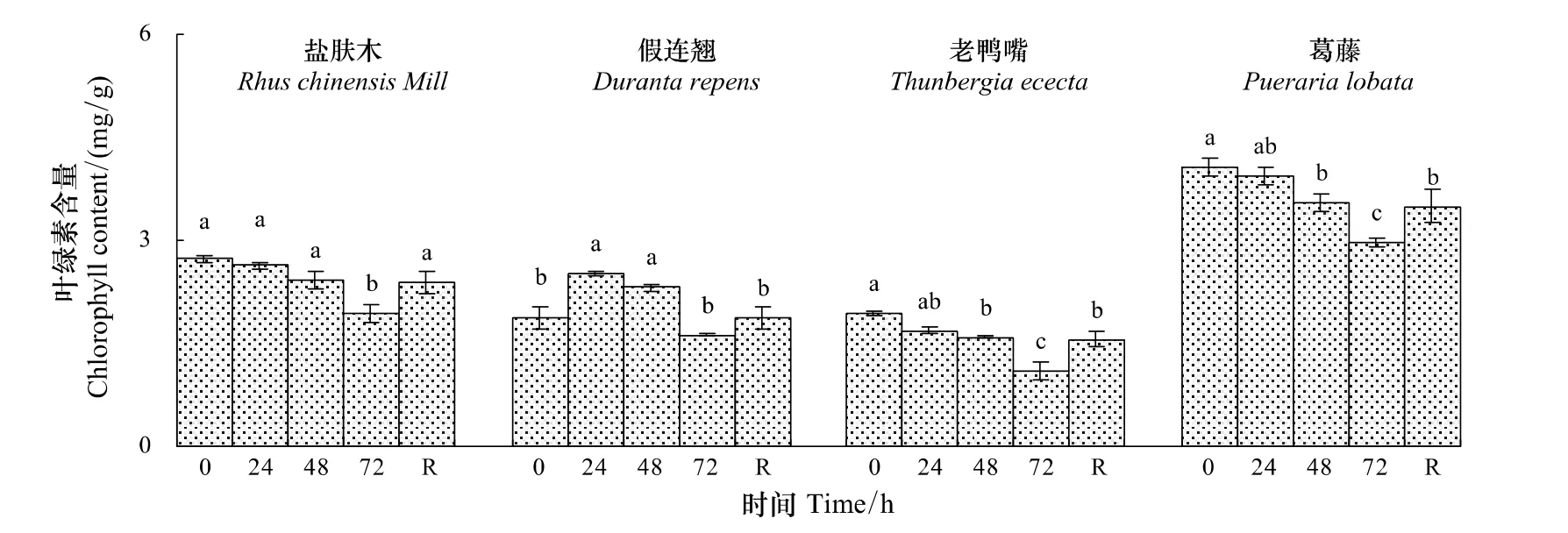
图1 低温胁迫下对幼苗叶片叶绿素含量的影响Fig.1 Effect of low temperature stress on the chlorophyll content in seedling leaves of the examined plants
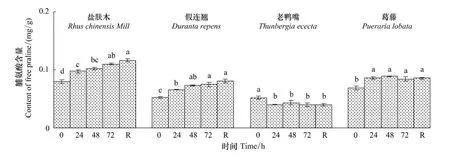
图2 低温胁迫下对幼苗叶片脯氨酸含量的影响Fig.2 Effect of low temperature stress on the content of free proline in seedling leaves of the examined plants
2.1.3 不同低温胁迫时间对幼苗可溶性蛋白质含量的影响
随低温胁迫时间的延长,盐肤木、假连翘、老鸭嘴幼苗叶片的可溶性蛋白质含量均显著上升(P<0.05),在低温72 h时分别为对照的219.4%,271.6%和228.7%。葛藤幼苗叶片的可溶性蛋白质含量先升后降,在低温72 h时为对照的160.3%。恢复48 h时,葛藤幼苗叶片的可溶性蛋白质含量与低温72 h时相比有所降低,其余幼苗有所增加(图3)。
2.1.4 不同低温胁迫时间对幼苗可溶性糖含量的影响
随低温胁迫时间的延长,盐肤木叶片的可溶性糖含量显著上升后小幅波动,其余幼苗持续增加。盐肤木、假连翘、老鸭嘴和葛藤幼苗叶片的可溶性糖含量在低温72 h时分别增加167.9%、224.0%、196.5%和124.0%(图4)。恢复48 h时与连续低温72 h时相比盐肤木和老鸭嘴幼苗的可溶性糖含量有所上升,其余幼苗有所下降。
2.1.5 不同低温胁迫时间对幼苗丙二醛含量的影响
低温胁迫处理期间,4种幼苗的丙二醛(MDA)含量均持续上升,盐肤木增幅较小,在低温72 h时增幅为66.4%,假连翘、老鸭嘴和葛藤的增幅分别为112.7%、161.4%、165.2%(图5)。恢复48 h时,4种幼苗的MDA含量与低温72 h时相比,盐肤木和假连翘的MDA含量有所下降,老鸭嘴和葛藤有所上升。
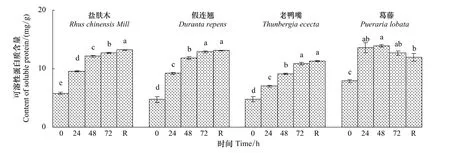
图3 低温胁迫下对幼苗叶片可溶性蛋白质含量的影响Fig.3 Effect of low temperature stress on the content of soluble protein in seedling leaves of the examined plants
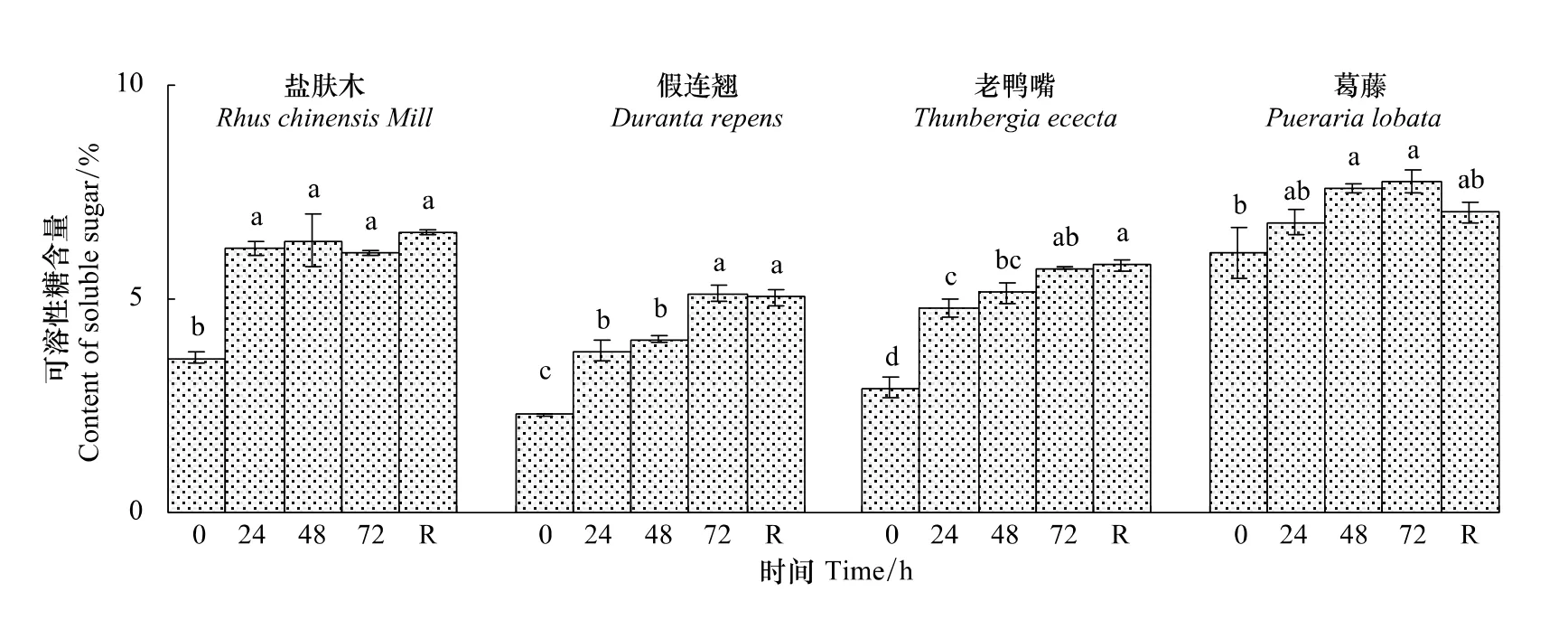
图4 低温胁迫下对幼苗叶片可溶性糖含量的影响Fig.4 Effect of low temperature stress on the content of soluble sugar in seedling leaves of the examined plants
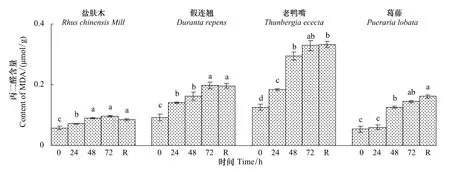
图5 低温胁迫下对幼苗叶片丙二醛含量的影响Fig.5 Effect of low temperature stress on the content of MDA in seedling leaves of the examined plants
2.1.6 不同低温胁迫时间对幼苗SOD活性的影响
低温胁迫处理期间,盐肤木和老鸭嘴幼苗叶片的SOD活性先升后降,在低温72 h时分别降至对照的133.7%和144.9%,而假连翘和葛藤持续上升,在低温72 h时分别增至对照的148.8%和123.9%(图6)。恢复48 h时,盐肤木幼苗的SOD活性比低温72 h时略有上升,其余幼苗的SOD活性下降显著(P<0.05)。
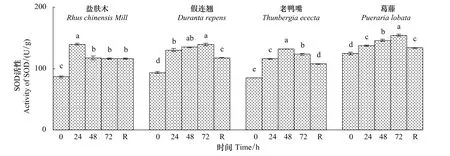
图6 低温胁迫下对幼苗叶片SOD含量的影响Fig.6 Effect of low temperature stress on the activity of SOD in seedling leaves of the examined plants
2.2 不同低温胁迫时间对幼苗光合特性的影响
2.2.1 不同低温胁迫时间对幼苗净光合速率(Pn)的影响
随低温胁迫时间的延长,4种幼苗的Pn持续下降,经72 h低温处理时,盐肤木、假连翘、老鸭嘴和葛藤分别下降到对照的13.3%、18.5%、3.8%和2.9%。恢复48 h时假连翘的Pn与低温72 h时相比略有回升,其余幼苗显著回升(P<0.05)(图7)。
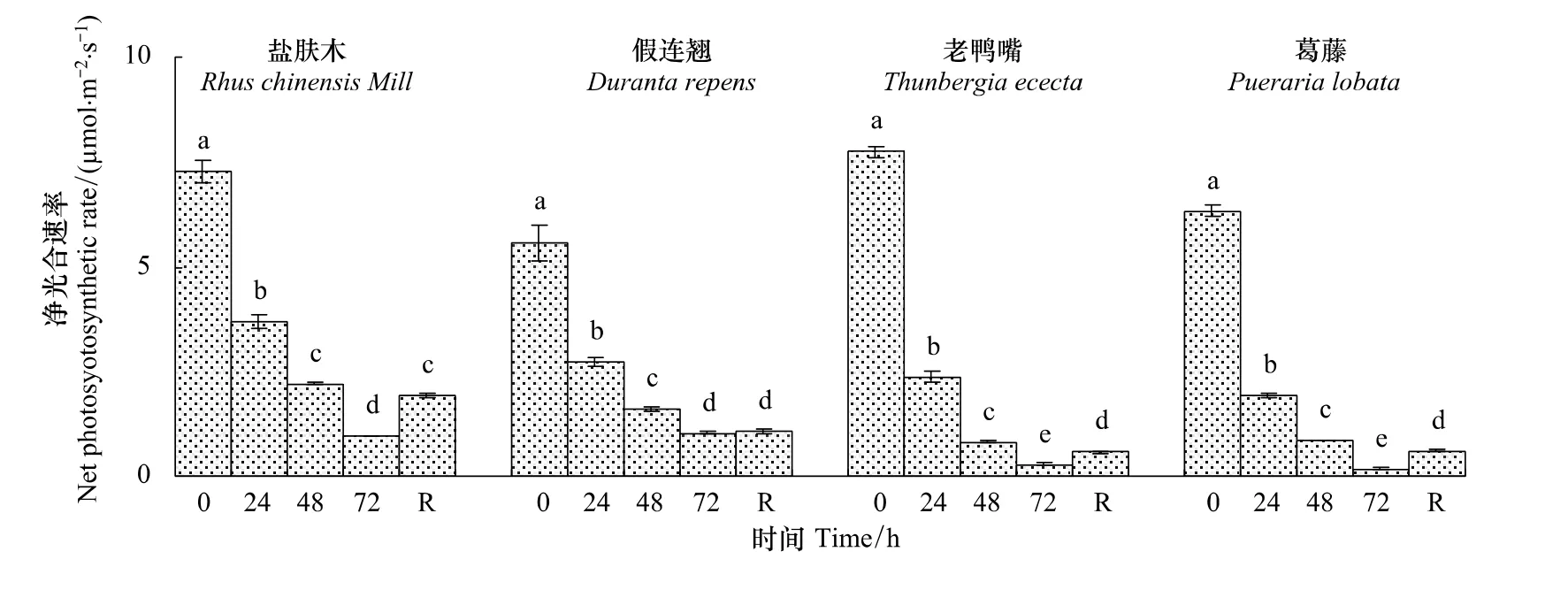
图7 低温胁迫下对幼苗叶片净光合速率(P n)的影响Fig.7 Effect of low temperature stress on the net photosynthetic rate(P n)in seedling leaves of the examined plants
2.2.2 不同低温胁迫时间对幼苗气孔导度(Gs)的影响
随低温胁迫时间的延长,4种幼苗的Gs持续下降,低温72 h时盐肤木、假连翘、老鸭嘴和葛藤幼苗的Gs分别下降到对照的3.3%、7.1%、2.3%和1.8%。恢复48 h时假连翘和老鸭嘴的Gs与低温72 h时相比有所回升,盐肤木和葛藤显著回升(P<0.05)(图8)。
2.2.3 不同低温胁迫时间对幼苗胞间CO2浓度(Ci)的影响
随低温胁迫时间的延长,除假连翘幼苗的Ci持续上升外,其余幼苗均先下降后上升。低温72 h时,盐肤木、假连翘、老鸭嘴和葛藤幼苗的Ci分别上升为对照的101.1%、152.3%、151.2%和131.3%。恢复48 h时4种幼苗的Ci均显著小于低温72 h的值(P<0.05)(图9)。
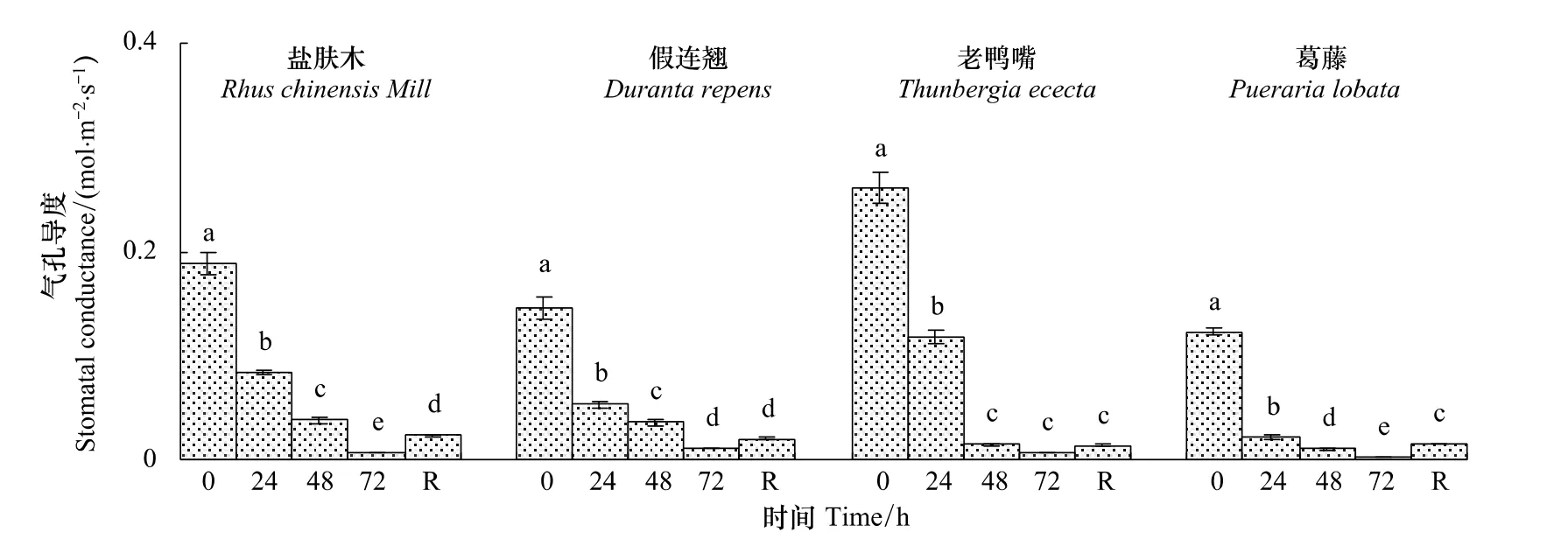
图8 低温胁迫下对幼苗叶片气孔导度(G s)的影响Fig.8 Effect of low temperature stress on the stomatal conductance(G s)in seedling leaves of the examined plants
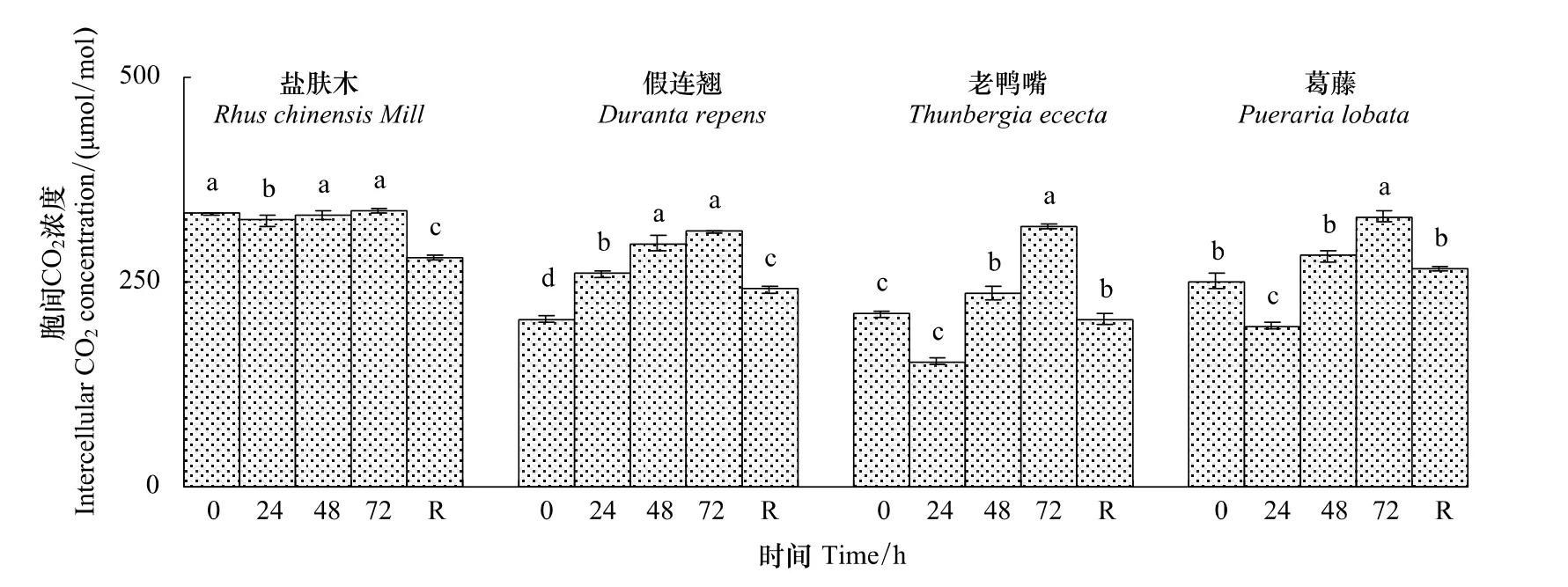
图9 低温胁迫下对幼苗叶片胞间CO2浓度(C i)的影响Fig.9 Effect of low temperature stress on the Intercellular CO2 concentration(C i)in seedling leaves of the examined plants
2.2.4 不同低温胁迫时间对幼苗叶片蒸腾速率(Tr)的影响
随低温胁迫时间的延长,4种幼苗的Tr显著下降,低温72 h时盐肤木、假连翘、老鸭嘴和葛藤幼苗的Tr分别下降为对照的16.6%、24.1%、13.2%和9.0%,恢复 48 h 时均显著回升(P<0.05)(图10)。
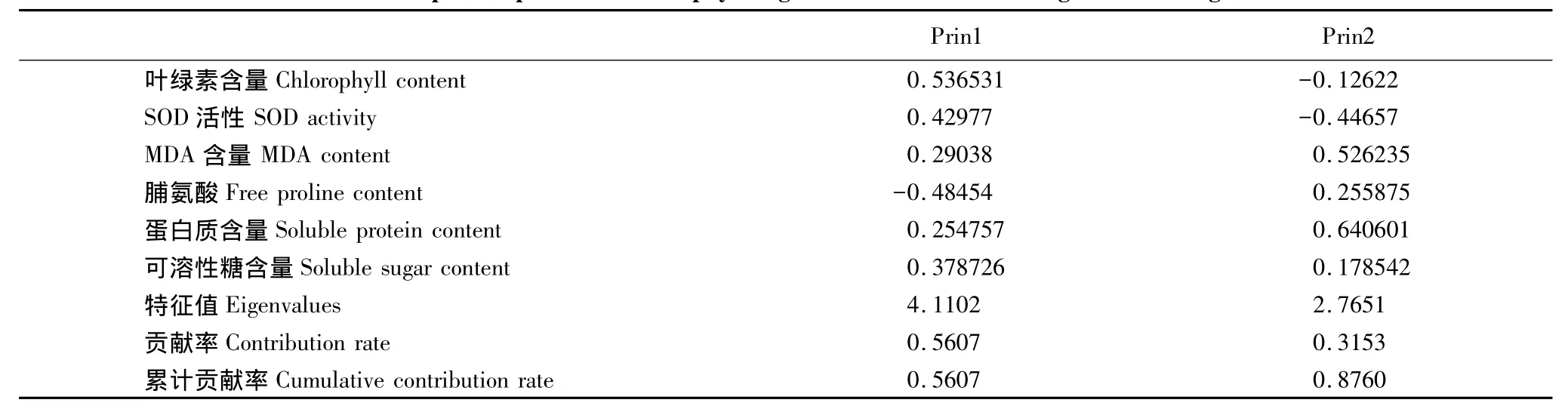
表2 低温胁迫幼苗的生理指标主成分分析Table2 Principal component result of physiological indicators for seedlings under drought stress
2.3 抗寒性综合评价结果
对4种幼苗低温胁迫的生理指标进行主成分分析,结果如表2。低温胁迫下前2个主成分的方差累计贡献率达到87.6%,故前2个主成分足够描述植物低温胁迫下的情况。由表2可知,第1主成分中叶绿素和脯氨酸系数较大,说明二者是反映低温胁迫最重要的生理指标。
根据生理指标的数据,由主成分的特征向量计算出4种幼苗的生理指标得分,表明4种幼苗的抗寒性为葛藤>盐肤木>老鸭嘴>假连翘(表3)。
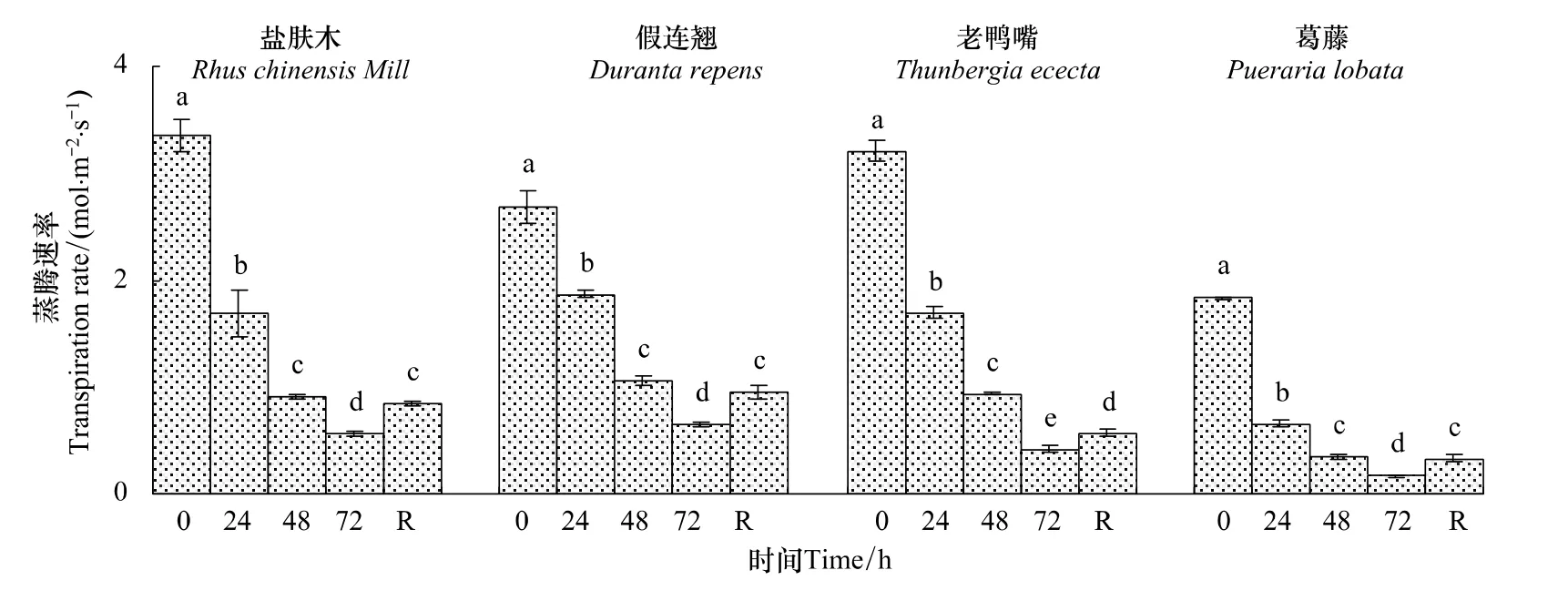
图10 低温胁迫下对幼苗叶片蒸腾速率(T r)的影响Fig.10 Effect of low temperature stress on the transpiration rate(T r)in seedling leaves of the examined plants

表3 低温胁迫下4种幼苗的生理生化指标得分Table3 Cold resistance scores of four species seedlings under low temperature
表4列出4种幼苗低温胁迫的光合指标主成分分析。低温胁迫下前2个主成分的方差累计贡献率达到91.85%,故采用前2个主成分。由表4可知,第1主成分中Pn和Tr的系数较大,说明二者是反映低温胁迫最重要的光合指标。
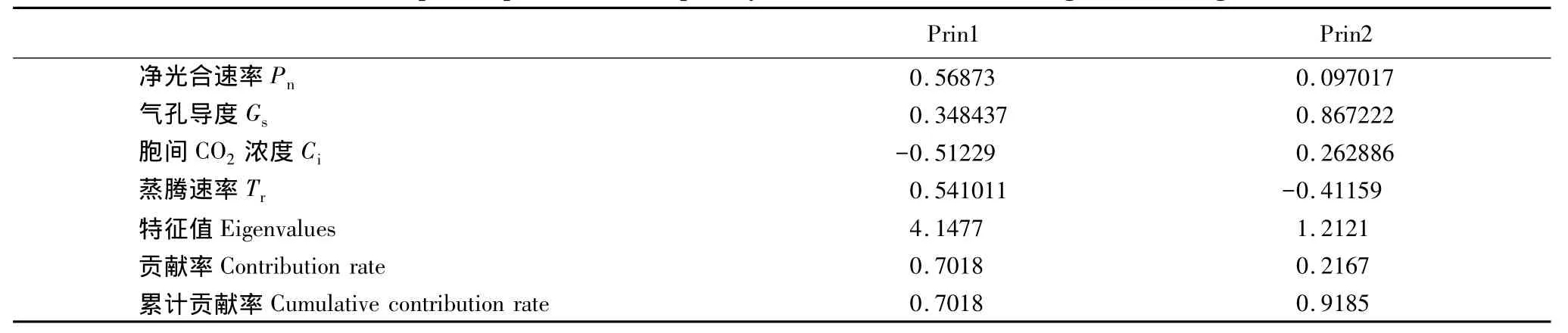
表4 低温胁迫幼苗的光合指标主成分分析Table4 Principal component result of photosynthetic indicators for seedlings under drought stress
根据光合生理指标的数据,由主成分的特征向量计算出4种幼苗的光合生理得分(表5),表明4种幼苗的抗寒性为葛藤>盐肤木>老鸭嘴>假连翘。

表5 低温胁迫下4种幼苗光合指标得分Table5 Cold resistance scores of four species seedlings under low temperature
3 结论与讨论
3.1 幼苗抗寒性与叶片生理生化指标
3.1.1 幼苗抗寒性与叶片叶绿素含量
温度影响叶绿素合成,进而植物的光合和生长。本研究低温处理的假连翘幼苗假叶片的叶绿素含量上升后下降,其余幼苗叶片的叶绿素含量持续下降。解除低温胁迫恢复48 h时4种幼苗的叶绿素含量均显著增加,这与光合速率的变化一致,说明解除低温胁迫后叶绿体色素合成有所恢复,光合作用加强。大部分植物在低温胁迫下叶绿素含量降低,一方面可能是叶绿体色素合成酶活性降低,叶绿体合成受阻而造成;另一方面也可能是低温引起了叶绿体功能的紊乱[13],或加速了叶绿素的分解和叶绿体形态结构的受损使植物叶片内含量减少[14]。此外,低温使植物体代谢缓慢,合成叶绿素的原料不足,也可能会造成叶绿素含量减少[15]。
3.1.2 幼苗抗寒性与叶片的渗透调节物质含量
植物体内游离脯氨酸是细胞质重要的渗透调节物质,可以降低质膜受冻害的程度[16]。在各低温胁迫阶段除了老鸭嘴幼苗的脯氨酸含量低于对照之外,其余幼苗均大于对照,这有利于缓解低温对植株造成的伤害。
可溶性蛋白质的吸水性很强,有助于提高细胞内的束缚水,降低冰点,减少原生质内结冰而伤害致死的机会[17]。本研究的葛藤幼苗的可溶性蛋白质含量上升后相对稳定,其余幼苗的可溶性蛋白质含量均呈上升趋势,有利于抗寒。
可溶性糖是理想的渗透调节物质,可以缓解逆境对膜系统的伤害[18]。在低温胁迫下,盐肤木幼苗的可溶性糖含量上升后保持稳定,其余幼苗持续上升,可以加大细胞的原生质浓度,增强细胞液的流动性而起到抗脱水的作用,有利于抗冷性的增加。在低温胁迫解除后,盐肤木和老鸭嘴幼苗的可溶性糖含量有不同幅度的增加,说明其对低温有较强的适应性。
3.1.3 幼苗抗寒性与叶片MDA含量和SOD活性
低温胁迫破坏细胞内活性氧代谢平衡被而产生活性氧,造成细胞膜系统的损害,引发或加剧膜质过氧化的作用,最终产物主要为丙二醛[19]。本研究结果表明,随低温胁迫时间的延长,4种幼苗的MDA含量都呈增加趋势,其中盐肤木和葛藤在低温胁迫24 h时增幅小,说明这两种幼苗低温胁迫初期的膜脂过氧化程度弱,表现出较强的抗寒性。恢复48 h时,4种幼苗的MDA含量与低温72 h时相比无显著差异,说明在解除低温胁迫后,幼苗的细胞膜脂过氧化程度变化不大。
SOD是植物重要的耐冷保护酶系统[20]。与对照相比,4种幼苗在受到低温胁迫24 h时,SOD活性都有不同程度的上升,说明幼苗细胞内活性氧含量超出了正常水平,促发细胞内SOD活性增强,其活性的上升说明在低温胁迫下其清除自由基的能力增强。在降温初期幼苗对低温具有一定的防御反应,来减缓细胞内多余的自由基对细胞伤害的速度与程度,是4种幼苗对低温胁迫的适应性反应。随着低温胁迫时间的延长,假连翘的SOD活性保持稳定,葛藤持续增加,说明低温没有减弱假连翘,特别是葛藤的清除自由基的能力,有利于这些幼苗的抗寒。
3.2 幼苗抗寒性与叶片光合特性指标变化
净光合速率是光合系统功能的直接体现,也是植株光合系统工作正常与否的指标[21]。气孔是植物与大气进行水汽和CO2交换的通道,影响着植物的光合与蒸腾。随低温胁迫的延长,4种幼苗的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)均持续下降,假连翘的Ci持续上升,其余幼苗均先下降后上升。4种幼苗的Pn降低有利于抗冻。低温胁迫期间,假连翘幼苗的Gs持续下降,且Ci持续上升,所以其Pn下降主要有非气孔因素引起。其余3种幼苗的Gs持续下降,Ci先降后升,其Pn前期下降的原因主要是气孔因素,Gs的下降限制了外界CO2通过气孔进入细胞间隙,导致光合速率下降,后期转变为非气孔因素[22]。从光合生理指标来看,假连翘幼苗的抗寒性最差,其他3种幼苗较强。恢复48 h时Pn、Gs和T r均有不同程度的回升,Ci有不同程度的下降,说明4种幼苗均有一定的抗寒能力。
综上所述,幼苗抗寒性是受渗透调节物质和保护酶活性等共同调节的。低温4种幼苗的脯氨酸、可溶性糖、可溶性蛋白质含量的增加和SOD活性的稳定或增加,减轻了幼苗叶片细胞,特别是葛藤和盐肤木叶片细胞的膜脂过氧化程度,维持了细胞膜的完整性,减轻了低温对幼苗的伤害,是幼苗对低温胁迫的适应性反应的重要调节机制。
研究植物抗寒有重要的应用价值[3]。从生理生化指标和光合生理指标的主成分得分可知,4种幼苗的抗寒性均为葛藤>盐肤木>老鸭嘴>假连翘,这一结果可为采矿石废弃地植被恢复植物的筛选提供科学依据。幼苗定居后,通过凋落物和根系分泌物来增加有机质[23-24]和有效养分,减轻水蚀和风蚀的形成和程度,减少土壤养分的流失,改善土壤特性[25],促进植被的生长和植被覆盖度的增加,从而营造一个植物群落环境,加速群落内养分的累积和其它种类的入侵,从而促进物种丰富度的不断增加。
[1] Guo SH,Xue L,Zhang R,Yang Z Y.Photosynthetic response of four species seedlings to low temperature stress.Journal of South China Agricultural University,2012,33(3):373-377.
[2] He Y J,Xue L,Ren X R,Cao H,Liang L L,Xu Yan.Effects of low temperature stress on physiological characteristics of six tree species seedlings.Chinese Journal of Ecology,2008,27(4):524-531.
[3] Xu Y,Xue L,Qu M.Physiological and ecological mechanisms of plant adaptation to low temperature.Scientia Silvae Sinica,2007,43(4):88-94.
[4] Farooq M,Aziz T,Wahid A,Lee D J,Siddique KHM.Chilling tolerance in maize:agronomic and physiological approaches.Crop and Pasture Science,2009,60(6):501-516
[5] Zhu X C,Song F B,Xu H W.Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis.Plant and Soil,2010,331(1/2):129-137
[6] Yang Z Y,Xue L,Xu J X.Advances in ecology restoration of abandoned quarries.Acta Ecologica Sinica,2012,32(16):5264-5274.
[7] Chen J X,Wang X F.Guideline of Experiments in Plant Physiology.Guangzhou:South China University of Technology Press,2002:31-32,117-120.
[8] Gao JF.Guideline of Experiments in Plant Physiology.Beijing:Higher Education Press,2006:142-143
[9] Li H S.Principle and technology on physiological and bio-chemical test of plant.Beijing:Higher Education Press,2000:195-197.
[10] Wang SG,Wang Z L,Wang P,Wang H W,Li F,Huang W,Wu Y G,Yin Y P.Evaluation of wheat freezing resistance based on the responses of the physiological indices to low temperature stress.Acta Ecologica Sinica,2011,31(4):1064-1072.
[11] Feng H F,Xue L,Ren X R,Fu JD,Zheng W G,Shi X L.Physiological responses of four broadleaved seedlings to drought stress simulated by PEG.Acta Ecologica Sinica,2011,31(2):371-382.
[12] Tan X H,Gao Y P,Guo X P,Zhao T N,Wang L.Physiological characteristics and comprehensive evaluation of drought resistance in five plants used for roadside ecological restoration.Acta Ecologica Sinica,2012,32(16):5076-5086.
[13] Wang Y,Yang H F,Li SD.Studies on chilling injury and cold hardiness of horticultural crops:a literature review.Acta Horticulturae Sinica,1994,21(3):239-244.
[14] Liang L H,Mei X,Lin F,Xia J,Liu SJ,Wang JH.Effect of low temperature stress on tissue structure and physiological index of cashew young leaves.Ecology and Environmental Sciences,2009,18(l):317-320.
[15] Wang C G,Wang X,Cang J,Yang L J.Effect of low temperature stress on cold resistance ability of rice seedlings.Journal of Northeast Agricultural University,2004,35(2):205-207.
[16] He B,Chen Q B,Pan Y Z,L iu Y G.Research on physiology characteristic performance of several euphorbia pulcherrima Willd.cultivars under low temperature stress.Journal of Sichuan Agricultural University,2004,22(4):332-334,360.
[17] Gao Y,Qi X H,Yang J H,Zheng M F.The response mechanism of cold stress in higher plants.Northern Horticulture,2007(10):58-61.
[18] Yin C X,Yao R X,Qiao A M.The response to cold stress and evaluation of cold resistance of five cassava varieties.Guangdong Agricultural Sciences,2012,11:30-33.
[19] Chen SY.Injury of membrane lipid peroxidation to plant cell.Plant Physiology Communications,1991,27(2):84-90.
[20] Liu H Y,Zhu ZJ,Lu GH.Effect of low temperature stress on chilling tolerance and protective system against active oxygen of grafted watermelon.Chinese Journal of Applied Ecology,2004,15(4):659-662.
[21] Zhou J,Yang L F,Hao F G,You Y.Photosynthesis and chlorophyll-fluorescence of Magnolia grandiflora seedlings under low temperature stress.Acta Bot.Boreal.-Occident.Sin,2009,29(1):0136-0142.
[22] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33(3):317-345.
[23] An Z S,Zhan J,Sun Q Y.Changes of nitrogen components in wastelands of copper mine tailings with the formation of natural plant communities.Acta Ecologica Sinica,2010,30(21):5958-5966.
[24] Li Y,Chen M L.Effects of the inhabitation by Hippochaete ramosissimum on heavy metal speciations and enzyme activities in copper mine tailing soil.Acta Ecologica Sinica,2010,30(21):5949-5957.
[25] Xue S,Liu G B,Dai Q H,Wei W,Hou X L.Evolution of soil microbial biomass in the restoration process of artificial Robinia pseudoacacia under erosion environment.Acta Ecologica Sinica,2007,27(6):909-917.
参考文献:
[1] 郭淑红,薛立,张柔,杨振意.4种幼苗对低温胁迫的光合生理响应.华南农业大学学报,2012,33(3):373-377.
[2] 何跃君,薛立,任向荣,曹鹤,梁丽丽,徐燕.低温胁迫对六种幼苗生理特性的影响.生态学杂志,2008,27(4):524-531.
[3] 徐燕,薛立,屈明.植物抗寒性的生理生态学机制研究进展.林业科学,2007,43(4):88-94.
[6] 杨振意,薛立,许建新.采石场废弃地的生态恢复研究进展.生态学报,2012,32(16):5264-5274.
[7] 陈建勋,王晓峰.植物生理学实验指导.广州:华南理工大学出版社,2002:31-32,117-120.
[8] 高俊风.植物生理学实验指导.北京:高等教育出版社,2006:142-143.
[9] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:195-197.
[10] 王树刚,王振林,王平,王海伟,李府,黄玮,武玉国,尹燕枰.不同小麦品种对低温胁迫的反应及抗冻性评价.生态学报,2011,31(4):1064-1072.
[11] 冯慧芳,薛立,任向荣,傅静丹,郑卫国,史小玲.4种阔叶苗木对PEG模拟干旱的生理响应.生态学报,2011,31(2):371-382.
[12] 谭雪红,高艳鹏,郭小平,赵廷宁,王亮.五种高速公路边坡绿化植物的生理特性及抗旱性综合评价.生态学报,2012,32(16):5076-5086.
[13] 王毅,杨宏福,李树德.园艺植物冷害和抗冷性的研究——文献综述.园艺学报,1994,21(3):239-244.
[14] 梁李宏,梅新,林锋,夏军,刘术金,王金辉.低温胁迫对腰果幼苗叶片组织结构和生理指标的影响.生态环境学报,2009,18(l):317-320.
[15] 王晨光,王希,苍晶,杨丽娟.低温胁迫对水稻幼苗抗冷性的影响.东北农业大学学报,2004,35(2):205-207.
[16] 何兵,陈其兵,潘远智,刘应高.几个一品红品种低温胁迫的生理特性研究.四川农业大学学报,2004,22(4):332-334,360.
[17] 高媛,齐晓花,杨景华,张明方.高等植物对低温胁迫的响应研究.北方园艺,2007,(10):58-61
[18] 尹彩霞,尧瑞霞,乔爱民.5个木薯品种对低温胁迫的响应及其抗寒性评价.广东农业科学,2012,11:30-33.
[19] 陈少裕.膜脂过氧化对植物细胞的伤害.植物生理学通讯,1991,27(2):84-90.
[20] 刘慧英,朱祝军,吕国华.低温胁迫对嫁接西瓜耐冷性和活性氧清除系统的影响应用.应用生态学报,2004,15(4):659-662.
[21] 周建,杨立峰,郝峰鸽,尤扬.低温胁迫对广玉兰幼苗光合及叶绿素荧光特性的影响.西北植物学报,2009,29(1):0136-0142.
[23] 安宗胜,詹婧,孙庆业.自然植物群落形成过程中铜尾矿废弃地氮素组分的变化.生态学报,2010,30(21):5958-5966.
[24] 李影,陈明林.节节草生长对铜尾矿砂重金属形态转化和土壤酶活性的影响.生态学报,2010,30(21):5949-5957.
[25] 薛萐,刘国彬,戴全厚,卫伟,侯喜禄.侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征.生态学报,2007,27(6):909-917.

