RNA干扰沉默信号转导和转录激活因子3对类风湿关节炎成纤维样滑膜细胞增殖的影响
王亚媛,高 薇,王 燕,冯 欣
类风湿关节炎 (rheumatoid arthritis,RA)是一种慢性炎症性疾病,以滑膜增生和外周关节对称性、侵蚀性关节炎为主要特征,是一种慢性系统性自身免疫性疾病。RA早期主要表现为关节的红肿热痛以及功能障碍,最终可能会导致关节的畸形甚至患者的残疾。它不仅患病率高,而且致残率亦高,是造成人群劳动力丧失的主要疾病之一。其病因与发病机制,即在RA中炎症和关节损害是如何发展和慢性持续的仍旧是未知的。但是已经有相关研究表明信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)在RA的发病过程中会有持续表达,造成滑膜的持续性炎症。然而目前尚无理想的治疗手段,因此进一步寻找治疗RA的有效方法是亟待解决的难题。
本实验通过构建靶向STAT3的小干扰RNA(small interfering RNA,siRNA)转染进入人RA成纤维样滑膜细胞 (fibroblast-like synoviocytes,FLS),从而观察FLS的一系列生理变化、转染的效率及其抑制率,从而为下一步实施动物造模实验提供理论依据,进一步揭示STAT3在RA发病中的作用,为未来RA的基因治疗奠定基础。
1 材料与方法
1.1 滑膜组织 本实验用的滑膜组织由辽宁医学院附属第一医院骨关节科提供,患者为2012年2—12月行关节镜滑膜切除的RA患者,诊断均符合1987年美国风湿病学会 (ARA)修订的RA的诊断标准。术前获得患者知情同意。
1.2 主要试剂 DMEM高糖培养基和胎牛血清购自Hyclone公司;Ⅱ型胶原酶和胰蛋白酶均购自Sigma公司;Trizol和LipofectamineTM2000转染试剂盒均购自美国Invitrogen公司;聚合酶链反应 (PCR)引物合成由上海生工生物工程股份有限公司完成,反转录聚合酶链反应 (RT-PCR)试剂盒购自宝生物工程 (大连)有限公司;兔抗人STAT3抗体、羊抗兔抗体(二抗)均购自Santa Cruz公司;靶向STAT3的siRNA干扰质粒由上海吉凯基因化学技术有限公司设计构建,共有3个干扰靶序列,分别为 stat3-siRNA-1:5'-TGACCAACAATCCCAAGAA-3';stat3-siRNA-2:5'-ACAATCTACGAAGAATCAA-3';stat3-siRNA-3:5'-TGAAATCATCATGGGCTAT -3'。
1.3 方法
1.3.1 RA FLS的培养 在无菌条件下取滑膜组织,用磷酸盐缓冲液 (PBS)反复冲洗4~5次以去除血污,剔除周围的脂肪组织。然后用眼科剪子将滑膜组织切割为1~2 mm3的小块,用Ⅱ型胶原酶终浓度为0.4%的DMEM培养基,于37℃5%二氧化碳 (CO2)培养箱中孵育消化2 h,然后以1 000 r/min(离心半径为13.8 cm)离心5 min,收集细胞,弃掉上清液,加入0.25%胰蛋白酶4 ml,再于37℃ 5%CO2培养箱中消化30 min。用200目纱网过滤后离心,弃上清液。用10%胎牛血清-DMEM培养基重悬细胞,移入培养瓶内,置于37℃ 5%CO2培养箱内培养24 h后更换培养液,弃去未贴壁细胞。此时,贴壁的细胞即为原代FLS。待FLS达80%汇合成片时,消化传代,本实验用3~7代的细胞。
1.3.2 siRNA转染细胞 转染前将2×105个FLS接种于96孔培养皿中,待细胞融合达到80%~90%。按照Invitrogen公司的LipofectamineTM2000转染试剂操作说明书进行转染操作。转染后10~12 h换为10%胎牛血清-DMEM培养基。本实验细胞分为5组:空白组 (正常培养的FLS)、阴性对照组 (即加入空白质粒的FLS)、RNAi-1组、RNAi-2组和RNAi-3组,后3个组均加入靶向siRNA的重组质粒,即stat3-siRNA干扰,分别针对3个不同的靶点。按照分组情况,分别于FLS转染后的24、48、72 h在倒置荧光显微镜下观察转染细胞绿色荧光的表达,按发生绿色荧光的细胞数占细胞总数的比例来估计其转染效率。
1.3.3 转染后RT-PCR检测靶基因的mRNA表达水平 根据STAT3的3个等位基因同源区设计其引物,上游为5'-CTACAGTGACAGCTTCCCAATG -3',下游为5'-TTGGCTTCTCAAGATACCTGCT-3',扩增产物长度为233 bp。用 Trizol提取各组细胞总RNA,按RT-PCR试剂盒说明,取RNA样品进行反转录以及PCR扩增。PCR产物经2%琼脂糖凝胶电泳后使用凝胶成像系统进行条带分析,测出各组表达率 (即各条带的灰度值/β-actin条带灰度值×100%),然后计算抑制率(抑制率 =1-表达率)。反应条件为:94℃预变性5 min;94℃变性50 s;54℃退火50 s;72℃延伸1 min;扩增34个循环;最后72℃延伸8 min。取反应液5 μl进行电泳。
1.3.4 免疫印迹 (Western blotting)法检测干扰后STAT3的表达 将细胞裂解,提取各组细胞的总蛋白质,蛋白定量并制样。将样品加入制备好的10%聚丙烯酰胺凝胶 (SDS-PAGE)中,电泳分离蛋白质。分离的蛋白质经电泳转移至聚偏二氟乙烯膜 (PVDF)后,用5%的脱脂奶粉封闭2 h后加入兔抗人STAT3抗体 (1∶500),4℃摇床孵育过夜。洗膜后以1∶1 000稀释的相应的碱性磷酸酶标记的二抗室温孵育2 h,再用TBST洗3次,5 min/次。最后进行增强化学发光法 (ECL)显色,以各组电泳条带的灰度值作为条带的强度指标,内参照β-actin表达条带的灰度值作为标准,二者的比值代表各组STAT3的表达率,然后根据1-表达率得到表达抑制率。
1.3.5 四甲基偶氮唑蓝 (MTT)法检测靶向抑制STAT3对FLS增殖的影响 取对数生长期的人FLS接种于96孔板,每孔104个细胞。每板分3组,每组10孔,共接种5板。第1组为空白组,第2组为阴性对照组,第3组为转染后确定的最佳干扰序列组 (RNAi-1组),即RNAi组。5个板分别于接种后培养24、48、72、96、120 h,每孔加入MTT(5 mg/ml)20 μl,37℃温箱继续孵育4 h,离心后弃去培养基,每孔加入100 μl二甲基亚砜 (DMSO),室温下避光震荡孵育10 min,使结晶充分溶解,用酶标仪测量各孔490 nm处的吸光度 (A)值,间接反映活细胞数量,以此作为观察FLS增殖情况的指标。以时间为横轴、A为纵轴绘制增殖曲线。
1.4 统计学方法 采用SPSS 16.0软件进行统计检验。计量资料以 ((±s)表示,多样本均数比较采用单因素方差分析,组间两两比较采用LSD法。检验水准α=0.05。
2 结果
2.1 stat3-siRNA对RA FLS的转染效率 转染后在倒置荧光显微镜下可以观察到,被转染的细胞有绿色荧光表达,而未被质粒转染的细胞则没有荧光表达。其中在转染48 h时荧光表达较强,转染细胞数量最多,72 h后荧光表达开始减弱。
2.2 转染后STAT3 mRNA的表达情况 RT-PCR分析结果见图1。在转染RA FLS后,空白组、阴性对照组、RNAi-1组、RNAi-2组和RNAi-3组STAT3 mRNA表达抑制率分别为(27.32±2.06)%、 (30.61±2.47)%、 (76.99±2.05)%、(72.75±1.74)%和 (66.50±2.47)%,5组间差异有统计学意义 (F=362.92,P<0.01);其中空白组与阴性对照组STAT3 mRNA表达抑制率间差异无统计学意义 (P=0.094);RNAi-1组、RNAi-2组和RNAi-3组STAT3 mRNA表达抑制率与空白组、阴性对照组比较,差异均有统计学意义 (P<0.05);且3组STAT3 mRNA表达抑制率依次降低,组间两两比较差异有统计学意义 (P<0.05)。
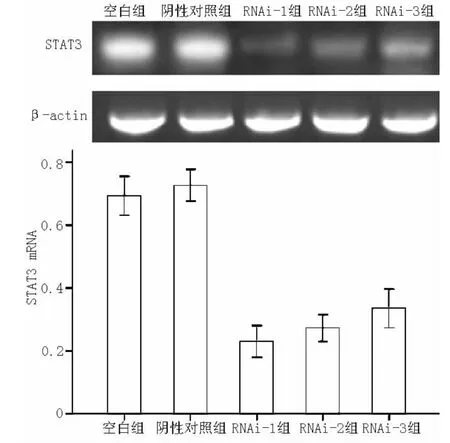
图1 RT-PCR检测转染后各组STAT3 mRNA的表达Figure1 Expression of STAT3 mRNA in each group detected by RT-PCR
2.3 转染后STAT3的表达 Western blotting检测结果见图2,发现STAT3表达水平受到不同程度的抑制,其中空白组、阴性对照组、RNAi-1组、RNAi-2组和RNAi-3组STAT3表达抑制率分别为 (44.35±2.04)%、 (43.10±2.59)%、(83.57±1.56)%、(77.05±0.54)%和 (69.44±2.76)%,5组间差异有统计学意义 (F=248.08,P<0.01);其中空白组、阴性对照组STAT3表达抑制率间差异无统计学意义 (P=0.472);RNAi-1组、RNAi-2组、RNAi-3组 STAT3表达抑制率与空白组、阴性对照组比较,差异均有统计学意义 (P<0.05);且3组STAT3表达抑制率依次降低,组间两两比较差异有统计学意义 (P<0.05)。STAT3的表达与其mRNA的表达情况相符,证明RNAi-1组的干扰效果高于另外两组。故后续实验中所使用的均为RNAi-1组质粒转染过的FLS。
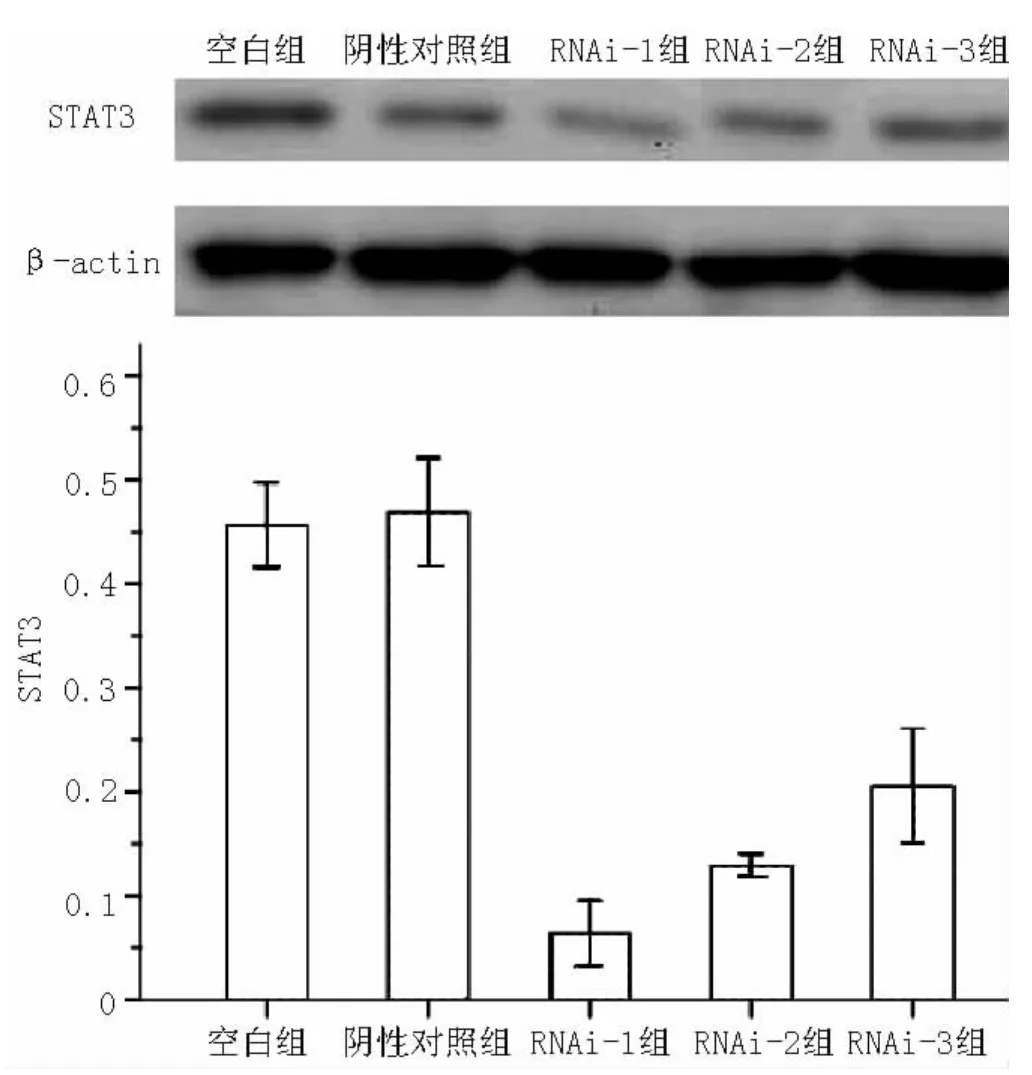
图2 Western blotting检测各组转染后STAT3的表达率Figure2 Expression of STAT3 detected by Western blotting
2.4 靶向抑制STAT3对FLS增殖的影响 经过不同时间点的检测,空白组、阴性对照组以及RNAi组在490 nm处的A值分别为 (0.553 3±0.343 2)、(0.535 0±0.337 3)和 (0.158 3±0.079 4),3组间差异有统计学意义 (F=3.761,P=0.047)。其中空白组A值与阴性对照组比较,差异无统计学意义 (P=0.912);RNAi组A值与空白组、阴性对照组比较,差异均有统计学意义 (P值分别为0.028和0.035,见图3)。
3 讨论
尽管RA的病因以及发病机制尚未完全明确,但是有研究证实细胞因子在RA的发生过程中起到了核心的致病作用。RA患者的滑膜炎症中有重要生物学作用的细胞因子,如γ干扰素 (IFN-γ)、白介素 (IL) -2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-15等均通过JAK-STAT信号转导通路发挥作用[1-2],最终导致FLS增殖与凋亡的失衡。而JAKSTAT通路是一个重要的细胞因子信号转导通路,在调节细胞增殖、分化、凋亡以及免疫调节、炎症、肿瘤等多种病理生理过程中发挥重要的作用。因此,其调控的基因也包括多个方面:凋亡相关基因如Fas、Bcl-2、Bax;炎症相关基因如环氧合酶2(COX -2)、IL-6、IL -8、内皮素 -1[3]、还原型辅酶Ⅱ (NADPH)氧化酶[4]等。然而,许多在RA中表达显著升高的细胞因子,如IL-6、IL-15、粒-巨噬细胞集落刺激因子 (GM-CSF)等都是通过激活JAK-STAT通路中的STAT3来发挥其生物学效应的。而STAT3在FLS的增殖、破骨细胞和Th17细胞的诱导以及RANKL途径的表达中都是必须的[5-7]。在小鼠的胶原诱导关节炎 (CIA)模型中已经证实,IL-6、IL-1、肿瘤坏死因子α(TNF-α)等促炎细胞因子直接或者间接地激活STAT3,最终导致关节的持续性炎症和破坏[8]。由此可见,STAT3在RA的慢性炎症和关节的破坏中都是重要的调节因子。因此,如果能选择性地阻断STAT3的表达,可能会对RA具有潜在的治疗作用。

图3 各组FLS的增殖曲线Figure3 Proliferation curves of FLS in different groups
RNA干扰 (RNA interference,RNAi)技术是近年来备受关注的一个分子生物学技术,是将与某一mRNA序列相对应的正义RNA和反义RNA组成的双链RNA导入到细胞中,使与其同源互补的mRNA降解,抑制细胞特定基因的表达,又称为基因沉默。RNAi具有高效性、特异性、ATP依赖性、位置效应等特点[9]。因此,本实验通过RNAi技术选择性地沉默STAT3,使STAT3的表达受到了抑制,同时也就是阻断了这些炎性递质表达的共同通路。结果显示,RNAi-1组、RNAi-2组、RNAi-3组STAT3 mRNA表达受到了一定的抑制,并且其蛋白质水平的表达也受到了抑制,二者的抑制结果及程度一致。转染后的FLS生长受到了抑制,同时间检测其活细胞的数量明显少于空白组及阴性对照组,生长速度亦较这两组缓慢。由此,可以进一步明确RA的发病机制,同时为RA的基因治疗提供理论基础和实验依据。
由于目前尚无完全满意的治疗RA的方法,而基因治疗是目前治疗RA最具有前景的方法,并且基因治疗的方法在治疗关节炎和相关的关节紊乱中已经有所发展,许多动物实验已经证明其具有很高的疗效性,并且一些临床试验也证明了该法是安全的[10-12]。细胞因子通过其过度表达导致RA的持续性炎症和关节破坏,从而引起了患者身体功能受损以及关节的疼痛,都会使患者的日常生活活动受到限制,生活质量降低。因此,推测通过基因治疗的方法特异性地阻断JAK-STAT通路将能够达到改善RA病理过程的目的,从而改善RA患者的生活质量。未来可以研究针对该通路的特异性拮抗剂或者抑制剂,从而为RA的诊断以及治疗提供新的靶点和研究方向。
1 Dinarello CA,Moldawer LL.Proinflammatory and anti-inflammatory cytokines in rheumatoid arthritis.A primer for clinicians[M].Third edition.Thousand Oaks:Amgen Inc,2003:993-1000.
2 余丽君.类风湿关节炎伴慢性疾病性贫血患者血清白介素1和促红细胞生成素水平及其意义[J].中国全科医学,2012,15(7):2265.
3 Manea SA,Manea A,Heltianu C.Inhibition of JAK/STAT signaling pathway prevents high-glucose-induced increase in endothelin-1 synthesis in human endothelial cells[J].Cell Tissue Res,2010,340(1):71-79.
4 Manea A,Tanase L,Raicu M,et al.Prolactin-induced production of reactive oxygen species and IL-1β in leukocytes from the bony fish gilthead seabream involves Jak/Stat and NF-κB signaling pathways[J].Arterioscler Thromb Vasc Biol,2010,185(7):3873 -3883.
5 Krause A,Scaletta,Ivashkiv LB,et al.Rheumatoid arthritis synoviocyte survival is dependent on Stat3[J].Immunol,2002,169(11):6610-6616.
6 Bishop KA,Meyer MB,Pike JW.A novel distal enhancer mediates cytokine induction of mouse RANKl gene expression[J].Mol Endocrinol,2009,23(12):2095 -2110.
7 Yang XO,Panopoulos AD,Nurieva R,et al.STAT3 regulates cytokine-mediated generation of inflammatory helper T cells[J].J Biol Chem,2007,282(13):9358-9363.
8 Mori T,Miyamoto T,Yoshida H,et al.IL-1β and TNF-ɑ-initiated IL-6-STAT3 pathway is critical in mediating inflammatory cytokines and RANKL expression in inflammatory arthritis[J].International Immunology,2011,23(11):701-712.
9 徐威,詹娜,王鲁文.RNA干扰治疗肝纤维化的实验研究[J].疑难病杂志,2010,9(12):901.
10 Evans CH,Ghivizzani SC,Robbins PD.Gene therapy of the rheumatic diseases:1998 to 2008[J].Arthritis Research and Therapy,2009,11(1):209-210.
11 Robbins PD,Evans CH,Chernajovsky Y.Gene therapy for arthritis[J].Gene Ther,2003,10(10):902 -911.
12 Mountz JD,Chen J,Hsu HC.Rheumatoid arthritis:safe and sound[J].Gene Therapy,2005,12(21):1542 -1543.

