氧化苦参碱对体外培养人膀胱癌T24细胞生长的抑制作用及其机制
李 顺,刘 泉,魏学斌,黄世明,徐留玉,黄生亮,赵庆利,李 青
(山东大学附属千佛山医院,济南 250014)
膀胱癌是泌尿系统最常见的恶性肿瘤之一,手术切除虽可取得较好的近期疗效,但术后复发率高,3~5年内复发率为50% ~70%,并且30% ~40%复发肿瘤恶性程度增高、浸润能力增强。膀胱腔内灌注化疗是当前预防膀胱癌复发最常用的方法,但其常用的化疗药物对癌细胞杀伤缺乏靶向性,毒副作用大,且存在不同程度的多药耐药。因此,寻找高效低毒的灌注药物对提高膀胱肿瘤疗效具有积极意义。近年研究证实,氧化苦参碱(OMT)对体外乳腺癌、胰腺癌等肿瘤细胞有明显的抑制作用[1,2]。2010年6月~2012年6月,我们观察了OMT对体外培养膀胱癌T24细胞生长的抑制作用,并初步探讨其可能机制。现报告如下。
1 材料与方法
1.1 材料 膀胱癌T24细胞,重庆医科大学实验诊断教研室惠赠;OMT,宁夏启元药业有限公司;丝裂霉素 C(MMC),Kyowa Hakko Kogyo Co.Ltd.;RMPI 1640培养液,Gibco公司;四甲基偶氮唑盐(MTT),Sigma公司;蛋白提取试剂盒、SDS-PAGE凝胶试剂盒,碧云天公司;倒置荧光显微镜(Motie,China),酶联免疫分析仪(Techan,Austria),凝胶成像系统(Bio-Rad)。
1.2 方法
1.2.1 人膀胱癌T24细胞培养及实验分组 将T24细胞置于含10%新生小牛血清和双抗RMPI 1640培养液,37℃、5%CO2、饱和湿度的孵育箱内培养。取对数生长期细胞配成4×104/mL悬液,接种于96孔培养板,设8个复孔,接种3板,继续培养24 h。以 OMT 0.625、1.25、2.5、5、10 mg/mL 分为 5个实验组,另设阳性对照组(MMC 20 mg/L)、阴性对照组(不加处理因素)、空白对照组(不加入细胞,其他同实验组),溶剂对照组(生理盐水代替处理因素)。加入不同的处理因素作用24 h后,取出1板加入MTT培养4 h,加入 DMSO 200 μL/孔,振荡溶解。
1.2.2 膀胱癌T24细胞抑制率检测 酶标仪用空白对照组调零,检测波长600 nm处吸光度(OD值),计算细胞存活率和抑制率。存活率=处理组OD值/阴性对照OD值×100%,抑制率=(1-存活率) ×100%。以 OMT 0.625、1.25、2.5、5、10 mg/mL分为5个实验组,作用24、48、72 h后分别取一培养板,测定OMT在24、48、72 h对膀胱癌 T24细胞的抑制率,重复3次。
1.2.3 膀胱癌T24细胞的形态学观察 以 OMT 1.25 mg/mL分为实验组,设立阴性对照组。取膀胱癌T24细胞制备细胞爬片,常规HE染色及瑞氏染色,分别在低倍和高倍镜及油镜下观察细胞形态变化并摄相。6孔培养板分两组(OMT 1.25 mg/mL组、阴性对照组)加入不同处理因素,培养72 h收集细胞。分别加入4%戊二醛、1%锇酸固定,再用乙醇丙酮梯度脱水,618环树脂包埋后超薄切片。经枸橼酸铅染色,透射电镜下观察细胞形态学变化。
1.2.4 流式细胞术(FCM)检测凋亡细胞 将细胞同步化培养24 h,以分为实验组、阴性对照组。实验组加入1.25 mg/mL OMT。再培养72 h收集细胞,1000 r/min离心5 min,弃去上清液,把细胞缓慢加入到-20℃预冷的70%乙醇固定。将等体积的细胞悬液和PI染液混匀,染色30 min。混合液过300目尼龙网。把样品放入FCM的样品室,以激发波长为488 nm测定,并用MODFIT2.0软件分析细胞周期分布及凋亡情况。
1.2.5 Western blot检测 Survivin、Caspase-3 的表达培养瓶培养膀胱癌T24细胞,将OMT按0.625、1.25、2.5 mg/mL 浓度梯度加药于培养瓶中,培养48 h后胰酶消化细胞,取干预后的细胞于EP管。每管加入100 μL细胞裂解液(含PMSF)吹匀。于冰上放置30 min后,4℃ 14000 g离心10 min,取上清并定量,采用BCA法测定蛋白浓度。每管取30 μg总蛋白加入上样缓冲液煮沸 5 min,经 SDS/PAGE凝胶电泳,然后电转移至PVDF膜,5%脱脂奶粉封闭2 h。一抗1∶1000稀释4℃孵育过夜,二抗1∶5000稀释室温孵育2 h后,二氨基联苯胺显色并对结果进行灰度扫描分析。重复实验3次,取平均值。
1.2.6 统计学方法 采用 SPSS10.0统计软件,计量资料以表示,组间比较行方差分析。检验水准 a=0.05。
2 结果
2.1 OMT对T24细胞增殖的抑制作用 见表1。
2.2 细胞形态学观察 1.25 mg/mL OMT作用后,光镜下可见到细胞变为不规则状,体积缩小,胞质浓缩,胞核凝聚,染色质致密聚集成板块状,位于核周膜成新月状,形成凋亡小体(图1A)。电子显微镜下,癌细胞核质比例缩小,胞质浓缩(图1B),核染色质浓缩呈半月形,染色质聚集靠近于核膜周边,进而细胞膜内陷细胞自行分割为多个具有完整膜性结构,内含各种细胞成分的凋亡小体(见图1C)。
2.3 T24细胞凋亡检测结果 FCM分析T24细胞DNA含量,1.25 mg/mL OMT处理组T24细胞与阴性对照组相比,出现G0/G1期阻滞,S期细胞较阴性对照组下降(P <0.05),1.25 mg/mL OMT 处理72 h后,G1期前出现呈特征性的亚二倍峰(凋亡峰)。细胞凋亡率为5.37%。见图2。
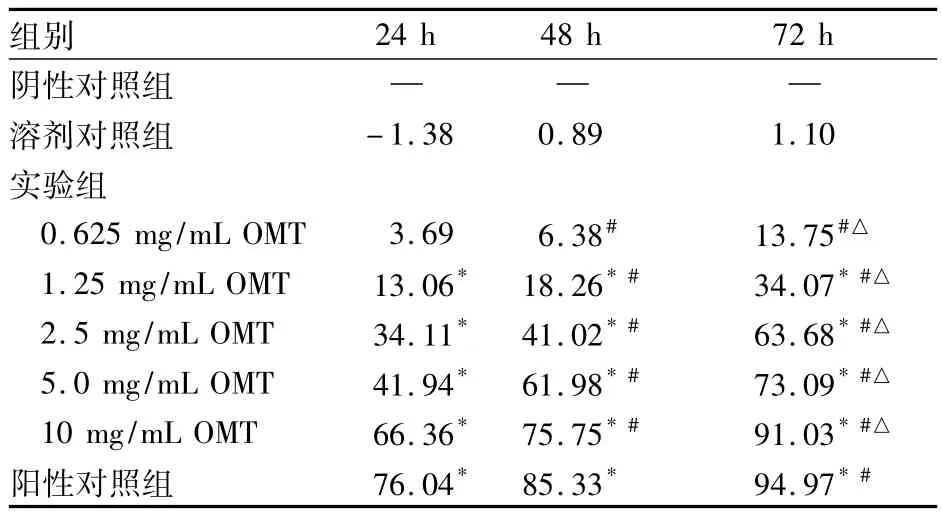
表1 各组不同时间膀胱癌T24细胞增殖抑制情况比较(n=3,%)
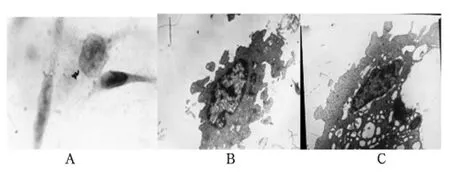
图1 1.25 mg/mL OMT作用后光镜及电镜下细胞形态学观察
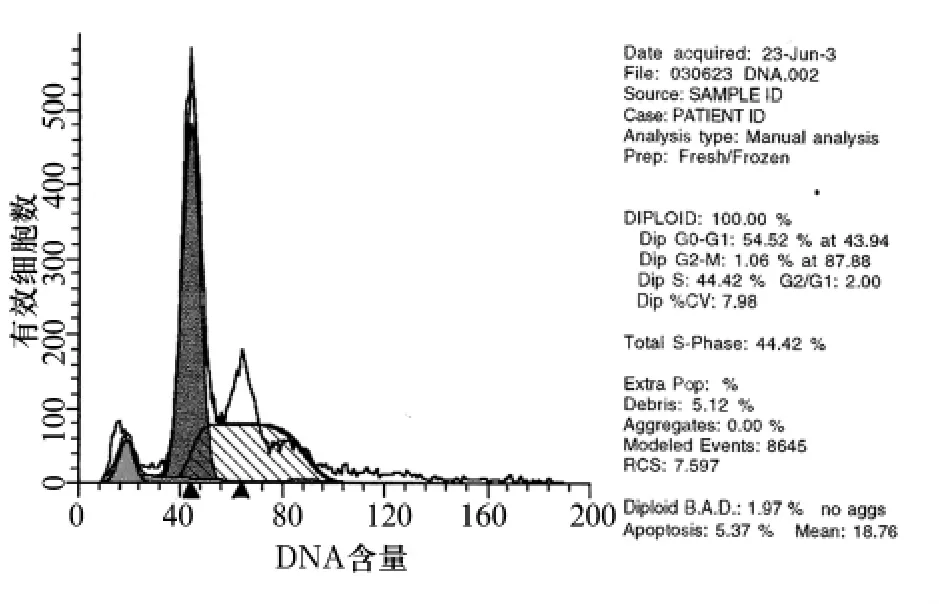
图2 1.25 mg/mL OMT作用72 h后T24细胞周期分布
2.4 各组Survivin、Caspase-3表达比较 见图3、表2。

图3 Caspase-3、Survivin蛋白免疫印迹带灰度
3 讨论
保留膀胱的膀胱癌术后患者,2年内超过半数要复发,并且有恶性程度增加趋势。丝裂霉素C、结核菌素、阿霉素、喜树碱等相继应用于膀胱灌注,但复发率仍居高不下,并且具有不同程度的毒副作用。因此,寻找高效低毒的灌注药物具有广阔的临床应用前景。
表2 各组Survivin、Caspase-3表达比较()

表2 各组Survivin、Caspase-3表达比较()
组别 n Caspase-3 Survivin空白对照组8 0.052 ±0.0018 0.632 ±0.00970.625 mg/mL OMT 组 8 0.084 ±0.0019 0.465 ±0.00751.25 mg/mL OMT 组 8 0.165 ±0.0023 0.257 ±0.00262.5 mg/mL OMT 组 8 0.298 ±0.0087 0.142 ±0.0092 P 0.014 0.008
OMT又名苦参素,分子式为C15H24N2O2·H2O,分子量为282,是从中药苦豆子中提取的一种生物碱。苦豆子,别名苦甘草、苦参草、苦豆根及西豆根,早在《神农本草经》就已载入药,全株味极苦、性寒,具有清热解毒、抗菌消炎作用。近年研究发现,OMT有抗肿瘤作用[3],但国内外尚未见其用于膀胱癌的报道。本研究结果显示,不同浓度OMT随着浓度的增长、作用时间的延长对人膀胱癌T24细胞的抑制率逐渐增强,1.25 mg/mL OMT对人膀胱癌T24细胞的抑制率明显高于阴性对照组、溶剂对照组、0.625 mg/mL OMT 组(P 均 <0.05),≥2.5 mg/mL OMT各组对人膀胱癌T24细胞的抑制率比较差异无统计学意义。1.25 mg/mL OMT作用人膀胱癌T24细胞后,在光镜、电镜下均可见到细胞皱缩,胞质浓缩,胞核凝聚,核染色质浓缩呈半月形,染色质聚集靠近核膜周边,核仁裂解,细胞膜内陷细胞自行分割为多个具有完整膜性结构,内含各种细胞成分的凋亡小体;FCM可见癌细胞株出现典型的调亡峰。提示OMT可以诱导膀胱癌T24细胞的凋亡。
细胞凋亡机制十分复杂,至今尚未完全清楚。近年研究发现,细胞凋亡与凋亡相关蛋白Survivin、Caspase-3表达有关。Survivin基因是新近发现的一种凋亡抑制基因,同时也是迄今发现的作用最强的凋亡抑制因子。膀胱癌组织中Survivin表达量明显高于正常组织中表达,且其表达与膀胱癌患者的临床分期和肿瘤分化程度均有一定相关性,在低分化和临床分期越高的膀胱癌患者中,其表达水平越高[4]。细胞凋亡的发生需激活Caspase。Caspase属于半胱氨酸蛋白酶,具有严格的底物特异性,Caspase-3是细胞凋亡过程中必不可少的蛋白酶,是凋亡发生的直接限速酶,表达的高低决定了凋亡的发生和多少[5,6]。Survivin 蛋白通过 Caspase 通路抑制凋亡,可以直接抑制凋亡终末效应器,干扰Caspase 9的活化及Caspase3、Caspase7,从而阻断各种刺激诱导的细胞凋亡过程。竞争性结合p21-cdk4复合物上的cdk4,释放的p21与Caspase 3形成复合物,抑制Caspase 3的活性,从而间接抑制细胞凋亡。提示Survivin基因可通过多重途径抑制凋亡,促进肿瘤的形成[7,8]。本研究结果显示,随着 OMT浓度升高,Caspase-3蛋白表达显著增高,Survivin蛋白表达显著下降,并且呈一定的剂量依赖性。提示OMT能明显抑制T24膀胱癌细胞增殖,诱导凋亡,其诱导凋亡机制与抑制Survivin蛋白表达,提高Caspase-3在的表达有关,但其确切机制还有待进一步研究。
综上所述,OMT对体外培养人膀胱癌T24细胞生长有强烈的抑制作用,其机制可能与抑制Survivin表达、上调Caspase-3表达等诱导细胞凋亡有关。
[1]Ling Q,Xu X,Wei X,et al.Oxymatrine induces human pancreatic cancer PANC-1 cells apoptosis via regulating expression of Bcl-2 and IAP families,and releasing of cytochrome c[J].J Exp Clin Cancer Res,2011,30:66.
[2]Zhang Y,Piao B,Zhang Y,et al.Oxymatrine diminishes the side population and inhibits the expression of β-catenin in MCF-7 breastcancer cells[J].Med Oncol,2011,28(Suppl 1):S99-S107.
[3]李顺,张毅,黄世明,等.苦参素对膀胱癌T24细胞影响的研究[J].山东医药,2007,47(8):29-30.
[4]Al-Azayzih A,Gao F,Goc A,et al.TGFβ1 induces apoptosis in invasive prostate cancer and bladder cancer cells via Akt-independent,p38 MAPK and JNK/SAPK-mediated activation of caspases[J].Biochem Biophys Res Commun,2012,427(1):165-170.
[5]Kunze D,Kraemer K,Erdmann K,et al.Simultaneous siRNA-mediated knockdown of antiapoptotic BCL2,Bcl-xL,XIAP and survivin in bladder cancer cells[J].Int J Oncol,2012,doi:10.3892/ijo.2012.1549.[Epub ahead of print]
[6]Zheng QY,Jin FS,Yao C,et al.Ursolic acid-induced AMP-activated protein kinase(AMPK)activation contributes to growth inhibition and apoptosis in human bladder cancer T24 cells[J].Biochem Biophys Res Commun,2012,419(4):741-747.
[7]Lin X,Wu G,Huo WQ,et al.Resveratrol induces apoptosis associated with mitochondrial dysfunction in bladder carcinoma cells[J].Int J Urol,2012,19(8):757-764.
[8]Kawata N,Tsuchiya N,Horikawa Y,et al.Two survivin polymorphisms are cooperatively associated with bladder cancer susceptibility[J].Int J Cancer,2011,129(8):1872-1880.

