医院内鲍曼不动杆菌感染分布特征及其耐药机制
李 娟,郝邯生,王 悦,张利娟
(1天津医科大学研究生院,天津 300070;2武警后勤学院附属医院;3天津医科大第二医院)
鲍曼不动杆菌(Ab)是院内感染的重要条件致病菌[1],近年来临床Ab分离率逐渐增高,耐药性不断加强,并出现多重耐药、泛耐药菌株,给临床治疗带来一定困难[2]。Ab可以具有多种耐药机制,如产生药物钝化酶或修饰酶、改变药物作用靶点、外膜蛋白缺失或外排泵高表达等[3]。整合子[4]作为可移动遗传元件一直是科研人员关注的重点,它可以捕获、整合并表达外源基因,在细菌耐药、多重耐药演进中扮演重要的角色。本研究以分离自天津市某三级医院住院患者的Ab为实验对象,分析其院内感染分布特征和耐药性,并对部分收集自重症监护病房(ICU)的Ab携带Ⅰ类整合子情况进行了研究。现报告如下。
1 材料与方法
1.1 菌株来源 选择2010年7月~2011年6月在天津市某三级医院住院患者分离出的Ab 616株(去除重复菌株),所有菌株由 MicroScan WalkAway-96SI全自动微生物分析仪进行菌种鉴定。随机选取其中收集自ICU的57株检测Ⅰ类整合子。质控菌株大肠埃希菌 ATCC25922、铜绿假单胞菌ATCC27853为该院保存。
1.2 方法
1.2.1 Ab抗菌药物敏感试验 带有菌液的鉴定药敏板放入MicroScan WalkAway-96SI全自动微生物分析仪,24 h后仪器会自动报告菌株及其药敏情况。头孢哌酮/舒巴坦和多粘菌素B药敏实验采用纸片扩散法(Kirby-Bauer)。
1.2.2 整合子基因检测 ①细菌DNA的提取及基因检测:采用煮沸法[5]提取细菌DNA,-20℃保存。②PCR检测菌株中Ⅰ类整合酶基因、Ⅰ类整合子可变区,志贺菌N5经测序证实携带Ⅰ类整合子,为本实验的阳性对照。反应总体系 25 μL:TaKaRa Premix Taq 12.5 μL,上下游引物各 1 μL,DNA 模板2 μL,加入无菌去离子水至25 μL。Ⅰ类整合酶基因的引物序列为:上游引物:5'-ACATGTGATGGCGACGCACGA-3',下游引物:5'-ATTTCGGTCCTGGCTGGCGA-3',目的片段为569 bp,PCR反应条件:94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,30 个循环,72℃ 5 min;Ⅰ类整合子可变区的引物序列为:上游引物:5'-GGCATCCAAGCAGCAAG-3',下游引物:5'-AAGCAGACTTGACCTGA-3',目的片段大小可变,PCR反应条件:94℃ 5 min,94℃ 45 s,53℃35 s,72 ℃ 2 min,35 个循环,72 ℃ 5 min。③PCR产物测序:各选2株片段大小一致的可变区PCR产物送上海英骏生物工程公司测序,结果在GenBank中用BLAST程序进行比对,以确定可变区的基因盒类型及排列顺序。
1.2.3 统计学方法 采用WHONET5.4统计软件,ICU和非ICU来源的Ab的耐药率比较采用χ2检验,整合子阳性、阴性Ab的耐药率比较采用Fisher确切概率法。P≤0.05为差异有统计学意义。
2 结果
2.1 菌株来源 616株Ab中,来自呼吸道标本512株(83.1%)、伤口脓液标本 34 株(5.5%)、血液标本20株(3.2%)、胸腹水和其他无菌体液标本13株(2.1%)、脑脊液标本 6 株(1.0%),其他标本 31株(5.0%)。
2.2 科室分布 616株 Ab中,来自 ICU 412株(66.9%),包括脑系科 ICU 269 株(43.7%)、综合ICU 143 株(23.2%);非 ICU 204 株(33.1%),包括脑系科 62 株(10.1%)、呼吸科29 株(4.7%)、烧伤科27株(4.4%)、其他内科 54 株(8.8%)和其他外科32 株(5.2%)。
2.3 Ab对各类抗菌药的耐药性情况 616株Ab中,均对多粘菌素B不耐药,其次分别为头孢哌酮/舒巴坦 85株(13.8%)、左氧氟沙星 282株(45.8%)、氨苄西林/舒巴坦 339 株(55.0%)、复方新诺明 395株(64.1%)、头孢他啶 395株(64.1%)、阿米卡星396 株(64.3%)、头孢曲松 397株(64.4%)、头孢噻肟 408 株(66.2%)、环丙沙星413 株(67.0%)、亚胺培南 431 株(70.0%)、妥布霉素 435株(70.6%)、替卡西林/棒酸 436株(70.8%)、庆大霉素443 株(71.9%)、头孢吡肟 471株(76.5%)、哌拉西林472 株(76.6%)。多重耐药Ab的检出率为76.5%(471/616)。
2.4 ICU与非ICU Ab耐药情况比较 见表1。
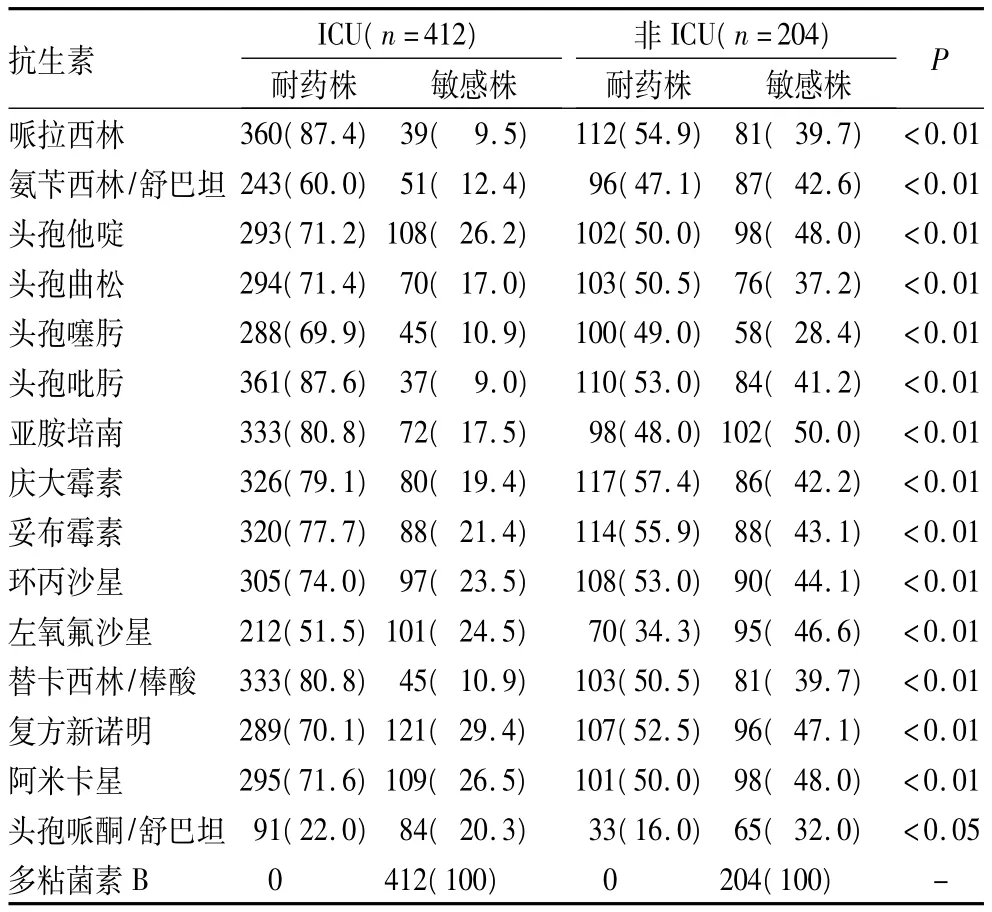
表1 ICU与非ICU Ab耐药情况比较[株(%)]
2.5 基因检测及序列分析结果 57株Ab中,Ⅰ类整合酶阳性43株(75.4%),可变区阳性39株(阳性率为68.4%)。34株检测出大小为2310 bp的产物,经BLAST比对,所含的耐药基因盒为 aacA4-catB8-aadA1;5株检出2470 bp的产物,经BLAST比对显示所含的耐药基因盒为aacC1-orfA-orfB-aadA1。见图 1、2。

图1 Ⅰ类整合酶基因扩增结果

图2 Ⅰ类整合子可变区扩增结果
2.6 ICU来源的AbⅠ类整合子阳性株与阴性株耐药情况比较 Ab对多粘菌素B均敏感,不纳入比较范围。具体结果见表2。

表2 Ⅰ类整合子阳性与阴性Ab耐药率比较[株(%)]
3 讨论
Ab广泛分布于土壤、水、医院环境,并易在住院患者皮肤、口腔、呼吸道、胃肠道及泌尿生殖道等部位定植。Ab被认为是一种低毒力病原菌[6,7],对其毒力因子的研究目前还处于初级阶段,它主要引起免疫力低下患者(尤其是重症监护病房患者)呼吸机相关性肺炎、败血症、继发性脑膜炎、外科手术部位感染等[8,9]。该菌强大的环境适应能力及快速获得耐药性的能力使其极易引起医院内感染的暴发流行,给临床工作者带来很大的困扰。对Ab进行耐药性监测,及时掌握该菌院内感染的分布情况,对指导临床合理使用抗生素及防控院内感染流行意义重大[10]。本研究发现,该院Ab耐药、多重耐药情况十分严重。检测的16种抗菌药物中,Ab对13种药物的耐药率均在55.0%以上,其中包括对碳青霉烯类—亚胺培南耐药。未发现对多粘菌素B耐药的菌株,Ab对头孢哌酮/舒巴坦的耐药率为13.8%,提示临床医生仍可以将其作为对抗Ab的一线用药。在分离的616株Ab中,呼吸道标本占83.1%,远高于其他类型标本,且主要集中在 ICU病房(66.9%),说明Ab可以引起住院患者(尤其是住ICU患者)呼吸道的细菌感染或定植,与院内获得性呼吸系统感染及呼吸机相关性肺炎关系密切。
整合子由 Stokes等[11]首次提出,定位于染色体、质粒或转座子上,它由5'保守区(5'CS)、3'保守区(3'CS)和两者之间的可变区组成。5'CS是整合子的基本结构,包括编码整合酶的基因、整合子重组位点和整合子可变区启动子;可变区含有一个或多个耐药基因盒;3'CS包括qacEΔ1和sul1,介导季铵盐类化合物和磺胺类药物的耐药。根据整合酶基因序列的不同,可将整合子分为6类,其中以Ⅰ类整合子最为常见[12]。研究表明,Ⅰ类整合子普遍存在于临床上分离的革兰阴性菌中,介导细菌对氨基糖苷类、β-内酰胺类、氯霉素等抗菌药物的耐药[13,14]。本次监测的Ab主要分离自ICU,且ICU来源的Ab耐药率明显高于非ICU来源的Ab,故随机收集了ICU来源的57株Ab,研究Ⅰ类整合子与其耐药的关系。研究发现,57株Ab中75.4%携带Ⅰ类整合子,68.4%可变区携带耐药基因盒,且本组Ab可变区阳性株中87.2%携带aacA4-catB8-aadA1形式的耐药基因盒,推断该院ICU病房内可能存在Ab克隆株的水平传播。Ⅰ类整合子所携带的耐药基因aacA4编码对阿米卡星、奈替米星、妥布霉素耐药,aadA1编码对壮观霉素、链霉素的耐药性,aacC1编码对庆大霉素的耐药性,catB8编码对氯霉素耐药。从分子生物学角度上来看,该院ICU来源的Ab中Ⅰ类整合子主要介导该菌对氨基糖苷类、氯霉素和磺胺类耐药,但是通过对耐药表型的分析比较发现,Ⅰ类整合子阳性株对左氧氟沙星、环丙沙星、哌拉西林、头孢吡肟等抗菌药物的耐药率也高于Ⅰ类整合子阴性株,我们认为在Ab中可能存在与Ⅰ类整合子密切相关的其他耐药机制,如Ⅰ类整合子下游连接了可以携带耐药基因的ISCR1元件等等,有待于进一步研究。
[1]陈东科,崔巧珍,胡云建.医院内不动杆菌流行现状及耐药性分析[J].中华流行病学杂志,2003,24(7):640-641.
[2]Le Hello S,Falcot V,Lacassin F,et al.Molecular epidemiology of carbapenem-resistant Acinetobacter baumannii in New Caledonia[J].Clin Microbiol Infect,2008,14(10):977-981.
[3]Zavascki AP,Carvalhaes CG,Picao RC,et al.Multidrug-resistant Pseudomonas aeruginosa and Acinetobacter banmannii:resistance mechanisms and implications for therapy[J].Expert Rev Anti Infect Ther,2010,8(1):71-93.
[4]Labbate M,Case RJ,Stokes HW.The integron/gene cassette system:an active player in bacterial adaptation[J].Methods Mol Biol,2009,532:103-125.
[5]Pitout JD,Thomson KS,Hanson ND,et al.Plasmid-mediated resistance to expanded-spectrum cephalosporins among Entetobacter aerogenes strains[J].Antimicrob Agents Chemother,1998,42(3):596-600.
[6]Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(2):538-582.
[7]Gordon NC,Wareham DW.Multidrug-resistant Acinetobacter baumannii:mechanisms of virulence and resistance[J].Int J Antimicrob Agents,2010,35(3):219-226.
[8]Munoz-Price LS,weinstein RA.Acinetobacter infection[J].N Engl J Med,2008,358(12):1271-1281.
[9]Maragakis LL,Perl TM.Acinetobacter baumannii:epidemiology,antimicrobial resistance,and treatment options[J].Clin Infect Dis,2008,46(8):1254-1263.
[10]习慧明,徐英春,朱德妹,等.2010年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2012,12(2):98-104.
[11]Stokes HW,Hall RM.A novel family of potentially mobile DNA elements encoding site-specific gene-integration functions:integrons[J].Mol Microbiol,1989,3(12):1669-1683.
[12]Rowe-Magnus DA,Guerout AM,Mazel D.Bacterial resistance evolution by recruitment of super-integron gene cassettes[J].Mol Microbiol,2002,43(6):1657-1669.
[13]Cornaglia G,Giamarellou H,Rossolini GM.Metallo-beta-lactamases:a last frontier for beta-lactams[J].Lancet Infect Dis,2011,11(5):381-393.
[14]Domingues S,Harms K,Fricke WF,et al.Natural transformation facilitates transfer of transposons,integrons and gene cassettes between bacterial species[J].PLoS Pathog,2012,8(8):e1002837.

