miRNA-17对靶基因整合素受体β8的调控表达作用
王福军,蔡军,刘岩,顾松,张希涛,安向光,颜均,高杰,苏丕雄
(首都医科大学附属朝阳医院,北京 100020)
miRNA是一类存在于真核生物中内源性非编码小分子RNA,参与基因转录后水平的调控;它通过与靶基因序列的3'非翻译区(3'UTR)以碱基互补配对的方式来执行对靶基因转录翻译抑制功能,从而调控基因的表达[1]。miRNA-17~92家族与心血管疾病的发生密切相关[2],能促进肺脏细胞起源和心脏分隔作用的发生。整合素(ITG)是细胞表面的异二聚体受体,包含α和β两种亚型,它们通过与细胞外基质配体结合,使细胞内效应器发生变化,最终引起病理生理变化。ITG表达与心血管疾病的发生、发展有着紧密关系[3],ITG的上调会导致心律失常和心肌收缩功能障碍[4]。有文献指出,ITG受体β8(ITG-β8)和配体蛋白4.1B结合共同调控胚胎心脏的发育[5]。但是,有关ITG-β8与心血管疾病的发生机制尚不清楚。2011年3月~2012年12月,我们就miRNA-17与ITG-β8的调控抑制关系进行了研究。
1 材料与方法
1.1 材料 ①主要试剂:HEK293T细胞,Ultrapure Agarose(GIBCOTM美国);1 ×TAE:0.040 mol/L Tris-Acetate和0.001 mol/L EDTA,pH 7.5;DNA 电泳用6 ×loading buffer:40%Ficoll,0.06%溴酚兰,培养液(GIBCOTMnvitrogen,美国),胎牛血清(中国医学科学院血液病研究所);消化液:含有0.25%胰蛋白酶的0.02%的 EDTA,无血清培养基(GIBCOTMInvitrogen,美国),LipofectamineTM2000 Reagent(Invitrogen公司,美国),引物合成(华大基因,北京),RNAsin(Promega,美国);细胞裂解液:25 mmol/L Tris-HCl、pH 7.5,150 mmol/L NaCl,0.5%NP-40,0.5 mmol/L PMSF,0.5%protease inhibitor cocktail。②主要仪器:水浴恒温箱(DK-8)(上海精宏实验设备有限公司),水平电泳槽(北京市六一仪器厂),超净工作台(BCM-8)(苏州净化设备公司),电热恒温孵育箱(DNP-9082)、干燥消毒烤箱(DHG-9246A)(上海精宏实验设备有限公司),紫外分光光度计(美国Bio-tek仪器公司),台式离心机、低温高速离心机(5417C)(德国Eppendorf公司),摇床(TS-1)(海门市其林贝尔仪器公司),CO2孵箱(Thermo Forma美国),荧光定量PCR仪(Bio-Rad iQ5美国),凝胶成像系统(UVP美国),F-4500 fluorescence spectrophotometer(HITACHI日本)。
1.2 方法
1.2.1 细胞培养 取HEK293T细胞置于含10%胎牛血清的RPMIDMEM培养液,在37℃、5%CO2孵箱中培养,2~3 d换液,待细胞融合70%~80%时,用0.25%胰酶消化传代,取对数生长期细胞用于后续实验。
1.2.2 靶基因载体的构建 应用生物信息学软件Target Scan、Miranda和 PicTar对 miRNA-17进行靶基因预测。增强型绿色荧光蛋白cDNA用限制性内切酶消化并亚克隆成pcDNA3.1,用人脑的cDNA数据库克隆成含有miRNA-17预测靶点的ITG-β8的3'UTR,即 pcDNA3.1/EGFP,进一步应用 BamHI、EcoRI设计成合适的核苷酸长度。
1.2.3 miRNA-17的真核表达载体的构建 生物学软件预测靶基因序列和已知miRNA-17基因序列见图1、图2。目的片段经过T-A克隆后筛选正确的序列,将其亚克隆到pcDNA3.1(+)上,然后进行酶切鉴定和测序分析其正确性。将构建成功的重组质粒pcDNA3.1(+)-miRNA-17转染HEK293T细胞 ,然后采用实时定量PCR法检测成熟miRNA-17的表达水平。

图1 生物学软件预测靶基因序列
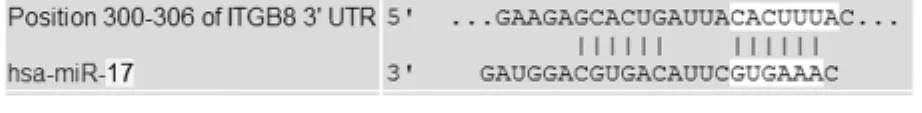
图2 已知miRNA-17基因序列
1.2.4 细胞转染与反义寡核苷酸技术 细胞常规培养于含10%胎牛血清培养基中,37℃、5%CO2,每2~3 d用0.25%胰酶消化传代培养。将处于对数生长期的细胞消化,以2×105/mL接种至6孔板,继续培养24 h待细胞长至培养板70%融合时转染。转染分为二组,即 ITG-β8+miRNA-17组和 ITG-β8+pcDNA3.1组。为了进一步证实miRNA-17调节抑制ITG-β8的特性,我们又设计合成miRNA-17的反义寡核苷酸序列(ITG-β8+ASO-miRNA-17)组和无义寡核苷酸序列(ITG-β8+ASO-Ctl)组,按照上述基因构建方法分别转染HEK293T细胞。转染后48 h,裂解细胞并提取蛋白。然后利用F-4500 fluorescence spectrophotometer检测各组绿色荧光蛋白的光密度值作为绿色荧光蛋白的相对表达水平。
1.2.5 统计学方法 采用SPSS13.0统计学软件,先对数据进行正态性检验,数据以表示,组间比较采用方差分析及t检验。P≤0.05为有统计学差异。
2 结果
绿色荧光蛋白表达水平:ITG-β8组为12.03±0.02,ITG-β8+miRNA-17 组为 9.33 ±0.04,ITG-β8+pcDNA3.1 组 为 11.04 ±0.09,ITG-β8+ASO-miR-17 组为 13.76 ±0.07,ITG-β8+ASO-Ctl组为11.34 ±0.09。ITG-β8+miRNA-17 组绿色荧光蛋白表达水平较ITG-β8+pcDNA3.1组明显下降(P<0.05),ITG-β8+ASO-miR-17 组绿色荧光蛋白水平与 ITG-β8+pcDNA3.1 组、ITG-β8+ASO-Ctl组比较无统计学差异(P均>0.05)。见图3。双荧光素酶报告基因分析提示,miRNR-17能够特异结合基因的ITG-β83'UTR区域使靶基因的mRNA表达量下降。HEK293T细胞未转染、转染miRNA-17、转染ASO-miNA-17绿色荧光蛋白染色见图4。

图3 各组绿色荧光蛋白表达水平比较

图4 HEK293T细胞转染前后绿色荧光蛋白染色
3 讨论
越来越多的研究发现,miRNA参与多种心血管疾病的发病过程,如心肌肥厚、心衰[6,7]、心律失常、心肌细胞凋亡等[8]。miRNA一般通过与靶基因miRNA 3'UTR的相互作用来调控靶基因的表达水平,尤其是miRNA5'端种子序列与靶基因的匹配程度尤为重要。我们通过网站预测到了miRNA-17可能的靶基因ITG-β8。BLAST数据库比对表明,ITG-β8的3'UTR区确实存在与miRNA-17的5'端相互作用的序列。在荧光报告载体实验中,我们发现miR-17能降低ITG-β83'UTR报告质粒的绿色荧光蛋白的表达水平,但对于ITG-β83'UTR报告空质粒pcDNA3.1-Egfp-ITG-β88-3'UTR 表达绿色荧光蛋白却没有明显影响。说明miRNA-17能够作用于ITG-β83'UTR的特异性序列,是miRNA-17的靶基因。利用反义寡核苷酸技术进一步证实,通过无义序列抑制miRNA-17的方法,可使绿色荧光蛋白恢复原来水平。
ITG是由α和β亚基通过非共价键组成的异二聚体,是细胞表面一类重要的兼具黏附和信号转导功能的受体。α亚单位与配体结合发挥作用,而β亚单位主要介导黏附、连接、信号传导等功能。近年来研究发现,β亚单位的胞质尾通过蛋白质之间的相互连接起到信号传导的枢纽作用[9,10]。ITG是心肌细胞和成纤维细胞与细胞外基质之间相互作用的主要部分,在心脏发育过程中,ITG的模式表达变化表明细胞外基质与特定的ITG之间有协同表达的特点,不同亚单位组合形成的ITG在心肌发育和疾病等生理病理过程中发挥不同的作用。
本研究结果证明,ITG-β8是miR-17的靶基因,反义核酸技术进一步证实miRNA-17可以负性调控靶基因ITG-β8的表达。利用反义寡核苷酸技术开展针对miR-17的靶向治疗,将可能减少先天性心脏病的发生。但是,ITG-β8影响心血管疾病的具体机制尚不清楚,还有待进一步研究阐明。
[1]Ambros V,Lee RC,Lavanway A,et al.MicroRNAs and other tiny endogenous RNAs in C.elegans[J].Curr Biol,2003,13(10):807-818.
[2]Wang J,Greene SB,Bonilla-Claudio M,et al.Bmp signaling regulates myocardial differentiation from cardiac progenitors through a MicroRNA-mediated mechanism[J].Dev Cell,2010,19(6):903-912.
[3]Sun M,Opavsky MA,Stewart DJ,et al.Temporal response and localization of integrins beta1 and beta3 in the heart after myocardial infarction:regulation by cytokines[J].Circulation,2003,107(7):1046-1052.
[4]Valencik ML,Zhang D,Punske B,et al.Integrin activation in the heart:a link between electrical and contractile dysfunction[J].Circ Res,2006,99(12):1403-1410.
[5]Jung Y,Kissil JL,McCarty JH.beta8 integrin and band 4.1B cooperatively regulate morphogenesis of the embryonic heart[J].Dev Dyn,2011,240(1):271-277.
[6]Care A,Catalucci D,Felicetti F,et al.MicroRNA-133 controls cardiac hypertrophy[J].Nat Med,2007,13(5):613-618.
[7]Thum T,Gross C,Fiedler J,et al.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[8]Cheng Y,Liu X,Zhang S,et al.MicroRNA-21 protects against the H(2)O(2)-induced injury on cardiac myocytes via its target gene PDCD4[J].J Mol Cell Cardiol,2009,47(1):5-14.
[9]Humphries JD,Byron A,Bass MD,et al.Proteomic analysis of integrin-associated complexes identifies RCC2 as a dual regulator of Rac1 and Arf6[J].Sci Signal,2009,2(87):ra51.
[10]Shattil SJ,Kim C,Ginsberg MH:The final steps of integrin activation:the end game[J].Nat Rev Mol Cell Biol,2010,11(4):288-300.

