甘氨酸浓度对生姜组培苗氮代谢的影响
廖林正 朱菲菲 刘奕清* 唐建民 陈泽雄
(1重庆文理学院花卉研究所,重庆市特色植物种苗工程技术研究中心,重庆402160;2西南大学园艺园林学院,重庆400716)
氮素对植物生理代谢和生长发育有重要作用,其中有机氮甘氨酸(Glycine)是结构最简单的氨基酸,分子量小,是有机肥及土壤中主导氨基酸之一(Chapin et al.,1993;Nasholm et al.,1998;张青 等,2005;葛体达 等,2008)。在完全无菌水培条件下,番茄能直接吸收甘氨酸(葛体达 等,2009)。也有研究指出,水稻、胡萝卜、大白菜、绿豆等能吸收土壤中的甘氨酸和可溶性有机氮(Matsumoto et al.,2000;Wu et al.,2005)。有关植物有机氮营养生理生化机制方面亦有报道,水稻吸收的氨基酸可能在体内发生转氨基作用而被同化或者是脱氨基后被同化(吴良欢和陶勤南,2000)。研究发现以氨基酸及酰胺态氮形式进入植物的有机氮容易被植物代谢转化(Yamagata & Ae,1999)。
生姜(Zingiber officinaleRosc.)对氮素的需求量较大,氮肥用量直接影响到生姜的品质、产量、经济效益以及对环境的污染等问题。从前人研究来看,目前多集中在研究不同氮素形态对生姜生长或是氮代谢的影响(Behura,2001;Majumdar et al.,2005;Mathai,2006),而有机氮甘氨酸浓度对生姜生长及生理特性的影响研究却鲜见报道。本试验以生姜组培苗为试材,研究甘氨酸浓度对其氮代谢的影响,以期阐述生姜组培继代苗对有机氮的吸收机制,为生姜组培苗氮素调控以及有机氮在生姜组培苗生产上的应用提供理论支持。
1 材料与方法
1.1 材料
试验于2011年10月在重庆市特色植物种苗工程技术研究中心组织培养实验室中进行。以竹根姜专用培养基MG(专利ZL 201010042068.8)为基本培养基,以脱毒培养3代的生长健壮、继代培养20 d、株高4~5 cm的四川竹根姜组培芽团(每芽团有3~4芽)为试验材料。
1.2 方法
将生姜组培芽团分别转接于含不同甘氨酸浓度1.0、1.5、2.0(CK)、2.5、3.0 mg·L-1的MG培养基上进行继代培养,分别作为处理1、2、3(CK)、4、5,对照为MG培养基(正常甘氨酸水平2.0 mg·L-1),每个芽团含3~4个芽。温度25 ℃,光照1 400 lx,光周期为12 h。培养30 d后,测定其相关生理指标。叶绿素含量采用丙酮提取法测定,可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量采用考马斯亮蓝G-250染色法测定(郝建军 等,2006)。谷氨酰胺合成酶(GS)的活性测定参照Miflin和Lea(1980)的方法。谷草转氨酶(GOT)活性测定参照吴良欢等(1998)提出的植物转氨酶活性比色法进行。每隔7 d测定1次,3次重复。
应用SPSS19. 0统计软件进行数据处理,试验结果采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 甘氨酸浓度对生姜组培苗叶绿素含量的影响
由表1可以看出,叶绿素含量随着生姜组培苗的生长逐渐增多。在培养30、44 d时,处理4和处理5的叶绿素含量显著高于其他处理,处理5与处理4之间差异不显著;在培养37 d时,处理3、处理4、处理5的叶绿素含量显著高于处理1和处理2,处理5与处理3、处理4之间差异不显著;叶绿素含量变化整体趋势表现为随着甘氨酸浓度的增加而上升。
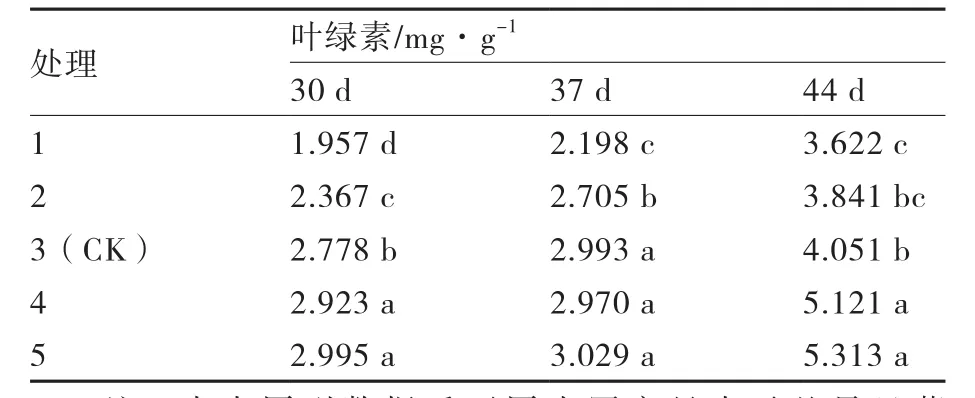
表1 甘氨酸浓度对生姜组培苗叶绿素含量的影响
2.2 甘氨酸浓度对生姜组培苗可溶性糖和可溶性蛋白含量的影响
由表2可以看出,各处理的可溶性糖含量随着生姜组培苗的生长呈增长趋势。30 d时,处理5的可溶性糖含量显著高于其他处理,处理1、2、3、4间差异不显著;在培养37、44 d后,各处理的可溶性糖含量差异显著,且变化趋势表现为随着甘氨酸浓度的增加可溶性糖含量增加;处理5的可溶性糖含量在培养30、37、44 d时,比处理3(对照)分别高0.69、1.14、1.41倍。可溶性蛋白含量随生姜组培苗的生长而上升;各处理可溶性蛋白含量变化趋势与叶绿素含量和可溶性糖含量变化趋势相反,即随着甘氨酸浓度的增加而降低。

表2 甘氨酸浓度对生姜组培苗可溶性糖和可溶性蛋白含量的影响
2.3 甘氨酸浓度对生姜组培苗谷氨酰胺合成酶和谷草转氨酶活性的影响
由表3可看出,谷氨酰胺合成酶(GS)活性随着生姜组培苗的生长而减小,但随着甘氨酸浓度的增加而升高。其中培养30、44 d时,处理2和处理3(对照)的GS活性差异不显著,其他处理与处理3(对照)差异显著;在培养37 d时,处理5和处理4的GS活性显著高于处理1、2、3,但处理4和处理5之间差异不显著,处理1、2之间差异不显著。谷草转氨酶(GOT)活性随着生姜组培苗的生长呈增强趋势;且与GS类似,GOT活性随着甘氨酸浓度的增加而升高,且各处理之间均差异显著。

表3 甘氨酸浓度对生姜组培苗谷氨酰胺合成酶和谷草转氨酶活性的影响
3 结论与讨论
有机氮甘氨酸作为一种小分子氨基酸化合物,可被植物直接吸收和利用(王文颖和刘俊英,2009)。由于本试验是在无菌组培条件下进行的,甘氨酸不会被微生物降解,因此可以认为生姜组培苗在本试验无菌培养条件下只能直接吸收分子态氨基酸,而不是将甘氨酸转化为矿质态氮后才吸收。氨基酸进入植物体后,可通过转氨基、脱氨基作用及其他过程加以同化(陈胜勇 等,2010)。本试验结果表明,随着甘氨酸浓度的增加,生姜组培苗体内的可溶性糖含量和叶绿素含量增加,这与葛体达等(2008)的研究结果一致,说明生姜组培苗能利用有机氮甘氨酸作为营养物质促进其生长。另外,植物在获取有机氮的同时,也获取了有机氮化合物中的碳和能量,因此在氮摄入量相等的情况下,植物的有机氮营养效应比矿质氮营养效应更大,生长更好。至于随着甘氨酸浓度的增加,生姜组培苗可溶性蛋白含量降低,其机理有待进一步研究。
谷氨酰胺合成酶(GS)在高等植物氮代谢中起着重要作用,是氮代谢的关键酶(陈胜勇 等,2010),它在谷氨酸合成酶循环中催化谷氨酸与NH3缩合形成谷氨酰胺,参与植物含氮化合物的新陈代谢(黄冰艳 等,2010)。因此提高GS活性可以提高氮素的同化效率和转移效率,从而提高氮素的利用效率(王小纯 等,2010)。在本试验条件下,随着无菌培养基中甘氨酸浓度的增加,生姜组培苗叶片的GS活性提高,说明甘氨酸能使生姜组培苗氮代谢运转加强,促进氨基酸的合成和转化,有利于生姜组培苗对有机氮甘氨酸的吸收和利用。
谷草转氨酶(GOT)也是高等植物氮同化的关键酶,在植物氮代谢中起着重要作用(王华静,2006)。本试验结果表明,随着甘氨酸浓度的增加,生姜组培苗的GOT活性提高。这或许是因为在外源添加了有机氮甘氨酸后,促进了生姜组培苗体内氨基酸的合成,增加了组织中的氨基酸含量,而某些氨基酸(如谷氨酸)是GOT等转氨酶的底物,从而使其活性增加。
陈胜勇,李观康,汪云,何霭如,陈傲,余小丽.2010.谷氨酰胺合成酶的研究进展.中国农学通报,26(22):45-49.
葛体达,黄丹枫,芦波,唐东梅,宋世威.2008.无机氮和有机氮对水培番茄幼苗碳水化合物积累及氮素吸收的影响.应用与环境生物学报,14(5):604-609.
葛体达,宋世威,姜武,唐东梅,黄丹枫.2009.不同甘氨酸浓度对无菌水培番茄幼苗生长和氮代谢的影响.生态学报,29(4):1994-2002.
郝建军,康宗利,于洋.2006.植物生理学实验技术.北京:化学工业出版社.
黄冰艳,高伟,苗利娟,严玫,张新友,董宝红.2010.谷氨酰胺合成酶基因研究进展及其在植物氮代谢调控中的应用.中国农学通报,26(23):53-57.
王华静.2006.矿质氮、有机氮营养对小白菜生长和品质的影响及机理研究〔博士论文〕.杭州:浙江大学.
王文颖,刘俊英.2009.植物吸收利用有机氮营养研究进展.应用生态学报,20(5):1223-1228.
王小纯,安帅,熊淑萍,程振云,陈新建,孟凡荣,马新明.2010.小麦叶片谷氨酰胺合成酶的分离纯化与鉴定.麦类作物学报,30(1):83-86.
吴良欢,蒋式洪,陶勤南.1998.植物转氨酶(GOT和GPT)活度比色测定方法及其应用.土壤通报,29(3):136-138.
吴良欢,陶勤南.2000.水稻氨基酸态氮营养效应及其机理研究.土壤学报,37(4):464-473.
张青,彭福田,姜远茂,彭勇,周鹏.2005.草莓对不同形态氮素的吸收与分配.园艺学报,32(6):1070-1072.
Behura S.2001.Effect of nitrogen and potassium on growth parameters andrhizomatic characters of mango-ginger.Ind J Agron,46:747-751.
Chapin F S,Moilanen L,Kielland K.1993.Preferential use of organic nitrogen for growth by a non-mycorrhizal arctic sedge.Nature,361:150-153.
Majumdar B,Venkatesh M S,Kumar K,Patiram P.2005.Effect of potassium and farmyard manure on yield,nutrient uptake and quality of ginger(Zingiber officinale) in a typic Hapludalf of Meghalaya.Ind J Agric Sci,75:809-811.
Matsumoto S,Ae N,Yamagata M.2000.Possible direct uptake of organic nitrogen from soigy chingensai(Brassica campestrisL.)and carrot (Daucus carotaL.).Soil Biology & Biochemistry,32:1301-1310.
Mathai C K.2006.The pattern of rhizome yield and their accumulation of commercially important chemical constituents in turmeric during growth and development.Qual Plant,28(3):219-225.
Miflin B J,Lea P J.1980.Ammonia assimilation//Miflin B J.The biochemistry of plants.New York:Academic Press:169-202.
Nasholm T,Ekblad A,Nordin A.1998.Oreal forestplants take up organic nitrogen.Nature,392:914-916 .
Wu L H,Mo L Y,Fan Z L.2005.Absorption of glycine by three agricultural species under sterile stand culture conditions.Pedosphere,15:286-292.
Yamagata M, Ae N.1999.Direct acquisition of organic nitrogen by crops.Japanese Agricultural Resource Quality,33:15-21.

